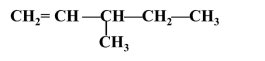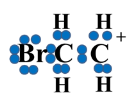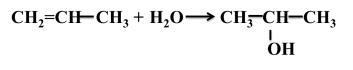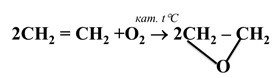Конспект уроку з хімії для 11 (10) класу "Хімічні властивості алкенів. Правило П. П. Марковнікова"
Конспект даного уроку можна використувати в 11 (10) класі для учнів, які дуже люблять хімію, бажають її знати більш поглиблено. Багаторічний досвід показує, що хімія є «пасинком» освіти, не є помітним серед інших природничих наук. Через це нам, вчителям, потрібно зробити все, щоб зацікавити учнів цим предметом.


![]()

Конспект уроку з хімії для 11 класу
Школа: Великодобронська загальноосвітня школа І-ІІІ ступенів
Ужгородської районної ради Закарпатської області
Клас: 11
Тема. Хімічні властивості алкенів. Правило П. П. Марковнікова, механізм реакції приєднання за подвійним зв’язком.
Цілі уроку: формувати в учнів знання про хімічні властивості алкенів; розкрити хімічні властивості ненасичених вуглеводнів на прикладі етену та його гомологів; розкрити механізм реакції приєднання; розвивати навички й уміння складати рівняння хімічних реакцій на прикладі хімічних властивостей алкенів.
Тип уроку: засвоєння нових знань
Форми роботи: фронтальна, індивідуальна, групова
Демонстрації: Горіння етену, взаємодія з бромною водою, розчином калію перманганату.
Обладнання, дидактичні та методичні матеріали: комп’ютер, інтерактивна дошка, проектор, мультимедійна презентація уроку, демонстраційні відео-експерименти, роздатковий матеріал для гри «Доміно», картки для опитування
Вчитель: Молнар Є.І.
Хід уроку
І. Організаційний етап
ІІ. Перевірка домашнього завдання
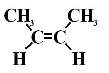
- Назвіть вуглеводні (слайд 2)
|
|
|
|
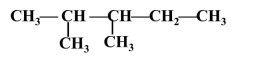
2,3-диметилпентан |
3-метилпент-1-ен |
|
|
|
|
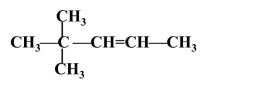
4,4-диметилпент-2-ен |
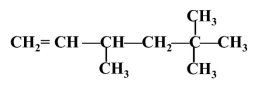
3,5,5-триметилгех-1-ен |
- 2. Розв’яжіть задачу (слайд 3)
|
Масова частка карбону в молекулі вуглеводню дорівнює 85,7%. Густина речовини за киснем 1,75. Визначте молекулярну формулу сполуки. Запишіть структурні формули ізомерів. |
|
|
М(СxНy)= 1,75 ▪ 32= 56 г/моль W(H)=100 – 85,7=14,3%
x:y= x:y= 7,14: 14,3 x:y= 1:2 (CH2)n M((CH2)n )= 14n 14n=56 n=4 C4H8 -бутен |
|
|
Ізомери (слайд 4) |
|
|
|
|
|
бут-1-ен |
бут-2-ен |
|
|
|
|
цис-бут-2-ен |
транс-бут-2-ен |
|
|
|
|
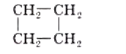
2-метилпроп-1-ен |
циклобутан |
|
|
|
|
метилциклобутан |
|
ІІІ. Актуалізація опорних знань
1. Завдання на картках (індивідуальна робота, додаток №1)
Заповніть таблицю
|
|
Етан |
Етен |
|
Молекулярна формула |
С2Н6 |
С2Н4 |
|
Структурна формула |
|
|
|
σ-зв’язків у молекулі |
7 |
5 |
|
π- зв’язків у молекулі |
0 |
1 |
|
Тип гібридизації атомів карбону |
sp3 |
sp2 |
|
Агрегатний стан |
газ |
газ |
2. Контрольні запитання (фронтальна робота)
- Чим відрізняються насичені та ненасичені вуглеводи?
- До якої їх групи належить етан?
- Який зв’язок між атомами Карбону у алкенів?
- Загальна формула алкенів!
- Що таке гомологічний ряд?
- Що таке гомологічна різниця?
- Складіть молекулярні та структурні формули пропену та бутену!
- Що таке цис-, транс- ізомерія?
- Опишіть фізичні властивості етену!
ІV. Мотивація навчальної діяльності
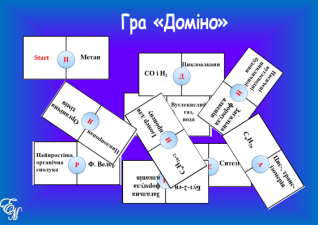
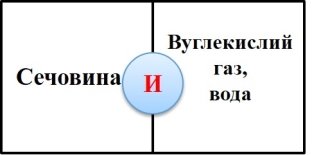
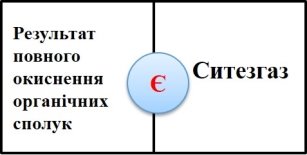
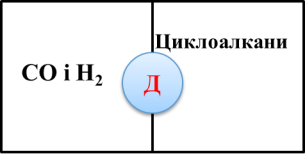
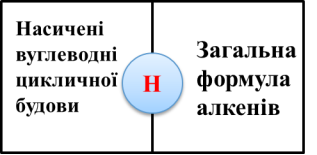
Робота в парах. Гра «Доміно» (додаток №2) (слайд5, 6)
На картках доміно написані поняття. Між ними є відповідність. Знайдіть цю відповідність і в результаті отримаєте ключове поняття уроку. Посередині доміно розташовані букви. Якщо ви добре попрацюєте, отримаєте значуще словo. (наприклад: білий фосфор— отруйний).
|
|
|
Приєднання –ключове поняття уроку. Нагадаємо, що таке реакція приєднання ( із кількох речовин утворюється одна).
V. Визначення теми, мети й завдань уроку (слайд 7, 8)
Мета уроку: розкрити хімічні властивості ненасичених вуглеводнів на прикладі етену та його гомологів; розкрити механізм реакції приєднання;
VІ. Вивчення нового матеріалу
Алкени хімічно активні. Їх хімічна активність зумовлена наявністю подвійного зв’язку. Вони легко вступають в реакції приєднання, окислення, полімеризації.
1. Реакції приєднання
1.1. Гідрування (слайд 9)
|
Алкени легко приєднують водень за наявності каталізаторів (Pt, Ni, Pd). Реакцію приєднання атомів Гідрогену називають реакцією гідрування (гідрогенізації). |
|
|
CH2 = CH2 + H2 → CH3CH3 |
|
|
етен |
етан |
|
Загальний вид |
|
|
CnH2n + H2 → CnH2n+2 |
|
1.2. Галогенування (слайд 10)
|
Алкени при звичайних умовах приєднують галогени, утворюючи дигалогенопохідні алканів. Знебарвлюють бромну воду. |
||
|
Демонстрація : Взаємодія етену з бромною водою (перегдяд відео-демонстрації) |
|
|
|
CH2 = CH2 + Br2 → CH2BrCH2Br |
||
|
етен |
1,2- диброметан |
|
|
Загальний вид |
||
|
CnH2n + X2 → CnH2nX2 X = F, Cl, Br, J – галогени |
||
Механізм реакціїї приєднання між етеном і бромом (слайд 11)
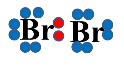
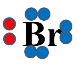
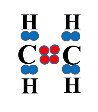
Молекула брому поляризується під впливом негативно зарядженої π-електронної хмари, відбувається гетеролітичний розрив молекули брому:
|
|
+ |
|
→ |
|
+ |
|
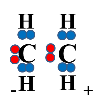
Позитивно заряджений іон Брому приєднується до одного з атомів Карбону й відтягує на себе електронну густину С=С-зв’язку, а сусідній атом Карбону набуває позитивного заряду, перетворюючись на так званий карбкатіон
|
|
+ |
|
→ |
|
|
|
|
|
|
|
|
карбкатіон |
|
|
На другій стадії карбокатіон взаємодіє з негативно зарядженим йоном Брому, при цьому утворюється кінцевий продукт реакції:
|
|
+ |
|
→ |
|
|
|
|
|
|
1,2-диброметан |
Реакції приєднання позначають символом А (від англ. addition – додавання). Отже, реакція електрофільного приєднання до алкенів відбувається за йонним механізмом АЕ – електрофільне приєднання.
1.3. Гідрогалогенування(слайд 12, 13)
|
Алкени здатні приєднувати також гідрогенгалогеніди з утворенням галогенопохідних. Реакція етену відбувається за схемою: |
||
|
CH2 = CH2 + НСl → CH3CH2Cl |
||
|
етен |
хлоретан |
|
|
Загальний вид |
||
|
CnH2n + HХ → CnH2n+1Х X = F, Cl, Br, J – галогени |
||
|
Якщо реагує пропен, то можна припустити утворення двох продуктів реакції: |
||
|
|
||
|
У результаті дослідження подібних реакцій російський хімік В. В. Марковников (1869 р.) сформулював правило, згідно з яким у разі приєднання гідроген галогенідів до несиметричних алкенів атом Гідрогену приєднується за місцем подвійного зв’язку до того атома карбону, що сполучений із більшою кількістю атомів гідрогену. Цю закономірність названо правилом Марковникова. (слайд 14) |
|
|
|
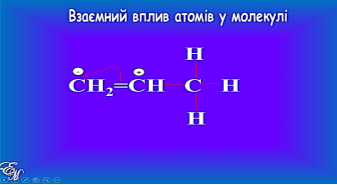
Пояснити дію правила Марковникова можна з позицій взаємного впливу атомів у молекулі. Під упливом подвійного зв’язку метильна група —СН3 виявляє позитивний індукційний ефект, тобто відштовхує від себе електрони σ-зв’язку. В результаті вздовж ланцюга спряжених між собою σ- і π-зв’язків електронна густина рухливого π-зв’язку зміщується до більш гідрогенізованого атома карбону, на якому виникає частковий негативний заряд; подвійний зв’язок поляризується (слайд 15): |
||
|
|
||
1.4. Гідратація (слайд 16)
|
Важливою є реакція алкенів із водою, в результаті якої утворюються спирти. Етен, приєднуючи воду, перетворюється на етанол. |
|
|
CH2 = CH2 + Н2О → CH3CH2ОН |
|
|
етен |
етанол |
|
|
|
|
пропен |
пропан-2-ол |
|
Реакцію приєднання води до речовини називають реакцією гідратації. |
|
2. Окиснення
2.1. Повне окиснення (горіння) ((слайд 17))
|
Демонстрація : Горіння етену (перегдяд відео-демонстрації) |
|
|
|
C2H4 + 3O2 → 2CO2 + 2H2O |
|
Загальний вид |
|
CnH2n + |
2.2. Часткове окиснення (слайд 18)
|
При м’якому окисненні алкенів водним розчином калій перманганату (реакція Вагнера) утворюються двохатомні спирти (фіолетовий розчин калій перманганату швидко знебарвлюється). |
||||
|
Демонстрація: Взаємодія етену розчином калій перманганату (перегдяд відео-демонстрації): |
||||
|
|
||||
|
3СН2=СН2 + 2KMnO4 + 4H2O → 3HOCH2CH2OH + 2MnO2 + 2KOH |
||||
|
етен |
етиленглікол |
|||
|
При окисненні алкенів киплячим розчином калій перманганату в кислому середовищі відбувається повний розрив подвійного зв’язку з утворенням кетонів, карбонових кислот або СО2 (слайд 19): |
||||
|
СН3СН=СНСН2СН3 → СН3СООН + СН3СН2СООН |
||||
|
пент-2-ен |
етанова кислота |
пропанова кислота |
||
|
Якщо змішати алкен з киснем і пропустити цю суміш над нагрітим до +200 С срібним каталізатором, то утворюється алкен оксид (слайд 20): |
||||
|
|
||||
|
етен |
етиленоксид |
|||
|
Оксиран (етиленоксид)- насичена гетероциклічна сполука. Це найпростіший етер. Застосовується в органічному синтезі, зокрема для добування етиленгліколю. |
||||
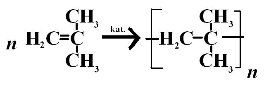
3. Полімеризація (слайд 21)
|
Молекули алкенів здатні сполучатися між собою з утворенням полімерів. У результаті реакції полімеризації етену (етилену) утворюється поліетилен: |
||||||
|
nCH2=CH2 → (CH2CH2)n |
||||||
|
етен |
поліетилен |
|
|
|||
|
|
||||||
|
пропен |
поліпропілен |
|
|
|||
VII. Закріплення нового матеріалу
1. Які реакції характерні для алкенів? (приєднання, окислення, полімеризація)
2. Як очистити етан від домішок етену? Напишіть рівняння реакції.
Суміш етану і етену пропускаємо крізь надлишок бромної води. Бромна вода знебарвлюється.
CH2 = CH2 + Br2 → CH2BrCH2Br
3. Заповніть таблицю (додаток №3), (слайд 22)
|
|
Етен |
Бут-2ен |
|
Молекулярна формула |
С2Н4 |
С4Н8 |
|
Структурна формула |
|
|
|
Реакція з Гідрогеном |
С2Н4+Н2→С2Н6 |
С4Н8+Н2→С4Н10 |
|
Реакція з Хлором |
С2Н4+Сl2→С2Н4Cl2 |
С4Н8+Cl2→С4Н8Cl2 |
|
Реакція з HJ |
С2Н4+HJ→С2Н5J |
С4Н8+НJ→С4Н9J |
|
Горіння |
С2Н4+3O2→2СO2 +2H2O |
С4Н8+5O2→4СO2 + 4H2O |
4. Я знаю..... (слайд 23)
- Реакції взаємодії алкенів з Гідрогеном, галогенами, гідрогенгалогенідами, водою називають реакцією приєднання
- Реакцію приєднання води до речовини називають реакцією гідратації
- Реакцію приєднання атомів Гідрогену називають реакцією гідрування
- Приєднання гідроген галогенідів до несиметричних алкенів атом Гідрогену приєднується за місцем подвійного зв’язку до того атома Карбону, що сполучений із більшою кількістю атомів Гідрогену
- Молекули алкенів здатні сполучатися між собою з утворенням полімерів
VIII. Підбиття підсумків уроку, оцінювання учнів (слайд 24)
- Що означає англійське слово addition?
- Які реакції характерні для алкенів?
- Якісна реакція для алкенів.
- За яким механізмом відбуваються реакції приєднання до алкенів?
- Поясніть правило Марковникова.
IX. Домашне завдання (слайд 25)
- § 10, завдання 82 на сторінці 77 підручника.
- Зробіть проект про життя і творчість В.В. Марковникова
Список використанної літератури, інтернетних джерел
- Л. П. Величко Н. М. Буринська: Підручник для 11 класу загальноосвітніх навчальних закладів (Профільний рівень). Київ « Школяр – 2013.
- Хімія : підруч. для 11 кл. загальноосвіт. навч. закл. із навчанням угорською мовою : академічний рівень / П. П. Попель, Л. С. Крикля ; переклад угорською мовою А. А. Варга. - Львів : Світ, 2011.
- Хімія. Великий довідник для школярів та абітурієнтів. «Навчальна книга Богдан», 2001.
Додаток №1
Заповніть таблицю
|
|
Етан |
Етен |
|
Молекулярна формула |
|
|
|
Структурна формула |
|
|
|
σ-зв’язків у молекулі |
|
|
|
π- зв’язків у молекулі |
|
|
|
Тип гібридизації атомів карбону |
|
|
|
Агрегатний стан |
|
|
Додаток №2
Гра «Доміно»
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Додаток №3
Заповніть таблицю
|
|
|
|
|
Молекулярна формула |
|
|
|
Структурна формула |
|
|
|
Реакція з Гідрогеном |
|
|
|
Реакція з Хлором |
|
|
|
Реакція з HJ |
|
|
|
Горіння |
|
|
1


про публікацію авторської розробки
Додати розробку