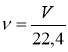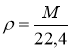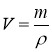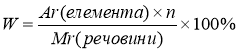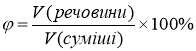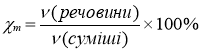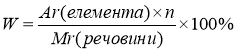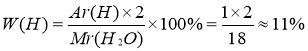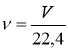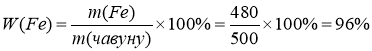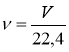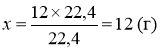Збірник задач з хімії для підготовки до олімпіад
Збірник задач з хімії, створений на основі багаторічного досвіду підготовки учнів і студентів до участі у Всеукраїнській олімпіаді з хімії. Розглянуті основні типи задач, запропонована методика їх вирішення, наведені задачі для самостійного розв'язування.

РОЗВ'ЯЗУВАННЯ ЗАДАЧ З ХІМІЇ
Типи задач з хімії
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10.Виведення формули речовини за продуктами згорання |
|
|
|
|
|
|
|
|
|
НАЙВАЖЛИВІШІ ХІМІЧНІ ВЕЛИЧИНИ
|
|
кількість речовини |
[моль] |
|
m |
маса |
[г] |
|
V |
об’єм |
[л] |
|
M |
молярна маса |
[г/моль] |
|
Mr |
відносна молекулярна маса |
– |
|
ρ |
густина |
[г/л] |
НАЙУЖИВАНІШІ ХІМІЧНІ ФОРМУЛИ
|
1) |
m = М; |
без цієї формули не обходиться майже жодна задача |
|
2) |
М = Mr |
це не принципово, але бажано вказати |
|
3) |
V = 22,4
|
лише для газів і лише для нормальних умов: температура - 0ºС, або 273К тиск – 101,3 кПа, або 1 атмосфера |
|
4) |
|
рівняння стану ідеального газу, яке дозволяє вести розрахунки, якщо умови відрізняються від нормальних
R = 8,31 |
|
5) |
М = ρ×22,4 |
лише для газів, це вивід з формул 1), 2), 3) |
|
6) |
m = ρ×V
|
ця формула пов’язує маси з густиною та об’ємом, взагалі то це фізична формула |
|
7) |
М (Х) = Дх/У×М(У); М (повітря) = 29 |
Визначення відносної густини одного газу (Х) за другим (У) |
|
8) |
а)
б)
в)
г) |
універсальна формула, яка дозволяє визначити масову частку елемента в складній речовині (а), масову частку речовини в суміші (в тому числі в розчині) (б), об’ємну (в) або молярну (г) частку.
! Для газів: φ=χm |
1. Визначення масової частки елемента в речовині
W – масова частка елемента [%]
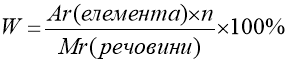 , де
, де
Аr( елемента ) – відносна атомна маса елемента ,
n – кількість атомів елемента , що входять до складу молекули (індекс)
Мr ( речовини ) – відносна молекулярна маса речовини .
Задача І.
Визначити масову частку Гідрогену і Оксигену у складі води .
|
W ( Н ) - ? W ( О ) - ?
|
Розв’язання:
Мr ( Н2О ) = 12+16 = 18
W ( О ) = 100% - 11% = 99% |
Відповідь : W ( Н ) = 11% , W ( О ) = 99%
Задача ІІ.
Яка руда більш вигідна для отримання заліза:
магнітний залізняк – Fе3О4; червоний залізняк – Fе2О3; бурий залізняк – 2 Fe2О3 3Н2О; шпатовий залізняк – FеСО3; пірит – FеS2 ?
|
Fе3О4 Fе2О3 2 Fe2О3 3Н2О FеСО3
W (Fе) - ?
|
Розв’язання: Більш вигідною для виплавки заліза є та руда, яка містить більшу масову частку Феруму.
Mr ( Fе3О4 ) = 563+164=232 Mr( Fе2О3) = 562+163=160 Mr(2Fe2О33 Н2О)=2(562+163)+3(12+16)=374 Mr(FеСО3 )=56+12+163=116 Mr(FеS2) = 56+322=120 W1 (Fe в Fе3О4)=563/232 100%=72% W2( Fe в Fe2О3)=562/160 100%=70% W3(Fe в 2Fe2О3 3Н2О)=564/374 100%=60% W4(Fe в FеСО3)=56/116 100%=50% W5(Fe в FеS)=56/120 100%=46% |
Відповідь : найбільш вигідною для виплавки заліза є магнітний залізняк - Fе3О4, який містить 72% Феруму.
Розв’яжіть самостійно :
1.Визначити масову частку елементів у крейді – СаСО3.
(Відповідь : Са – 40%, С – 12%, О – 48% )
2. Яке з азотних добрив: натрієву селітру (NаNО3), чи аміачну селітру (NН4NО3) вигідніше придбати фермеру враховуючи, що ціна аміачної селітри вдвоє вища ?
(Відповідь : NН4NО3).
2. Визначення числа атомів ( молекул ), маси , об’єму
за відомою кількістю речовини
N = 6 1023
m = М
V = 22,4 , де
N – кількість частинок ( атомів , молекул )
m – маса г
V – об’єм л
М – молярна маса г/ моль
– кількість речовини моль
Звідки :
![]()
![]()
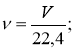
Кількість речовини пов’язує між собою масу, об’єм та кількість частинок речовини .
Задача І.
Скільки атомів та молекул міститься в чайній ложці води масою 9 г ?
|
Nатомів - ? Nмолекул - ?
|
Розв’язання:
М ( Н2О )= Мr ( Н2О ) = 12+16 = 18 (H2O) = 9/18=0,5 (моль) Nмолекул=0,5610 = 31023 , оскільки кожна молекула води складається з 3 атомів, то Nатомів=3Nмолекул=331023 =91023 |
Відповідь : Nмолекул=31023 , Nатомів=91023 .
Задача ІІ.
Яку масу має повітря, що знаходиться в кімнаті, яка має розміри 563 м ?
|
а = 5м b = 6м
mповітря-? |
Розв’язання:
m = М ; М = Мг ; V(кімнати) = a bc , V(повітря) =563 = 90 (м3) Примітка: якщо об’єм газу вимірюється в м3, то його маса вимірюється в кілограмах, а - в кіломолях. Мr ( повітря ) = 29 (довідникова величина) повітря = 90 /22,4 = 4 кмоль mповітря= 429 = 116 кг |
Відповідь: mповітря=116 кг
Розв’яжіть самостійно :
1.В якій масі натрію міститься стільки ж атомів, як і в 40г Са ?
(Відповідь: m ( Na ) = 23г )
2.Алмаз масою 1 карат (0,2г) коштує біля 1000 грн. Скільки атомів С цього алмазу можна купити на 1 копійку?
(Відповідь: 1×1017 атомів)
3. Визначення відносної густини газів
Відносна густина - Д двох газів ( Х та У ) визначається відношенням їх молярних мас (М = Мr)
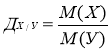
Наприклад :
Д о2/н2 = 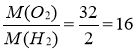
тобто кисень важчий за водень у 16 раз.
М повітря = 29
Порівнявши М газу з М повітря, можна визначити, важчий цей газ за повітря, чи легший .
Задача І.
Визначте відносну густину вуглекислого газу і повітря.
|
повітря
Д со2/повітря - ?
|
Розв’язання:
М (повітря) = 29 М (СО2) = Мr (СО2) = 12 + 162 = 44 Д со2/повітря = 44 / 29 = 1,5 |
Відповідь: Д о2/повітря =1,1; Д н2/повітря =0,07; Д со2/повітря=1,5
Розв’яжіть самостійно :
1. Пара білого фосфору має густину за воднем 62 . Яку молекулярну формулу має білий фосфор ?
(Відповідь : Р4)
2. Яка молярна маса газу, якщо його густина за воднем – 35,5. Що це за газ ?
(Відповідь: М(газу) = 71, це-хлор )
4. РОЗРАХУНКИ ЗА ХІМІЧНИМИ РІВНЯННЯМИ
Алгоритм розв’язування задач
- Записуємо скорочену умову задачі .
- Складаємо рівняння реакції .
- Визначаємо даної речовини за формулою :
= m / M , або = V / 22,4
4. Визначаємо шуканої речовини за рівнянням реакції, враховуючи коефіцієнти .
5. Знаходимо масу ( об’єм ) шуканої речовини
m = М , V = 22,4
- Записуємо відповідь.
Задача І.
Який об’єм водню отримаємо в результаті електролізу ( розкладання електричним струмом ) склянки води масою 250 г ?
|
V (Н2) - ? л
|
Розв’язання: 2 Н2О = 2 Н2 + О2 Мr (Н2О) = 12+16 = 18
(Н2О) = 250 : 18 13,9 (моль) V = 22,4 V (Н2) = 13,922,4 311 ( л )
|
Відповідь : V (Н2) 311 л
Задача ІІ.
1. Який об’єм вуглекислого газу можна добути , випаливши 200 кг вапняку ?
|
V (СО2) - ?м3
|
Розв’язання: СаСО3 = СаО + СО2
М (СаСО3) = Мr (СаСО3) = 40+12+16×3 = 100 (г/моль) 200/100 = 2кмоль (СО2) = (СаСО3) = 2кмоль V = 22,4 V (СО2) = 22,4 = 222,4 = 44,8 м3 |
Відповідь: V (СО2) = 44,8 м3
Задача ІІІ.
Яку масу води слід піддати електролізу, щоб отримати 10 л водню?
|
m (Н2О) = ? г
|
Розв’язання: 2 Н2О = 2 Н2 + О2
(Н2) = 10/22,4 0,45 (моль) (Н2О) = (Н2) 0,45 (моль) m = М m (Н2О) 0,45×18 8 ( г ) |
Відповідь: m (Н2О) 8г
Задача ІV.
Яку масу чадного газу (СО) можна окиснити до вуглекислого (СО2) киснем, утвореним при розкладанні 61,25г бертолетової солі КСlО3?
|
m (СО) - ? л
|
Розв’язання: 2КСlО = 2КСl + 3О2 СО + 1/2О2 = СО2 Складаємо стехіометричну схему: 2КСlО3 → 3О2 → 6СО2 КСlО3 → 3СО2 М (КСlО3) = Мr (КСlО3) = 39+35,5+16×3=122,5
(КСlО3) = 61,25/122,5 = 0,5 (моль) (СО) = 3 (КСlО3) = 1,5 (моль) m = М М (СО) = Мr (СО) = 12+16 = 28 (г/моль) m (СО) = 1,5×28 = 42 (г) |
Відповідь: m (СО) = 42г
Задача V.
Чи вистачить 15л кисню для спалювання 15г фосфору?
|
m (Р) = 15,5 г
V1 (О2) - ? л
|
Розв’язання: 4Р + 5О2 = 2Р2О5
(Р) = 15/31 ≈ 0,5 (моль) (О2) = 1,25 (Р) ≈ 0,625 (моль) V = 22,4 V (О2) ≈ 0,625×22,4 ≈ 14 ( л ) 15л 14л |
Відповідь: 15 л кисню вистачить для спалювання 15 г фосфору.
Розв’яжіть самостійно:
1. Розрахуйте масу води, якщо при розкладі її електричним струмом виділився водень кількістю речовини 4 моль.
(Відповідь: m (Н2О) = 72г)
2. Який об’єм водню виділиться при взаємодії 13 г цинку з соляною кислотою?
(Відповідь: V (Н2) = 4,48л)
3. Яка кількість речовини кисню утвориться при розкладанні 8,68г меркурій (ІІ) оксиду, яка маса та об’єм цього кисню?
(Відповідь : ν (О2) = 0,02моль, m (О2) = 0,64г, V (О2) = 0,448л.)
3. Розрахуйте масу алюмінію, що прореагує з сіркою масою 4,8г. Яка маса алюміній сульфіду утвориться?
(Відповідь: m (Al) = 2,7г, m (Al2S3) = 7,5г)
4. Залізо реагує з хлором з утворенням ферум (ІІІ) хлориду. Визначте відношення мас реагентів.
(Відповідь: 56:106,5)
5. Магній масою 12г спалили у кисні масою 24г. Яка маса магній оксиду утворилася? Чи залишилася після реакції одна з вихідних речовин? Якщо так, то обчисліть масу її залишку.
(Відповідь: m(МgО)=20г, m(О2)=16г)
6. Чи вистачить 20л кисню для спалювання 32г сірки ?
(Відповідь: не вистачить, необхідно 22,4л кисню)
7. Під час нагрівання нітроген (ІV) оксиду масою 2,3г утворилося 1,2г нітроген (ІІ) оксиду і кисень. Визначте масу кисню. Чи зазнала вихідна речовина повного перетворення? Якщо так, то обчисліть масу її залишку.
(m(О2)=0,64г, m(NО2)=0,46г)
8. Змішали 140г негашеного вапна (СаО з домішками) і воду. Утворилося 148г гашеного вапна (Са(ОН)2). Визначте масову частку СаО в негашеному вапні.
(W(Са(ОН)2=80%)
5. Визначення масової частки речовини в суміші
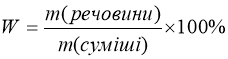 , де
, де
W – масова частка речовини , звідки
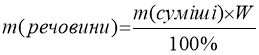
Задача І
Чавунна деталь масою 500г містить 480г заліза. Який вміст заліза в чавуні?
|
m (чавуну) = 500 г
W ( Fe ) - ?
|
Розв’язання:
|
Відповідь : W( Fe ) = 96 %
Задача ІІ
Бронза містить 90% міді і 10% олова. Які маси міді і олова необхідно взяти для виплавки 550 г бронзи?
|
m (бронзи) = 550 г W (Cu) = 90%
m (Cu) - ? m (Sn) - ? |
Розв’язання:
m (Sn)= m (бронзи) - m (Cu) = 550 – 495 = 55 (г) |
Відповідь: m (Cu) = 495 г, m (Sn) = 55 г.
Розв’яжіть самостійно.
1.Який склад сплаву, отриманого сплавлянням 10г олова і 40г міді ?
(Відповідь : W(Sn) = 20% , W(Сu) = 80%).
2. Мідна руда вважається бідною, якщо містить менше 2% Купруму і багатою, якщо вміст Купруму більше 4%. Якою є руда, якщо 1 тонна її містить 45 кг Сu? (Відповідь: W(Сu)=4,5%; руда багата)
6. Розрахунки за хімічними рівняннями, якщо вихідна речовина містить домішки
Це – комбінація задач двох попередніх типів. Спочатку необхідно визначити масу (об’єм, кількість речовини) вихідної речовини, а потім вести розрахунки за хімічними рівняннями.
Задача І.
Яку масу вуглекислого газу можна добути , випаливши 20кг вапняку (СаСО3 з домішками), що містить 25% домішок?
|
m(вапняку) = 20кг
m(СО2) - ?
|
Розв’язання: 1) Знаходимо масу СаСО3:
m(СаСО3) = 20-5 = 15(кг) 2) Ведемо розрахунки за хімічним рівнянням: СаСО3 = СаО + СО2 Мr(СаСО3) = 40+12+163 = 100 Мr(СО2) = 12+162 = 44
ν(СаСО3) = ν(СО2) = ν(СаСО3) = 150моль m(СО2) = ν×М = 150×44 = 6600(г) = 6,6(кг) |
Відповідь : m(СО2) = 6,6кг
Розв’яжіть самостійно:
1. Який об’єм кисню витратиться на спалювання 120 г вугілля, яке містить 10% негорючих домішок?
2. Який об’єм повітря витратиться на спалювання 120г коксу (вважати, що кокс містить лише Карбон)?
7. Розрахунки за хімічними рівняннями, якщо одна з речовин дана в надлишку
Якщо в умові задачі наведені дані про обидві речовини, що вступили в реакцію, визначаємо кількість речовини кожної з них, за рівнянням реакції визначаємо, яка з речовин у надлишку, а розв’язання ведемо по тій, яка повністю прореагує.
Алгоритм розв’язування задач
|
Розрахунки за хімічними рівняннями |
Розрахунки за хімічними рівняннями, якщо одна з речовин дана в надлишку |
|
1. Записуємо скорочену умову задачі. 2. Складаємо рівняння реакції. 3. Визначаємо даної речовини:
4. Визначаємо шуканої речовини за рівнянням реакції, враховуючи коефіцієнти. 5. Знаходимо масу (об’єм) шуканої речовини. m = М , V = 22,4 6. Записуємо відповідь. |
1. Записуємо скорочену умову задачі. 2. Складаємо рівняння реакції. 3. Визначаємо кожної з даних речовин:
! Порівнюємо даних в умові речовин і розв’язання ведемо по тій, якої менша! 4. Визначаємо шуканої речовини за рівнянням реакції, враховуючи коефіцієнти. 5. Знаходимо масу (об’єм) шуканої речовини. m = М , V = 22,4 6. Записуємо відповідь. |
Задача І.
Яка маса ферум (ІІ) сульфіду утвориться при взаємодії 8 г заліза і 8 г сірки?
|
m(Fе) = 8г
m(FеS) - ?
|
Розв’язання: Fе + S = FеS
(Fе) =
( S) = 0,14 0,25 Сірка у надлишку, розв’язання ведемо по залізу. (FеS) = (Fе) = 0,14 моль m(FеS) = М = 0,1488 = 12г |
Відповідь : m(FеS) = 12г
Задача ІІ.
Яка маса осаду утвориться при взаємодії 600 г 2,85 %-вого розчину алюміній сульфату та 1 кг 7,22 %-вого розчину барій нітрату ?
|
m(р-ну Аl2 (SО4)3) = 600г W(р-ну Аl2 (SО4)3) =2,85% m(р-ну Ba(NO3)2) = 1000г
m(осаду) - ? |
Розв’язання: Аl2 (SО4)3+3Ba(NO3)2 = 3ВаSО4+ 2Аl(NО3)3 1) Знаходимо маси Аl2 (SО4)3 та Ba(NO3)2
|
|
2) Знаходимо ν Аl2 (SО4)3 та Ba(NO3)2
Мr( Аl2 (SО4)3) = 272+(32+164)3 = 342; (Аl2 (SО4)3) =
Мr(Ba(NO3)2) =137+(14+163)2 = 261; (Ba(NO3)2) = Згідно з рівнянням реакції ν(Аl2 (SО4)3) відноситься до (Ba(NO3)2) як 1: 3, тобто на 1 моль Аl2 (SО4)3 має припадати 3 моль Ba(NO3)2, а на 0,05 моль Аl2 (SО4)3 має припадати 3× 0,05= 0,15 моль Ba(NO3)2. (Ba(NO3)2) у надлишку, розв’язання ведемо по Аl2(SО4)3 (ВаSО4) = 3(Аl2 (SО4)3) =30,05 = 0,15моль Мr(ВаSО4)=137+32+164=233 m(ВаSО4) = ×М = 0,15233 =34,95г |
|
Відповідь : m(ВаSО4) = 34,95г
Задача ІІІ.
Через розчин КОН масою 240г з масовою часткою КОН - 14 % пропустили 0,35 моль вуглекислого газу. Визначте кількість речовини утворених солей.

|
Дано : m(р-ну КОН) = 240г W(КОН) =14% (СО2) = 0,35моль (солі1) - ? (солі2) - ? |
Розв'язання:
m(КОН) = Мr(КОН) = 39+16+1 = 56
(КОН) =
|
(1) КОН + СО2 = КНСО3 (калій гідрокарбонат)
(2) КНСО3 + КОН = Н2О + К2СО3 (калій карбонат)
Згідно з рівнянням (1) в реакцію вступає 0,35моль КОН і 0,35 моль СО2, утворюється 0,35 моль КНСО3 і залишається 0,6-0,35=0,25 моль КОН.
Надлишок КОН, кількістю речовини 0,25 моль вступає в реакцію згідно з рівнянням (2). В реакцію вступають 0,25 моль КОН і 0,25 моль КНСО3, утворюється 0,25 моль К2СО3 і залишається 0,35-0,25=0,1 моль КНСО3.
Відповідь : (КНСО3) = 0,1моль , (К2СО3) = 0,25 моль.
8. Розрахунки за хімічними рівняннями з врахуванням виходу продукту реакції
Маса (об’єм) продукту реакції, розраховані за хімічним рівнянням, є теоретичними і позначаються mт (Vт).
На практиці маса (об’єм) продукту реакції, як правило, є меншими за теоретично розраховані, і носять назву практичних mпр(V пр).
Вихід продукту реакції – відношення маси (об’єму) практичної до маси (об’єму) теоретичної, виражене у відсотках.
![]()
Задача І.
Обчисліть масу гашеного вапна ( Са(ОН)2) , отриманого з 112 г негашеного вапна ( СаО) , якщо вихід продукту реакції становить 90 %.
|
m(СаО)= 112 г W(вихід) = 90 % mпр. ( Са(ОН)2) - ? |
СаО + Н2О = Са(ОН)2 Мr (СаО) = 40+16=56 Мr (Са(ОН)2)=40+(16+1)х2=74
|
(СаО)= ![]()
(Са(ОН)2)= (СаО)= 2 моль
m(Са(ОН)2)= М= 2х74=148 г
![]()
Відповідь: mпр(Са(ОН)2)=113,2 г
Розв’яжіть самостійно.
1.Обчисліть масу сульфатної кислоти, яка утвориться внаслідок реакції між 40г SО3 та водою, якщо вихід продукту реакції становить 80 %.
(Відповідь: m(Н2SО4)=39,2г).
9.Виведення формули речовини за масовими частками елементів
Алгоритм розв’язування задач
1.Записуємо загальну формулу речовини, позначивши індекси через х, y, z…
2.Визначаємо масову частку (масу) кожного елемента.
3.Знаходимо кожного елемента:
![]()
4.Складаємо пропорцію: х : у = (Х) : (Y), приводимо всі ν до цілих чисел.
5.Записуємо найпростішу формулу.
6.Якщо наведена відносна молекулярна маса шуканої речовини, або її можна визначити за відносною густиною за іншим газом:
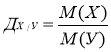
М (Х) = Дх/у×М(У); М (повітря) = 29
порівнюємо її з Мг речовини, формулу якої визначили.
Задача І.
Речовина містить 75% Карбону та 25% Гідрогену. Визначте її формулу.
|
W (C) = 75%
формула - ?
|
Розв’язання: 1) СхНу 2) нехай m(С) = 75г, тоді m(Н) = 25г.
3) (С) =
(Н) = х : у = 6,25 : 25 = 1 : 4 СН4 – шукана формула. |
Відповідь: СН4
Задача ІІ.
Масове співвідношення Аl : S : О = 9 : 16 : 32. Визначте формулу речовини.
|
Дано :
формула - ? |
1) АlхSуОz 2) якщо m(Аl) = 9г, то m(S) = 16г, m(О) = 32г |
|
3) 4) х : у : z = 0,33 : 0,5 : 2 = 2 : 3 : 12 5) Аl2S3О12 , або Аl2(SО4)3 |
|
Відповідь : Аl2(SО4)3
Задача ІІІ*.
Масове співвідношення елементів у складі солі Ме : Н : О : S = 11,17 : 2,8 : 35,2 : 6,4. Визначити формулу солі.
1) МехНуОzSn
2) нехай m (Ме) = 11,17 г , тоді
m (Н) = 2,8 г , m (О) = 35,2 г, m (S) = 6,4 г.
3) ![]() ;
; 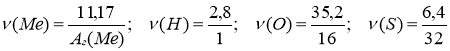
4) х : у : z : n : = 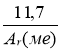 : 2,8 : 2,2 : 0,2 =
: 2,8 : 2,2 : 0,2 =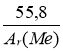 : 14 : 11 : 1
: 14 : 11 : 1
припустімо , що х = 1, тоді 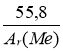 = 1, Аг (Ме) = 55,85 , це - Fе
= 1, Аг (Ме) = 55,85 , це - Fе
5) FеН14О11S , або FеSО4·Н2О
Відповідь : FеSО4·Н2О
Розв’яжіть самостійно:
1.Визначте формулу сполуки, яка складається з Sі та О у співвідношенні 7 : 8.
(Відповідь: SіО2 )
2.В результаті розкладання меркурій (ІІ) оксиду масою 2,17г отримали 0,16 г кисню. Яка формула речовини? (Відповідь: НgО)
10. Виведення формули речовини за продуктами згорання
Алгоритм.
1.Записуємо загальну формулу речовини. Якщо це органічна речовина загальна формула: СхНу, або СхНуОz.
2.Визначаємо масу кожного елемента за рівнянням реакції.
Якщо це органічна речовина :
а) визначаємо масу С за рівнянням С + О2 = СО2
б) визначаємо масу Н за рівнянням 2Н2 + О2 =2Н2О
в) визначаємо масу О , як різницю маси речовини та мас С та Н.
3.Знаходимо кожного елемента:
![]()
4.Складаємо пропорцію: х: у: z = (Х) : (У) : (Z), приводимо всі до цілих чисел.
5.Записуємо найпростішу формулу .
6.Якщо наведена відносна молекулярна маса шуканої речовини , порівнюємо її з Мr речовини, формулу якої знайшли.
Задача І.
При спалюванні 23 г деякої органічної речовини утворилося 22,4 л СО2 та 27 г Н2О. Визначте формулу сполуки , якщо її Мr = 46.
|
V (СО2) = 22,4 л
формула - ? |
х г 22,4 л 2а) С + О2 = СО2 ; 12 г 22,4 л
|
у г 27 г
2б) 2 Н2 + О2 = 2 Н2О
4 г 36 г
![]() - маса Н
- маса Н
2в) m(О) = 23 – (12+3) = 8 г
3) (С) = 12:12 = 1 моль
(Н) = 3:1 = 3 моль
(О) = 8:16 = 0,5
4) х : у : z = 1 : 3 : 0,5 = 2 : 6 : 1
5) С2Н6О – найпростіша формула
6) Мr (С2Н6О) = 122+16+16 = 46
46 = 46
С2Н6О – шукана формула
Відповідь : С2Н6О – шукана формула
Розв’яжіть самостійно:
1. При спалюванні 13 г деякого газу отримали 22,4 л СО2 і 9 г Н2О. Визначте формулу невідомого газу, якщо його густина за воднем а) 13; б) 39.
11. Визначення невідомого елемента за складом сполуки
Алгоритм
1.Записуємо загальну формулу сполуки, якщо валентність елемента не вказано, приймаємо її рівну І
2.Знаходимо масову частку (W) елемента.
3.Знаходимо відносну атомну масу (Аr) елемента
4.Послідовно домножуємо Аr і валентність на
2, 3…7, і знаходимо невідомий елемент.
! іноді валентність = 8/3 ( наприклад, Fе3О4)
Задача І.
Сполука деякого елемента з Сульфуром містить
50 % S. Що це за елемент ?
ІІ ІІ
1) Е S ( для сульфідів та оксидів зручніше починати з валентності ІІ )
2) W (Е) = 100% - 50% = 50%
3) Аr (S) = 32 W (S) = 50%
Аr (Е) = х W (Е) = 50%
![]() ; х = 32
; х = 32
4) валентність Аг
ІІ 32
І 16 SО2
ІІІ 48
ІУ 64 СuS2
Відповідь: О, або Сu
Задача ІІ.
Оксид деякого елемента містить 27,6% О. Яка формула оксиду ?
ІІ ІІ
1) Е О
2) W (Е) = 100% - 27,6% = 72,4%
3) Аr (О) = 16 W (О) = 27,6%
Аr (Е) = х W (Е) = 72,4%
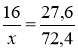 ;
; 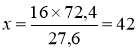
4) валентність Аr
ІІ 42
І 21
ІІІ 63
ІУ 84
У 105
УІ 126
УІІ 147
8/3 56 Fе
Відповідь : Fе3О4
Розвяжіть самостійно.
1. Воднева сполука елемента містить 11,11% Н. Формула -?
( Відповідь : Н2О )
2. Сполука масою 10 г містить 7 г Феруму . Формула - ?
( Відповідь : Fе2О3
12. Знаходження невідомого елемента за рівнянням реакції
Алгоритм
1. Записуємо рівняння реакції, якщо валентність невідомого елемента не вказана, приймаємо її рівну І.
2.Виконавши розрахунки за рівнянням реакції, знаходимо ν невідомого елемента (або сполуки, до складу якої він входить ).
3.Знаходимо відносну атомну масу (Аr) елемента
4.Послідовно домножуємо Аr і валентність на 2, 3…7, і знаходимо невідомий елемент.
! іноді валентність = 8/3 ( наприклад, Fе3О4).
Задача І.
34,25 г металу прореагувало з кислотою. При цьому виділилося 5,6 л водню. Що це за метал?
І І
1)Ме + НСl = МеСl + ½ Н2
2) 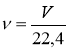 ;
; 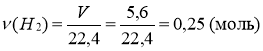
(Ме) = 2 (Н2) (відповідно до рівняння реакції).
(Ме) = 0,25×2 = 0,5 (моль)
3) Аг (Ме) = 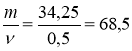
4) валентність Аr
І 68,5
ІІ 137 Ва
Відповідь : Ва.
Задача ІІ.
4 г оксиду невідомого елемента повністю прореагувало з 25 г розчину НСl в якому W (НСl) = 29,2%. Що це за елемент ?
ІІ ІІ
1) Е О + 2 НСl = ЕСl2 + Н2О
2) m (НСl) = ![]()
(НСl) = 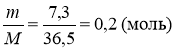
(ЕО) = ½ ν (НСl) (згідно з рівнянням реакції )
(ЕО) = ½0,2 = 0,1 (моль)
3) М (ЕО) = 
М (ЕО) = Аr (Е) + Аr (О) = Аr (Е) + 16 , звідки
Аr (Е) = 40 – 16 = 24
4) валентність Аr
ІІ 24 Мg
Відповідь : Мg
Розв’яжіть самостійно:
На розчинення 2,06 г гідроксиду тривалентного металу витратили 30 мл 1М розчину Н2SО4. Що це за метал ?
( Відповідь : Сr )
13. Задачі на реакцію обміну між металом і сіллю
Алгоритм
1. Записуємо рівняння реакції .
2. Визначаємо масу металу до і після реакції .
3.Визначаємо, як змінилася маса металу в результаті реакції .
4.Складаємо і розв’язуємо пропорцію .
Задача І.
Алюмінієву пластинку опустили в розчин залізного купоросу ( FеSО4) . Маса пластинки збільшилася на 2 г . Яка маса заліза осіла на пластинці ?
1) 2 Аl + 3 FеSО4 = Аl2(SО4)3 + 3 Fе
2) m(Аl) = М = 227 = 54 г
m(Fе) = М = 356 = 168 г
3) m = m (Fе) – m(Аl) = 168 –54 = 114 г
4)m (Fе) m
168 г 114 г
х г 2 г
![]()
Відповідь : м (Fе) = 3 г.
Задача ІІ.
Пластинку з невідомого металу опустили в мідний купорос (СuSО4·5Н2О), її маса збільшилася на 0,8%, а коли таку ж пластинку опустили в ляпіс (АgNО3), її маса збільшилася на 16%. Валентність металу – ІІ. Що це за метал?
ІІ ІІ
1) Ме + СuSО4 = МеSО4 + Сu
ІІ ІІ
Ме + 2 АgNО3 = Ме(NО3)2 + 2 Аg
2) m(Ме) = М, якщо Аr(Ме) = х ,
то m (Ме) = х г
m (Сu) = M = 164 = 64 г
m (Аg) = M = 2107 = 214 г
3 ) m1 = m (Сu) – m (Ме) = 64 – х
m2 = m (Аg) - m (Ме) = 216 – х
4) m %
64 – х 0,8%
216 – х 16%
![]() ; х=56, це – Fе
; х=56, це – Fе
Відповідь : Fе
Розв’яжіть самостійно .
1. Дві однакові пластинки з невідомого металу опустили в розчини СuSО4 та FеSО4 . Маса першої пластинки стала в 1,25 раза більша ніж маса другої. Що це за метал ?
( Відповідь : Мg )
14. Задачі на суміші
Алгоритм
1. кожного компонента суміші позначаємо через х , у , z ...
2. Якщо дано масу суміші, складаємо рівняння :
М (Х)х+М (У)у+ ... = m суміші ,
де М(Х) , М(У) - молярні маси компонентів суміші.
3. Якщо дано об’єм суміші, визначаємо кількість речовини суміші ( = V/22,4) і складаємо рівняння: х + у + .. = суміші .
4. Якщо суміш вступає в хімічну реакцію ,
а) записуємо рівняння реакції ,
б) визначаємо ν продукту реакції, за рівнянням реакції ,
в) визначаємо у продукту реакції за формулами :

г) складаємо рівняння : (б) = (в)
5. Складаємо систему рівнянь , розв’язуємо її , знаходимо у кожного компонента суміші .
6. Якщо необхідно знайти склад суміші, визначаємо масові частки компонентів:
m = М , 
Задача І.
Визначити склад суміші КОН і Са(ОН)2 , якщо на її нейтралізацію витрачається 21,9 г НСl .
1) нехай (КОН) = х моль , (Са(ОН)2) = у моль .
2) Мr (КОН) = 39+16+1 = 56
m (КОН) = 56х
Мr (Са(ОН)2) = 40+(16+1)2 = 74
m (Са(ОН)2) = 74у
56х + 74у = 26 (г)
3) -
4а) КОН + НСl = КСl + Н2О (1)
Са(ОН)2 + 2 НСl = СаСl2 + 2 Н2О (2)
4б) (НСl) = (КОН) = х моль (1)
(НСl) = 2 (Са(ОН)2) = 2у моль (2)
(НСl) = х + 2у (моль)
4в) (НСl) = 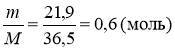
4г) х + 2у = 0,6 (моль)
![]() 5) 56х + 74у = 25
5) 56х + 74у = 25
х + 2у = 0,6
х = 0,2 моль , у = 0,2 моль
6) m (КОН) = 0,256 = 11,2 г
W (КОН) = ![]()
W (Са(ОН)2) = 100% - 43% = 57%
Відповідь : W (КОН) = 43% , W (Са(ОН)2) = 57%
Розв’яжіть самостійно.
1. 1,3 г сплаву , що містить Sn і Zn , обробили соляною кислотою . При цьому виділилося 368,1 мл водню . Який склад сплаву ?
( Відповідь : W (Zn) = 60% , W (Sn) = 40% )
1


про публікацію авторської розробки
Додати розробку