Конспект уроку з хімії для 7 класу на тему: "Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі. Ознайомлення з періодичною системою хімічних елемент"
№ 8
Дата: ________________
Тема: Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі. Ознайомлення з періодичною системою хімічних елементів.
Очікувані результати: учень називає хімічні елементи (не менше 20-ти) за сучасною науковою українською номенклатурою, записує їхні символи; найпоширеніші хімічні елементи в природі;
Методи навчання: словесні, наочні.
Тип уроку: комбінований.
Клас: 7 клас.
Обладнання: ПСХЕ Д. І. Менделєєва.
Хід уроку
I. Організаційна частина
II. Перевірка домашнього завдання.
Заслуховуємо спосіб розділення суміші сіль + вода + залізні ошурки.
(Фільтрування, дистиляція, випарювання і кристалізація)
III. Вивчення нового матеріалу.
1. Теорія атомів Демокріта.
Давньогрецький філософ Демокріт 2500 років тому висловив думку про те, що всі тіла складаються з найдрібніших невидимих неподільних частинок, які постійно рухаються, - атомів. У перекладі з грецької «атом» означає «неподільний». У середні віки вчення про атоми переслідувалося релігією, яка гальмувала розвиток науки в цілому і хімії зокрема.
2. Роберт Бойль (1627-1691) англійський вчений. У 1661 р. у своїй книзі «Хімік-скептик» визначив елементи як першопочаткові прості тіла.
3. Створення атомно-молекулярного вчення М. В. Ломоносовим і Дж. Дальтоном.
Вчення про атоми і молекули у середині XVIII ст. розробив великий російський вчений М. Ломоносов. Він стверджував, що тіла у природі складаються з корпускул (молекул), до яких входять елементи (атоми). Різноманітність речовин учений пояснив сполученням різних атомів у молекулах і різним їх розташуванням. Напрочуд правильною і сміливою для свого часу виявилася думка М. Ломоносова про те, що деякі корпускули (молекули) можуть складатися з однакових елементів (атомів). Учення про атоми отримало дальший розвиток у працях відомого англійського вченого Джона Дальтона.
Джон Дальтон (1766-1814) англійський вчений. У 1803 р. створив першу таблицю відносних атомних мас ряду елементів, вніс вклад у розвиток атомно-молекулярного вчення.
Деякі думки про атоми і молекули, висловлені М. Ломоносовим за півстоліття до Дж. Дальтона, виявилися більш вірогідними, науковими. Наприклад, англійський вчений заперечував можливість існування молекул, утворених однаковими атомами. Вчення про молекули і атоми остаточно було визнане тільки, в 1860 р. на Всесвітньому з'їзді хіміків у Карлсрує.
4. Ядерна модель будови атома Е. Резерфорда:
Е. Резерфорд висловив думку про те, що в центрі атома знаходиться позитивно заряджене ядро навколо якого обертаються негативно заряджені електрони. При чому простір навколо ядра не такий густий як саме ядро. Ця модель будови атома дістала назву – планетарної моделі будови атома.
• Атоми складаються з позитивно зарядженого ядра й електронної оболонки.
• Заряд ядра атома і сумарний заряд усіх електронів однаковий. Атом електронейтральний.
• Електрони рухаються навколо ядра з різним запасом енергії, на різній відстані від ядра й утворюють енергетичні рівні. Розглядаємо схему будови атома.

• Ядро складається з протонів і нейтронів.
• Заряд ядра дорівнює порядковому номеру елемента в періодичній системі
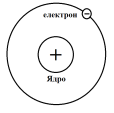
Будова найпростішого атома (планетарна модель)
Атом – найдрібніша електронейтральна частинка речовини, яка складається з позитивно зарядженого ядра й негативно заряджених електронів, які рухаються навколо нього.
Ядро містить елементарні частинки – протони. Вони мають заряд +1, тому ядро завжди позитивно заряджене. Заряд електрона становить -1. В атомі сумарний заряд протонів дорівнює сумарному заряду електронів, тому атом електронейтральний.
|
Частинка атома |
Позначення |
Маса |
Заряд |
|
Протон |
р+ |
1 |
+1 |
|
Нейтрон |
n0 |
1 |
0 |
|
Електрон |
|
0 |
-1 |
- до ХІІІ ст. було відомо 13 хімічних елементів. У ХVІІІ ст. їх стало відомо 30. Через 50 років добавилось ще 28. В наш час відомо понад 110 (зараз 115) хімічних елементів.
Вид атомів з однаковим зарядом ядра називається хімічним елементом.
Хімічні символи в такому вигляді запропонував шведський хімік Й. Я. Берцеліус. Вони позначають першу літеру латинської назви хімічних елементів. Якщо назви кількох елементів починаються з однакової літери, то до хімічного символу додають ще одну літеру. Ці позначення хімічних елементів є міжнародними та зрозумілими хімікам та іншим ученим у всьому світі.
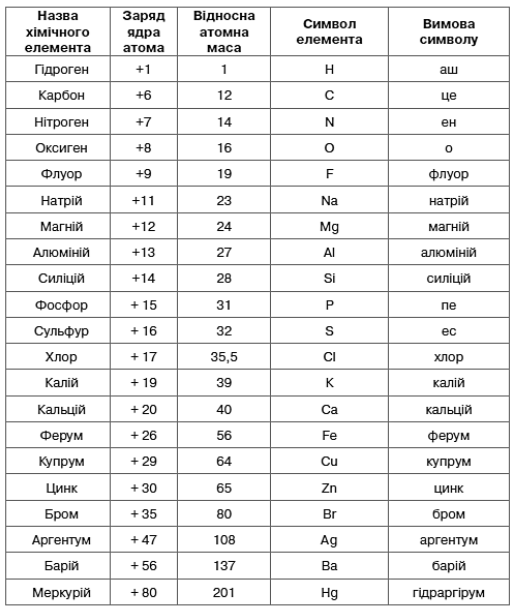
Крім хімічного символу елементи мають свої назви. Познайомимося з деякими з них за сучасною українською номенклатурою.
Робота з підручником.
Ознайомлення з періодичною системою хімічних елементів Д.І. Менделєєва.
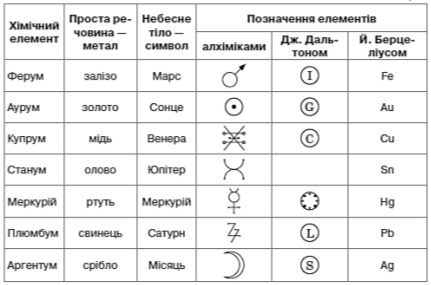
Як позначали хімічні елементи в різні часи
Властивості речовин залежать від того, які частинки входять до їх складу і як вони між собою з’єднуються.
Відомо що багато речовин складаються з молекул.
Молекула – найменша частинка речовини яка здатна до самостійного існування, при чому склад і хімічні властивості її такі ж як у даної речовини.
Розв’язування вправ
Назвіть номер групи та періоду де розташований:
- Сульфур
- Нітроген
- Оксиген
- Неон
- Кальцій
- Алюміній
- Гідроген
Вкажіть кількість протонів у елементів:
- Літій
- Натрій
- Алюміній
- Фосфор
- Флуор
- Гідроген
- Карбон
- Магній
- Силіцій
Вкажіть кількість електронів для елементів:
- Хлор
- Сульфур
- Кальцій
- Калій
- Бор
- Гелій
- Берилій
V. Підсумок уроку.
VІ. Домашнє завдання:
Опрацювати § _______
-
дякую


про публікацію авторської розробки
Додати розробку
