Конспект уроку з хімії для 7 класу на тему:"Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів."
№ 12
Дата: ____________
Тема: Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів.
Очікувані результати: учень складає формули бінарних сполук за валентністю елементів.
Тип уроку: комбінований.
Клас: 7 клас.
Методи навчання: словесні, наочні, практичні.
Хід уроку
I. Організація класу до уроку
II. Перевірка домашнього завдання.
Дати відповіді на питання:
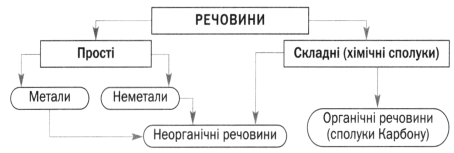
1. Охарактеризуйте прості та складні речовини. Яка між ними різниця?
Прості - речовини, молекули яких складаються з атомів одного хімічного елемента.
Приклад: азот N2, хлор СІ2, кисень О2, озон О3. їхні молекули містять атоми одного й того самого хімічного елемента, інших елементів немає.
Складні – речовини, молекули яких складаються з атомів двох і більше хімічних елементів
2. Що таке індекс?
Індекс знизу указує на число атомів у речовині.
3. Які Ви знаєте класифікації хімічних елементів?
4. Що таке хімічна формула?
Хімічна формула – це позначення атома, молекули, йона або речовини за допомогою символів хімічних елементів та індексів.
5. Що таке фізичні властивості? Фізичні властивості металів і неметалів.
III. Мотивація навчальної діяльності. Засвоєння і закріплення знань.

Едуард Франкленд (1825-1899)
Англійський хімік. У 1852 р. ввів поняття про зв’язуючи силу.
Цю властивість атомів пізніше стали називати валентністю.
Робота з підручником с. _____
Валентність – це властивість атомів хімічного елемента з'єднуватися з певним числом атомів того самого або інших хімічних елементів.
Розглянемо хімічні формули деяких сполук:
![]()
Наведені приклади показують, що один атом Хлору, Оксигену, Нітрогену, Карбону здатний приєднувати не будь-яку, а певну кількість атомів Гідрогену.
Щоб схарактеризувати валентність з кількісного боку, за одиницю взяли валентність атома Гідрогену. Отже, Гідроген – одно валентний. Якщо це так, то атом Хлору в НС1 також одновалентний, оскільки він і утримує тільки один атом Гідрогену. Атом Оксигену в Н2О – двовалентний, оскільки утримує два атоми Гідрогену. Відповідно атом Нітрогену в NН3 – тривалентний, атом Карбону в СН4 - чотиривалентний. Це можна записати наступним чином:
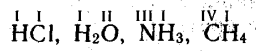
Числове значення валентності прийнято позначати римськими цифрами, які ставляться над знаками хімічних елементів.
Отже, значення валентності атома Гідрогену незмінне і дорівнює 1. (цей атом завжди сполучається тільки з одним атомом). Гідроген одновалентний елемент.
Оксисен двовалентний елемент. Таку валентність Оксиген виявляє завжди – і молекулах простої речовини, і в молекулах складної речовини.
1. Визначення валентності елементів за формулами їхніх сполук.
За формулою речовини, яка складається з двох елементів, можна визначити валентність одного елемента, якщо відома валентність іншого.
Приклад:
- дано формулу СuO. Валентність Купруму можна знайти наступним чином. Валентність Оксигену дорівнює ІІ, на один атом Оксигену припадає один матом Купруму. Відповідно валентність Купруму теж ІІ.
Дещо складніше визначити валентність по формулам сполук, що утворені не одним декількома атомами хімічного елемента.
Приклад:
- треба визначити валентність Алюмінію в алюміній оксиді, формула якого А12О3. Для цього записуємо формулу речовини над хімічним символом Оксигену позначаємо римською цифрою його валентність (вона нам відома, завжди два):
6
III II
А12О3
Враховуючи число атомів Оксигену в сполуці, визначаємо сумарну валентність трьох атомів Оксигену, вона дорівнює шести (2 ∙ 3 = 6). Ці шість одиниць валентності припадають на два атоми Алюмінію, значить, на один атом Алюмінію – три одиниці (6 : 2 = 3). Отже, Алюміній в оксиді Алюмінію тривалентний:
У формулах бінарних сполук сумарна валентність усіх атомів одного елемента завжди дорівнює сумарній валентності всіх атомів іншого елемента.
Отже, валентність елементів по формулах можливо знайти наступним чином:
1. Пишуть хімічну формулу речовини і відмічають валентність відомого елемента:
![]()
2. Знаходять найменше спільне кратне - загальне число валентності відомого елементу.
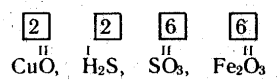
3. Вираховують і проставляють над хімічними знаками валентність другого елемента. Для цього загальне число валентності ділять на індекс цього елемента:
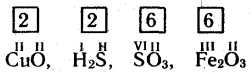
2. Складання хімічних формул за валентністю.
Знаючи валентність елементів, які утворюють дану речовину, можна скласти її хімічну формулу.
При складанні хімічних формул потрібно дотримуватись наступних дій:
1. Пишуть поряд хімічні знаки елементів, які входять до складу сполуки.
![]()
2. Над знаками хімічних елементів проставляють їх валентність:
![]()
3. Знаходять найменше спільне кратне чисел, що виражає валентність обох елементів:
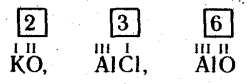
4. Діленням найменшого спільного кратного на валентність відповідного елемента знаходять індекси (індекс «1» не пишуть):
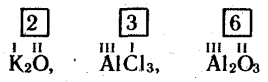
Валентність деяких елементів у хімічних сполуках

Завдання 1
Визначити формулу фосфор оксиду, в якому валентність Фосфору дорівнює п'яти.
Розв’язання
Для цього записуємо хімічні символи елементів, які входять до складу даного оксиду, над ними позначаємо валентності елементів:
V II
Р О
Знаходимо найменше спільне кратне валентностей обох елементів. Воно дорівнює 10. Ділимо найменше спільне кратне кожного з елементів і знаходимо індекс.
Багато які елементи в різних сполуках виявляють різну валентність. Це означає, що валентність буває стала і змінна.
В назві речовин, утворених елементами із змінною валентністю, після назви цього елементу в дужках пишуть римську цифру, показуючу валентність даного елемента у цій сполуці.
СuO – купрум(ІІ) оксид;
Сu2O – купрум(І) оксид
FeCl2 – ферум(ІІ) хлорид
FeCl3 – ферум(ІІІ) хлорид
FеО – ферум(II) оксид
Fe2О3 – ферум(III) оксид
СuСІ2 – купрум(II) хлорид
СuСІ – купрум(І) хлорид.
Для елементів – металів, що розміщені у головних підгрупах, валентність дорівнює номеру групи.
Неметалічні елементи проявляють в основному дві валентності: вищу, яка дорівнює номеру групи, і нижчу, яка дорівнює різниці між числом 8 (загальна кількість груп в таблиці) і номером групи, в якій перебуває елемент.
Запам’ятати числове значення постійної валентності металів допоможе не хитрий текст, який коментує таблицю:
«Натрий, Калий, Серебро с Водородом за одно.
С Кислородом Магний, Ртуть,
Кальций, Барий и Бериллий,
Медь и Цинк не позабудь.
Трехвалентный Алюминий».
Таблиця постійних значень валентності деяких елементів

IV. Узагальнення і систематизація знань.
1.Скласти Формули бінарних сполук за відомими валентностями:
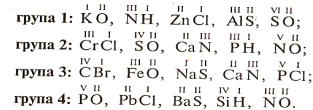
2.Як можна визначити валентність атома?
3.Як скласти хімічну формулу, знаючи валентність атома?
V. Підсумoк уроку.
VI. Домашнє завдання.
Опрацювати § Письм. №

про публікацію авторської розробки
Додати розробку
