Конспект уроку з хімії для 7 класу на тему "Повітря, його склад. Оксиґен. Поширеність Оксиґену в природі. Кисень, склад його молекули, поширеність у природі, фізичні властивості".
Запропонований конспект призначений для надання допомоги вчителям у підготовці та проведенні уроків хімії у 7 класі, складений відповідно до програми з хімії 11 – річної школи для загальноосвітніх навчальних закладів. Він має за мету зорієнтувати вчителів хімії у виборі педагогічних технологій для реалізації компетентнісного підходу до навчання та розвитку креативного мислення учнів.
Дата ______Клас _____ Вчитель: Дерев’янко Л.В.
УРОК № 27
Тема. Повітря, його склад. Оксиґен. Поширеність Оксиґену в природі. Кисень, склад його молекули, поширеність у природі. Фізичні властивості кисню.
Завдання:
• вивчити склад повітря, ознайомити учнів із роботами Лавуазьє про встановлення складу повітря, сформувати уявлення про повітря як суміш газів, розкрити взаємозв'язок хімії, людини, природи та показати, що головною причиною забруднення природи є людина;
• сформувати поняття учнів про Оксиґен, як хімічний елемент ПСХЕ та його поширеність у природі; склад молекул кисню, історію його відкриття та фізичні властивості;
• розвивати предметну і ключові компетентності учня, його екологічну культуру, навички безпечного поводження з речовинами, роль хімічних знань у поясненні природи речовин і суті хімічних явищ; значення хімії в житті людини, здатність до самоосвіти;
• виховувати загальну культуру, світоглядні орієнтири, екологічний стиль мислення і поведінку, творчі здібності, дослідницькі навички і навички життєзабезпечення.
Тип уроку: урок вивчення нового матеріалу.
Базові поняття і терміни: повітря – суміш газів, Оксиґен - хімічний елемент, кисень - проста речовина.
Обладнання та матеріали: періодична система хімічних елементів Д.І.Менделєєва, мультимедійна презентація «Оксиґен. Кисень».
Хід уроку
I. Організаційний момент
II. Актуалізація опорних знань
Закінчити речення:
1. Хімічний елемент – це…
2. Речовина - …
3. Прості речовини – це…
4. Складні речовини – це…
5. Суміш - це…
Бесіда.
1.Чим відрізняються суміші від чистих речовин?
2.Як можна відрізнити суміш від чистої речовини?
3.Як можна розділити суміш на індивідуальні речовини?
III. Мотивація навчальної діяльності Учитель:
Сьогодні на уроці ми з вами будемо отримувати нові знання з теми «Кисень». Згадаємо про однорідну суміш газів, без якої неможливе життя – повітря. Нас чекає цікаве знайомство з хімічним елементом Оксиґеном і утвореною ним простою речовиною киснем, дізнаємось де міститься Оксиґен в природі, чим цікавий кисень та як його було відкрито. Отримані на уроці знання знадобляться вам не лише на наших наступних уроках, а і у вашому повсякденному житті.
«Кисень – це речовина, навколо якої обертається земна хімія».
Й. Я. Берцеліус
Повідомлення теми та мети уроку
IV. Вивчення нового матеріалу
1. Історія відкриття складу повітря Розповідь учителя. Тривалий час вчені не надавали особливого значення вивченню газів. Дослідження у галузі пневматичної хімії почали з’являтися тільки в другій половині XVIII століття. Одержання окремих газів і вивчення їх властивостей стали можливими завдяки винаходу пневматичної ванни, тобто приладу для одержання й збирання газів.
Першим хіміком-пневматиком був англієць Дж. Блек. Досліджуючи луг, він одержав вуглекислий газ. Дослідження Блека продовжив англійський учений-самоук Генрі Кавендіш. Він першим дослідив і описав водень. Кавендіш досліджував склад повітря, відібраного в різних місцях (на горі, в лісі). Склад повітря всюди виявився однаковим, що спростувало розповсюджені в той час уявлення. Сучаснику Кавендіша, англійському вченому-аматору Прістлі належить пріоритет відкриття 1774 року кисню. Прістлі знайшов, що після згоряння горючих речовин об’єм взятого для дослідів повітря зменшується на 1/5 і повітря стає не придатним для горіння й дихання. Прістлі помітив, що повітря, не придатне для дихання, знову набуває звичайних властивостей, якщо помістити в нього на якийсь час рослину.
На жаль, Блек, Кавендіш і Прістлі були прихильниками теорії флогістону й не змогли правильно витлумачити результати своїх дослідів. Одержані гази вони називали «зв’язаним повітрям», не розуміючи, що відкрили індивідуальні речовини.
Величезна заслуга у вивченні складу повітря належить французькому вченому Антуанові Лавуазьє. Лавуазьє за освітою був юристом, але велику частину свого часу присвячував природничим наукам. 1774 року, аналізуючи результати своїх дослідів із спалювання речовин, Лавуазьє дійшов висновку, що повітря — це не просте тіло, як гадали вчені того часу, а суміш різних за властивістю речовин. Одна з частин суміші підтримує горіння й бере участь у диханні. Згодом Лавуазьє встановив, що ця частина повітря має киснеутворюючу властивість, тому що після згоряння в ній різні речовини перетворюються на кислоти. У зв’язку з цим з’явилася назва «оксиґен», тобто той що народжує кислоти, кисень. Вивчаючи іншу частину повітря, Лавуазьє встановив, що вона не підтримує дихання та горіння (миші поміщені в це повітря, швидко гинули). Цю частину повітря він назвав «азотом», що французькою означає «безжиттєвий». Вважається, що пріоритет у вивченні й встановленні складу повітря належить Лавуазьє. Незважаючи на те, що вчений встановив не всі відомі сучасній науці компоненти повітря, він відкрив два головних гази, вивчив і описав їх властивості, визначив їх об’ємні співвідношення.
2.Склад повітря
Розповідь з елементами бесіди.
Що ж таке повітря? Незважаючи на те, що людина живе на дні «повітряного океану», вона вивчила повітря значно пізніше, ніж інші речовини. Це пояснюється тим, що повітря невидиме, не має ні запаху, ні смаку. Лише наприкінці XVIII століття А.Лавуазьє визначив склад повітря. До його складу входять: азот - 78%, кисень - 21%, вуглекислий газ - 0,03%, аргон - 0,93%. Отже, повітря – складна суміш газів .
Робота з підручником( ст..109 табл.2 Склад повітря).
У повітрі є ще пил, водяна пара і домішки різних газів: сульфуру (IV) оксиду SO2, метану СН4, амоніаку NНз, карбон (ІІ) оксиду СО тощо. Вони шкідливі для довкілля і здоров'я людини, забруднюють атмосферне повітря.
3.Охорона атмосфери від забруднення Розповідь вчителя з елементами бесіди:
- створення безвідходних технологічних процесів;
- винесення великих потужних підприємств за межі міст;
- створення заміських кільцевих шляхів для транспорту;
- переведення міського транспорту на електротранспорт; - встановлення на заводських і фабричних трубах пило газовловлювачів;
- озеленення міст і сіл.
4. Порівняємо Оксиґен та кисень та складемо таблицю використовуючи матеріал підручника §18(ст..107 – 110)
|
Оксиґен – хімічний елемент |
кисень – проста речовина |
||||
|
О |
О2 |
||||
|
Відносна атомна маса Ar(O)= 15,999 ≈ 16 а.о.м. |
Відносна молекулярна маса Мr(O2) = 2Ar(O)=2•16=32 а.о.м. |
||||
|
Валентність : ІІ ІІ ? ? ? Н2О; Na2О; CaO; Al2O3 |
Графічна формула кисню :
О = О. |
||||
|
Місце у ПСХЕ: №8; 2період; VI група, головна підгрупа (VIА) |
Фізичні властивості:
|
||||
|
|
Агрегатний стан - Запах - Смак - Колір - Добре, чи погано розчиняється у воді - |
газ не має не має не має (але товстий шар кисню при заломленні променів світла яскраво-блакитний)
погано (малорозчинний у воді) (в 1 л Н2О при T=20 оС розчиняється 31мл О2 – 0,004% за масою) |
|
||
|
Будова ядра атома: 16 + = 8 р
8 e- = 8 |
|||||
|
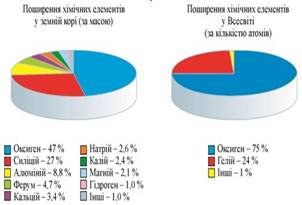
Оксиґен у природі: - найпоширеніший хімічний елемент
|
|||||
|
w(O)за масою у земній корі = 47%; w(O)за масою у гідросфері =86-89%; w(O)за масою у тілі дорослої людини = 65%;
- дуже активний неметал (поступається лише Флуору), тому утворює сполуки майже з усіма елементами;
- утворює дві прості речовини: О2 - кисень; О3 – озон. |
|
Важчий чи легший за повітря - Температура перетворення кисню на рідину Tкип = Температура перетворення кисню на тверді сині кристали Tпл = Чи має магнітні властивості |
важчий за повітря (1 л повітря при T=0 оС =1,29 г, а кисню – 1,43г)
- 183 оС
-218,7 оС є парамагнітним (притягується магнітом) у рідкому та твердому станах |
|
|
|
|
Об’ємна частка кисню у повітрі: φ(О2) ≈ 21%; Масова частка кисню у повітрі: w(О2) ≈ 23% |
||||
|
|
Кисень – підтримує дихання та горіння. Усі живі організми дихають киснем і в безкисневій атмосфері просто не можливе життя. Лише деякі мікроорганізми – анаеробні бактерії, живуть без кисню.
|
||||
5.Відкриття кисню.
1. У 1772 році славетний шведський фармацевт Карл Вільгельм Шеєле (1742-1786) після численних дослідів з розкладу селітри (KNO3, NaNO3) одержав «вогненне повітря», в якому скіпка, що ледь жевріла, загорялася яскравим полум'ям. Шеєле повторив дослід зі спалювання фосфору, але у «вогненному повітрі» після згоряння фосфору колба цілком заповнювалася водою. Утім, таємниця вогню так і залишалася для вченого таємницею, тому що до кінця днів він залишався прихильником теорії «флогістону».
2. У 1774 році протестантський священик, англієць Джозеф Прістлі (1733-1804) шляхом розкладання меркурій оксиду в герметично закритій посудині (Прістлі направляв на цю сполуку сонячні промені за допомогою могутньої лінзи): t 0C
2HgО → 2Hg + O2↑
Однак Прістлі спочатку не зрозумів, що відкрив нову просту речовину, він вважав, що виділив одну зі складових частин повітря (і назвав цей газ «дефлогістованим повітрям», «покращеним повітрям»). Про своє відкриття Прістлі повідомив видатного французького хіміка Антуана Лавуазьє. Шеєле добув кисень раніше, ніж Прістлі, але опублікував свої результати пізніше. Тому першовідкривачем кисню вважають Дж. Прістлі. 3.Історія відкриття кисню цікаво переплітається з історією підводних човнів. Є відомості, що кисень був відкритий ще в XVII столітті голландським ученим К. Дреббелем. Він використовував цей газ для дихання в підводному човні власної конструкції. Але це відкриття належало до військової техніки й трималося в секреті, тому не вплинуло на подальші дослідження.
V. Узагальнення та систематизація знань
Хімічний диктант:
І. Вставте пропущені слова так, щоб вираз став завершеним.
1. Прості речовини поділяються на _____________ і ____________.
2. Ядро атома Оксигену містить 8 ______________ і 8 __________.
3. Кисень – проста речовина, утворена елементом _____________.
4. Оксиген утворює прості речовини: ______, _____________. ІІ. Поставте знак «+», якщо твердження правильне, і знак «-», якщо хибне.
1.Кисень – типовий метал _________.
2.Відносна молекулярна маса кисню – 16 ______________.
3.Хімічна формула кисню – О2 _______________.
4.Без кисню неможливе життя людини -______________. ІІІ. Доповніть речення, вставивши слова «Оксиген», «кисень».
1.Найбільший вміст ____________ в гірських породах і мінералах.
2.У воді розчинений __________________.
3.В акваріумі риби дихають _______________, розчиненим у воді.
4.До складу молекули води входить .
Хвилинка – цікавинка:
- Рідкий кисень, як і залізо притягується до магніту.
- Організм дорослого чоловіка щодоби споживає приблизно 900 г кисню, а жінки – 600 г.
- До 1961 р. атомною одиницею маси була 1/16 маси атома Оксиґену.
VІ. Домашнє завдання.
• Опрацювати §18, конспект;
• Виконати завдання ст..110 - 111 №№131,134,135,136.
• Творче завдання: намалювати малюнки, що відображають фізичні властивості кисню або скласти кросворд за вивченою темою.
VІІ. Рефлексія.
• Над чим замислювались протягом уроку?
• Що найбільше сподобалось, запам’яталось?
• Що могло б бути краще?
VІІІ. Підсумок уроку, оцінювання учнів.


про публікацію авторської розробки
Додати розробку