Контрольна робота 11 клас: "Періодичний закон і Періодична система хімічних елементів. Хімічний зв'язок і будова речовини""
11 клас Контрольна робота з теми:
«Періодичний закон та Періодична система хімічних елементів. Хімічний зв’язок і будова речовини»
Варіант 1
- Вкажіть елементи, які виявляють максимальну схильність до утворення сполуки з йонним зв’язком:
а) S, O; б) K, N; в) P, Cl; г) H, Ne; д) Zn, O.
-
Вкажіть тип хімічного зв’язку в речовині, формула якої
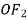 :
:
а) полярний ковалентний; б) неполярний ковалентний;
в) йонний; г) водневий; д) металічний.
-
Вкажіть правильне твердження. Спільним у будові йонів
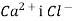 є :
є :
а) кількість протонів; б) загальна кількість електронів і протонів; в) кількість електронів на зовнішньому електронному шарі; г) кількість нейтронів; д) кількість протонів і нейтронів.
- Вкажіть молекулу між атомами якої існує неполярний ковалентний зв’язок:
а) ![]() ; б)
; б) ![]() ; в)
; в) ![]() ; г)
; г) ![]() ; д) HBr.
; д) HBr.
- Найменш стійким хімічних зв’язком є:
а) неполярний ковалентний; б) полярний ковалентний;
в) водневий; г) металічний; д) йонний.
- Вкажіть пару речовин, усі зв’язки в яких полярні ковалентні:
а) ![]() .
.
- Укажіть аморфну речовину:
а) Натрій гідроксид; б) Мідь; в) Поліетилен; г) Хлор
-
Укажіть назву хімічного елемента з електронною конфігурацією зовнішнього енергетичного рівня
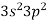 :
:
а) Оксиген; б) Силіцій; в) Карбон; г) Хлор
- Встановіть відповідність між формулою речовини та типом хімічного зв’язку у ній:
А- металічний 1. ![]()
Б - водневий 2. ![]()
В - йонний 3. ![]()
Г – полярний ковалентний 4. Mg
Д – неполярний ковалентний
- Встановіть відповідність між назвою хімічного елемента і його місцем у таблиці періодичної системи:
А- побічна підгруппа VIII групи 1. Натрій;
Б – головна підгрупа ІІ групи 2. Кальцій;
В – головна І групи 3. Алюміній;
Г – головна підгрупа ІІІ групи 4. Ферум;
Д – побічна підгрупа ІІІ групи
- Дайте характеристику хімічного елемента з порядковим номером 14 а саме:
- вкажіть положення елемента у Періодичній системі кількість протонів, електронів та нейтронів;
- складіть електронну та графічну формулу цього елемента, вкажіть кількість неспарених електронів;
- напишіть електронну конфігурацію атома цього елемента у збудженому стані;
- вкажіть усі можливі валентні стани та ступені окиснення, що характерні для цього елемента;
- напишіть формулу простої речовини та формулу вищого оксиду цього елемента; вкажіть тип хімічних зв’язків та тип кристалічної гратки у цих речовинах.
- Атом хімічного елемента має на 6 електронів більше, ніж йон Магнію. Запишіть назву цього елемента.
11 клас Контрольна робота з теми:
«Періодичний закон та Періодична система хімічних елементів. Хімічний зв’язок і будова речовини»
Варіант 2
- Вкажіть речовину, в якій найбільше виражена полярність зв’язку:
а) ![]() ; б) HCl; в)
; б) HCl; в) ![]() ; г)
; г) ![]() д)
д) ![]() .
.
- Вкажіть тип хімічного зв’язку в речовині, формула якої KF:
а) йонний; б) неполярний ковалентний;
в) полярний ковалентний; г) водневий; д) металічний.
-
Вкажіть правильне твердження. Спільним у будові атома
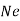 та йона
та йона 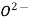 є :
є :
а) кількість протонів; б) загальна кількість електронів і протонів; в) кількість нейтронів; г)загальна кількість електронів; д) кількість електронів і нейтронів.
- Вкажіть молекулу, хімічний зв’язок між атомами в якій найбільш полярний:
а) ![]() ; б) HCl; в)
; б) HCl; в) ![]() ; г)
; г) ![]() ; д)
; д) ![]() .
.
- Вкажіть пару речовин для яких характерний міжмолекулярний водневий зв’язок:
а) ![]() ,
, ![]() ; б)
; б) ![]()
![]() ; в) HBr,
; в) HBr,![]() ;
;
г) NaCl, ![]() ; д)
; д) ![]() ,
, ![]() .
.
-
Вкажіть тип зв’язку між молекулами в ресовині, формула якої
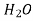 :
:
![]()
![]() .
.
- Укажіть аморфну речовину:
а) Бурштин; б) Азот; в) Залізо; г) Графіт
-
Укажіть назву хімічного елемента з електронною конфігурацією зовнішнього енергетичного рівня
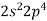 :
:
а) Оксиген; б) Неон; в) Флуор; г) Бор
- Встановіть відповідність між формулою речовини та типом хімічного зв’язку у ній:
А- йонний 1. Na
Б - водневий 2. ![]()
В - металічний 3. ![]()
Г – неполярний ковалентний 4. ![]()
Д – полярний ковалентний
- Встановіть відповідність між символами та електронними формулами атомів хімічних елементів в основному стані:
А- ![]() 1. P;
1. P;
Б – ![]() 2. N;
2. N;
В – ![]() 3. Cl;
3. Cl;
Г – ![]() 4. F;
4. F;
Д – ![]()
- Дайте характеристику хімічного елемента з порядковим номером 12 а саме:
- вкажіть положення елемента у Періодичній системі кількість протонів, електронів та нейтронів;
- складіть електронну та графічну формулу цього елемента, вкажіть кількість неспарених електронів;
- напишіть електронну конфігурацію атома цього елемента у збудженому стані;
- вкажіть усі можливі валентні стани та ступені окиснення, що характерні для цього елемента;
- напишіть формулу простої речовини та формулу вищого оксиду цього елемента; вкажіть тип хімічних зв’язків та тип кристалічної гратки у цих речовинах.
- Атом хімічного елемента має на 7 електронів більше, ніж атом Флуору. Запишіть назву цього елемента.
-
-
-
Дякую!


про публікацію авторської розробки
Додати розробку
