Контрольна робота ІІ семестр
Сотула Оксана Леонідівна, вчитель хімії
КЗ «Бугаївський ліцей Ізюмської районної ради Харківської області»
ПІДСУМКОВА КОНТРОЛЬНА РОБОТА 7 КЛАС
1. Якому елементу відповідає значення відносної атомної маси 23? (0,5 б):
а) Магнію; б) Силіцію; в) Натрію; г) Сульфуру; д) Хлору.
2. Виберіть найбільш правильний запис якісного складу формули FeCl2 (0,5 б):
а) молекула FeCl2 складається з одного атома Феруму і двох атомів Хлору;
б) молекула FeCl2 складається з одного атома Феруму і двох атомів Карбону;
в) до складу FeCl2 входять два елементи: Ферум і Хлор;
г) до складу FeCl2 входять два елементи: Ферум і Карбон.
3. Кисень першим відкрив (0,5 б):
а) Дж. Прістлі; б) К. Шеєле; в) Мао-Хоа; г) А. Лавуазьє.
4. Який запис означає «чотири молекули водню»? (0,5 б):
а) 4HCl; б) 4H; в) 4H2; г) 4H2O.
5. Яка валентність Феруму у Fe2O3? (0,5 б):
а) II; б) I; в) IV; г) III.
6. Вкажіть хімічне явище (0,5 б):
а) іржавіння заліза; б) розчинення цукру у воді; в) танення льоду.
7. Яке з понять є зайвим у переліку? (0,5 б):
а) Вода; б) лід; в) сніжинка; г) пара.
8. Вкажіть чисту речовину: (0,5 б):
а) повітря; б) молоко; в) залізо; г) річкова вода.
9. Установіть відповідність між вихідними речовинами й продуктами реакцій: (1 б):
1) K i Cl2 а) CO2
2) C i O2 б) BaS
3) Ba i S в) KCl
4) K і O2 г) K2O
д) CuO
10. Знайдіть відповідність між назвами й формулами таких речовин (1 б):
1) Сульфур(IV) оксид а) BaO
2) Фосфор(V) оксид б) CaI2
3) Кальцій йодид в) P2O5
4) Барій оксид г) SO2
5) Нітроген(II) оксид д) FeCl2
6) Ферум(II) хлорид е) NO
11. Складіть рівняння реакцій за наведеними схемами (3 б):
а) CH4 + O2 ![]() CO2 + H2O б) P + O2
CO2 + H2O б) P + O2 ![]() P2O3
P2O3
в) Fe + O2 ![]() г) FeS + O2
г) FeS + O2 ![]()
12. Маса води, під час розкладання якої електричним струмом утворилося 12 г водню та 96 г кисню, дорівнює (1 б):
а) 110 г; б) 96 г; в) 220 г; г) 108 г.
14. Яка маса солі міститься в розчині масою 50 г із масовою часткою розчиненої речовини 25%. (2 б)
ПІДСУМКОВА КОНТРОЛЬНА РОБОТА
7 КЛАС
Варіант II
1. Якому елементу відповідає значення атомної маси 12? (0,5 б):
а) S; б) O; в) Cl; г) C.
2. Найбільше Оксигену міститься (0,5 б):
а) у літосфері; б) в атмосфері; в) у гідросфері.
3. Першим дослідив властивості кисню (0,5 б):
а) К. Шеєле; б) А. Лавуазьє; в) Мао-Хоа; г) Дж. Прістлі.
4. Виберіть формулу гідроген пероксиду (0,5 б):
а) Na2O2; б) H2O2; в) C2H2; г) K2O; д) CO2.
5. Яка валентність Купруму в оксиді CuO? (0,5 б)
а) II; б) I; в) IV; г) III.
6. Вкажіть фізичне явище (0,5 б):
а) випаровування води; б) скисання молока; в) пожовтіння листя.
7. Яке з понять є зайвим у переліку? (0,5 б):
а) Вода; б) лід; в) сніжинка; г) пара.
8. Відносна молекулярна маса Н2О дорівнює (0,5 б):
а) 18; б) 16; в) 32.
9. Знайдіть відповідність між вихідними речовинами і продуктами реакцій (1 б ):
1) Cu i O2 а) CaCl2
2) Li i Br2 б) CuO
3) Ca i Cl2 в) LiBr
4) Ca і O2 г) CO
д) CaO
10. Знайдіть відповідність між назвами й формулами таких речовин(1 б):
1) Карбон(IV) оксид а) MgO
2) Калій оксид б) CaCl2
3) Кальцій хлорид в) CuCl
4) Магній оксид г) K2O
5) Фосфор(III) оксид д) CO2
6) Купрум(I) хлорид е) P2O3
11. Складіть рівняння реакцій за наведеними схемами (3 б):
а) Al + Cl2 ![]() AlCl3 б) C3H8 +O2
AlCl3 б) C3H8 +O2 ![]() CO2 + H2O
CO2 + H2O
в) Fe + S ![]() г) CH4 + O2
г) CH4 + O2 ![]()
12. У результаті взаємодії міді масою 6,4 г з киснем масою 1,6 г утвориться купрум (ІІ) оксид масою (1 б) :
а) 4,8 г; б) 4 г; в) 8 г; г) 10,24 г.
13. Яка маса солі міститься в розчині масою 100 г із масовою часткою розчиненої речовини 25%. (2 б)
- Доберіть коефіцієнти в схемах реакцій. Укажіть реакції сполучення і розкладу.
а) HgO = Hg + O2;
б) Mg + O2 = MgO;
в) Fe2O3 + Al = Al2O3 + Fe.
3. Допишіть рівняння реакцій:
а) N2 + … = NO;
б) KMnO4 = … + … + …;
в) … + … = Fe3O4.
Варіант III
1. Якому елементу відповідає значення атомної маси 56?
а) Cl;
б) Ni;
в) Ne;
г) Fe.
2. Залізо має колір:
а) жовтуватий;
б) сріблясто-сірий;
в) червоний;
г) чорний.
3. Уміст кисню в повітрі за об’ємом становить:
а) 21 %;
б) 23 %;
в) 52 %;
г) 65 %.
4. Кисень добувають розкладом калій перманганату, формула якого:
а) K2MnO4;
б) MnO2;
в) KNO3;
г) KMnO4.
5. Вкажіть хімічне явище:
а) замерзання води;
б) іржавіння заліза;
в) розділення повітря на кисень і азот.
6. Яка валентність Сульфуру в оксиді SO3?
а) II;
б) I;
в) IV;
г) VI.
7. Яке з понять є зайвим у наведеному рядку?
а) Підкова;
б) цвях;
в) залізо;
г) дріт.
8. Формула залізної окалини:
а) Fe;
б) Fe2O3;
в) Fe(OH)3;
г) Fe3O4.
9. Виберіть із переліку фізичні властивості заліза:
а) метал червоного кольору;
б) здатний намагнічуватись;
в) не проводить електричний струм;
г) ковкий.
10. Знайдіть відповідність між вихідними речовинами і продуктами реакцій:
1) S i O2 а) Kl
2) Mg i S б) MgS
3) K i I2 в) SO2
4) C і O2 г) K2O
д) CO
11. Заповніть таблицю формулами складних речовин поданих елементів:
|
|
N |
F |
|
Mg |
|
|
|
Li |
|
|
|
Al |
|
|
|
Cu(II) |
|
|
12. Знайдіть відповідність між назвами й формулами таких речовин:
1) Ферум(III) хлорид а) CO
2) Купрум(I) йодид б) FeCl3
3) Карбон(II) оксид в) NaCl
4) Нітроген(IV) оксид г) Na2O
5) Натрій оксид д) NO2
6) Натрій хлорид е) CuI
13. Складіть рівняння реакцій за наведеними схемами:
а) SO2 + O2 ![]() SO3
SO3
б) CS2 + O2 ![]() CO2 + SO2
CO2 + SO2
14. Маса магнію, що вступила в реакцію з киснем масою 8 г з утворенням магній оксиду масою 20 г, дорівнює:
а) 12 г;
б) 6 г;
в) 28 г;
г) 4 г.
15. Поширеність Феруму в природі.
16. Обчисліть масові частки елементів у ферум(ІІІ) оксиді.
17. Допишіть рівняння реакцій:
а) Fe + Cl ![]()
б) H2S + O2 ![]()
18. У якій речовині масова частка Феруму більша — у Fe(OH)3 чи FePO4 ?
19. Складіть рівняння реакцій за схемами й дайте назви сполукам:
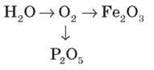
Виведіть молекулярну формулу хром сульфіду, масова частка Хрому в якому 52 %, Сульфуру — 48 %, відносна молекулярна маса сполуки — 200.


про публікацію авторської розробки
Додати розробку
