Багатоманітність речовин. Метали й неметали. Металічні та неметалічні елементи. Прості та складні речовини.
Хімія 7 клас
Урок №11
Тема: «Прості та складні речовини. Багатоманітність речовин. Метали й неметали. Металічні та неметалічні елементи».
Мета:
ввести поняття про різноманіття речовин; дати початкову класифікацію елементів на метали й неметали, їх поширення в природі; навчити розрізняти металічні й неметалічні елементи за їх положенням у періодичній системі; показати істотну відмінність фізичних і хімічних властивостей металів і неметалів; дати поняття про прості та складні речовини; навчити учнів аналізувати якісний склад простих і складних речовин; сприяти в ході уроку формуванню світоглядних ідей про матеріальність світу, сприяти естетичному вихованню, ознайомлення учнів з елементами етики в науці на основі правил запису хімічних елементів; розвивати абстрактне мислення учнів, вміння порівнювати речовини, самостійність та творчість при виконанні вправ, розвивати пізнавальний інтерес учнів, включаючи у зміст уроку елементи нових знань та зв’язок їх з життям.
Тип уроку: вивчення нового матеріалу та формування умінь.
ХІД УРОКУ
І. Організаційний етап.
ІІ. Актуалізація опорних знань.
- Бесіда:
- Які елементи зустрічаються переважно в космосі? (Н, Не)
- Які елементи першими стали відомими людям? (Au, Ag, Cu, Fe, Sn, Pb, Hg)
- Хто може пояснити, чому саме ці елементи першими навчилася ви-користовувати людина? (тому що вони зустрічалися у вільному стані, тобто не у вигляді сполук)
- Речовин на Землі набагато більше, ніж елементів. Чому? (елементи утворюють сполуки — молекули)
- З яких частинок може складатися речовина? (атоми, молекули, йони)
- Згадаймо, що таке молекула. (молекула — це дрібна частинка речовини, що має її властивості)
- 3 чого складається молекула? (з атомів) З однакових чи різних? (з однакових і з різних)
- За допомогою чого можна виразити склад речовини? (за допомогою хімічної формули)
- Що таке хімічна формула?
- На що вказує якісний склад? Кількісний склад?
- Що таке індекс? Коефіцієнт?
- Поясніть записи:
А) 2Fe Б) S8 В) 3H2O Г) 5O2.
ІІІ. Мотивація навчальної діяльності.
З давніх-давен людина знала золото, срібло, залізо, скло, вугілля, повітря, вогонь, ґрунт, воду, уміла добувати харчові й лікарські речовини, руди, виготовляти мило. На початку ІХ ст. почала стрімко зростати кількість відкритих хімічних елементів та їхніх сполук. Щоб не заплутатися в цьому різноманітті, слід було добре систематизувати нові знання. За найзручніший спосіб обрали розділити відомі на той час речовини на прості й складні, а потім прості — на метали й неметали, складні — на сполуки металів і неметалів відповідно. Яким чином ми можемо відрізнити прості речовини від складних, металічні від неметалічних? За якими ознаками відбувається розподіл речовин? Чим відрізняється, наприклад, залізо від сірки? Які відмінності існують між водою, киснем, алюмінієм? У чому причина таких відмінностей?
ІV. Вивчення нового матеріалу.
Будова речовини залежить від природи хімічних елементів, що її утворюють.
|
|
|
Молекулярні - складаються з молекул (цукор, вода у твердому, рідкому та газоподібному станах). |
|
Немолекулярні - складаються з атомів, йонів та інших частинок (графіт, алмаз, усі солі). |
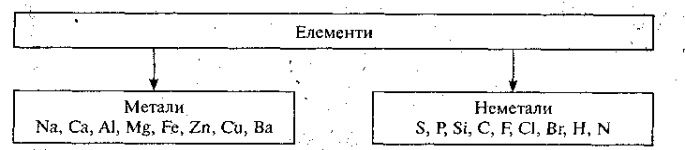
Перша класифікація хімічних елементів за властивостями передбачає їх поділ на метали й неметали.
Демонстрація «Зразки металів і неметалів»:
1. Які загальні властивості мають метали?
- Металевий блиск; сірі (крім міді); тверді; проводять електричний струм.
2. Розгляньмо зразки неметалів: сірка, графіт, додамо наші знання про N2 і O2
- Крихкі; тверді або газоподібні; різні властивості.
Запишемо приклади:
1. Яких елементів у космосі більше — металів чи неметалів? (Неметалів — Н, Не)
2. Частка яких елементів більша в земній корі — металів чи неметалів?
(Неметалів: W (O) = 47%, W (Si) = 27,6%.)
3. А які елементи містяться в повітрі? (Неметали Нітроген, Оксиген у складі речовин N 2, О2)
А тепер подивімося в періодичну систему. Умовна діагональ від Бору до Астату поділяє періодичну систему на дві частини: у нижній частині таблиці ліворуч від діагоналі знаходяться елементи-метали, а у верхній лівій частині знаходяться елементи-неметали (крім елементів побічних груп).
Відомі також елементи, що в сполуках виявляють властивості як металів, так і неметалів. Вони називаються перехідними елементами. До них належать, наприклад, Ре, Gе та інші.
Окрема група елементів — це елементи головної підгрупи VIII групи: Не, Ne, Аг, Кг, Хе, Rn. Їх називають інертними, або благородними, елементами, оскільки вони не виявляють ні властивостей металів, ні властивостей неметалів.
- Запропонуйте по п'ять прикладів елементів металів і неметалів з періодичної системи.
Демонстрація
Змішали порошок сірки і порошок заліза.
- Як можна розділити цю суміш? (Залізо в суміші зберігає свої магнітні властивості, тому легко притягується магнітом)
- Чому залізо не можна вилучити з цієї ж суміші після нагрівання? (Залізо реагує із сіркою)
Тепер і залізо, і сірка змінили свої властивості. З атомів Сульфуру і Феруму утворилася речовина складу FeS. Речовини до проведення досліду складалися з однакових атомів S і Fе, після досліду речовина складається, з молекул FeS.
Чим відрізняються речовини до реакції та після? (За якісним складом)
За якісним складом речовини поділяються на прості та складні.

Прості — речовини, молекули яких складаються з атомів одного хімічного елемента: O2, H2, C, S8, Fe.
Складні — речовини, молекули яких складаються з атомів двох і більше хімічних елементів:
FeS, CO2, H2SO4, CaCO3.
Вода — проста чи складна речовина? (Складна; складається з двох атомів Гідрогену й одного атома Оксигену — Н2O)
V. Узагальнення і закріплення знань.
- Виписані формули простих і складних речовин:
Варіант І: виписати десять формул простих речовин та неметалів.
Варіант II: виписати десять формул складних речовин та металів.
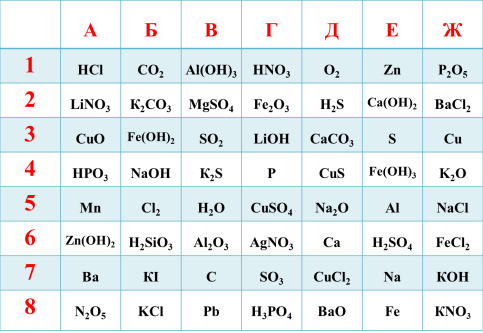
- Морський бій.
Учитель називає координати, учень —визначає просту чи складну речовину, метал чи неметал він бачить під цими координатами.
VІ. Підбиття підсумків.
Оцінюється робота учнів. Підбиваємо підсумки уроку:
• На які групи поділяються хімічні елементи?
• Як розрізнити за положенням у періодичній системі металічні й неметалічні елементи?
• Чи можна за властивостями розрізнити, метал чи неметал? Як можна визначити, що речовина проста, складна?
Учні відповідають на поставлені запитання на початку уроку.
VІІ. Домашнє завдання.


про публікацію авторської розробки
Додати розробку
