Ковалентний зв’язок, його утворення. Полярний і неполярний ковалентний зв’язок.
8 клас
Урок № 18
Тема: Ковалентний зв’язок, його утворення. Полярний і неполярний ковалентний зв’язок.
Мета:
- освітня: сформувати уявлення про утворення ковалентного зв’язку з урахуванням засвоєння знань поняття про електронегативність та будови атомів; вивчити особливості ковалентного неполярного та полярного зв’язків, навчити відрізняти ці зв’язки;
- розвивальна: розвивати вміння аналізувати, порівнювати, робити висновки;
- виховна: виховувати активність, працелюбність, інтерес до предмету, ініціативність.
Матеріали та обладнання: Періодична система хімічних елементів Д.І. Менделєєва, робочі зошити, ручки, підручники, картки.
Очікувані результати: На кінець уроку учні:
· пояснюють особливості утворення ковалентного зв’язку;
· наводять приклади сполук із ковалентним (полярним і неполярним) зв’язком;
· виконують вправи з теми.
Компетентності: спілкування державною мовою (формулювати відповідь на поставлене запитання, робити висновки), математична компетентність (аналізувати принцип утворення зв’язку), основні компетентності у природничих науках (виконувати вправи на засвоєння ковалентного полярного та неполярного зв’язку), вміння вчитися впродовж життя (застосовувати і переносити знання та навички у нову тему).
Тип уроку: засвоєння знань, умінь та навичок.
ХІД УРОКУ
Організаційний етап уроку
Вчитель вітається з учнями, записує відсутніх до журналу.
І. Актуалізація опорних знань учнів
«Кулька питань»
Вчитель кидає кульку кільком учням і задає питання. Якщо учні не відповідають, то кульку кидають вчителю.
- Чому атоми інертних елементів не вступають у хімічну взаємодію?
- Що таке електронегативність?
- У яких випадках атому вигідно віддати електрони, а в яких приєднати?
- В чому полягає утворення хімічного зв’язку?
- Що таке хімічний зв’язок?
- У періодах зі збільшенням порядкового номера електронегативність…(збільш.)
- У групах зі збільшенням порядкового номера електронегативність…(зменш.)
ІІ. Мотивація навчальної діяльності учнів
У 1907 р. Російський вчений М. О. Морозов, а в 1916р. Американський фізико-хімік Дж. Льюїс висловили припущення, що хімічний зв’язок може утворюватись, якщо виникає спільна пара електронів, що одночасно належить двом атомам.
Слово вчителя: чи були вірними припущення вчених про те, що хімічний зв’язок обумовлений утворенням спільної електронної пари ми зараз і з’ясуємо.
ІІІ. Повідомлення теми, мети уроку
Вчитель записує тему на дошці, називає мету уроку разом з учнями.
ІV. Сприйняття й первинне усвідомлення учнями нового матеріалу
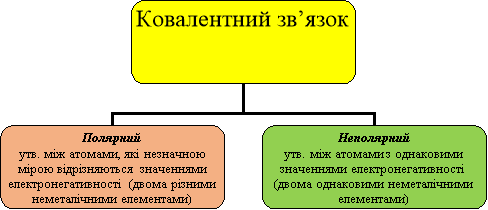
Утворення ковалентного зв’язку. Ковалентний неполярний зв’язок
Для початку пригадаємо електронну форму і графічну схему будови атома Н.
Учень на дошці записує електронну та графічну будови атома Гідрогену і робить висновок про його здатність утворювати хімічні зв’язки.
11 Н +1)11S1
Розповідь вчителя
При утворенні хімічного зв’язку атоми прагнуть до того, щоб на їх зовнішньому енергетичному рівні було два або вісім електронів. Цього можна досягти декількома способами. Найпоширеніший з них полягає в об’єднанні неспарених електронів у спільні електронні пари. При зображенні утворення хімічного зв’язку прийнято позначати електрони зовнішнього енергетичного рівня крапкою або хрестиком:
Розглянемо, як же утворюється хімічний зв’язок в молекулі водню.
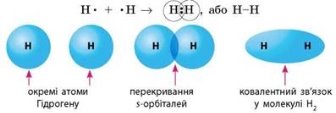
В утворенні молекули водню беруть участь два атоми Гідрогену, які намагаються добудувати свій зовнішній енергетичний рівень за рахунок іншого атома. Кожен атом намагатиметься притягнути на свою електронну оболонку додатковий електрон і таким чином отримати електронну конфігурацію найближчого інертного газу – Неону.
Під час взаємного притягання ядер атомів та електронних оболонок дві s-орбіталі перекриваються і в місцях перекривання утворюється підвищена електронна густина (густина імовірності виявлення електрона у даній точці).
Утворення молекули водню можна записати і у вигляді схеми:
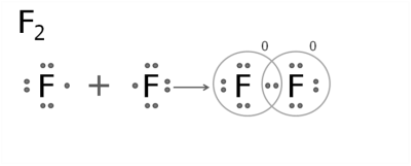
Н• + •Н → Н : Н , такі формули називають формулами Льюїса, або електронно-крапковими формулами.
Ковалентний зв’язок ‒ хімічний зв’язок, що виникає в результаті утворення спільних електронних пар.
Спільну електронну пару, що обумовлює хімічний зв’язок , можна позначити рискою. Таким чином виходить структурна формула:
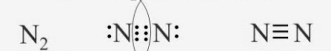
V. Осмислення об'єктивних зв'язків і відносин у досліджуваному матеріалі й розкриття внутрішньої сутності досліджуваних явищ
Зверніть увагу на атом Карбону, що входить до складу вуглекислого газу. На зовнішньому рівні тільки два неспарених електрони. Але відомо, що С може мати валентність 4. Для того, щоб утворити 4 хімічні звязки. Атом С поглинає невелику кількість енергії і переходить у так званий збуджений стан (графічно він позначається зірочкою С*). Під впливом енергії один е з s-орбіталі переходить на р-орбіталь і С стає 4-х валентним. Цей процес називають промотуванням електронна
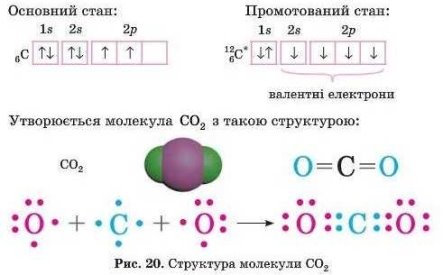
Промотування електрона – перехід електрона під впливом енергії на вільну орбіталь.
VI. Узагальнення та систематизацыя знань
Фронтальна робота
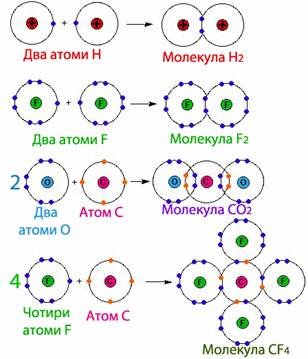
Завдання. Побудуйте електронну-крапкову формулу для таких хімічних речовин, як Н2, F2, СО2, СН4:
VII. Підсумки уроку
«Ланцюжок»
Учні користуються конспектом уроку і задають питання по ньому за ланцюжком.
VIIІ. Домашнє завдання

про публікацію авторської розробки
Додати розробку
