Лабораторні роботи з хімії
Лабораторна робота № 3
Тема: Амоніак.
1. Мета роботи. Навчитися добувати амоніак у лабораторних умовах; визначати іон амонію.
2. Обладнання та реактиви: Кристалічні амоній хлорид, кальцій гідроксид; розчини амоній гідроксиду, ферум ( ІІІ ) хлориду, натрій гідроксиду, амоній хлориду, концентрований розчин амоніаку, концентрована хлорид на кислота, фенолфталеїн, індикаторний папір.
3. Вказівки на теоретичний матеріал.
Буринська Н.М. «Хімія» . Підручник для 10 класу Київ, Ірпінь, 2005 § 11, 12.
4. Теоретичні положення.
Амоніак (аміак) ![]() - безбарвний газ, з різким запахом, набагато легший за повітря, дуже добре розчинний у воді (в 1 об’ємі води – 700 об’ємів
- безбарвний газ, з різким запахом, набагато легший за повітря, дуже добре розчинний у воді (в 1 об’ємі води – 700 об’ємів ![]() ), за температури нижчій за -33,4
), за температури нижчій за -33,4![]() переходить у рідкий стан. Дуже уражує слизові оболонки очей і дихальних шляхів.
переходить у рідкий стан. Дуже уражує слизові оболонки очей і дихальних шляхів.
Має основні властивості. Взаємодія амоніаку з водою відбувається за рівнянням:
![]()
Амоніак, взаємодіючи з кислотами, утворює солі амонію:
![]()
Солі амонію – сильні електроліти, у водному розчині добре дисоціюють на іони:
![]()
Розкладаються під час нагрівання:
![]()
Для розпізнавання солей амонію їх нагрівають з лугами. При цьому виділяється аміак – це характерна ознака для розпізнавання солей амонію.
5. Порядок виконання роботи.
Дослід 1. Добування амоніаку.
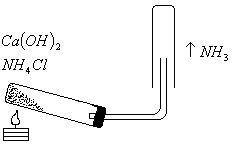
Зберіть прилад, як показано на рис. 1. В пробірку помістіть суміш амоній хлориду і кальцій гідроксиду (2:1), нагрійте. Зберіть газ у суху пробірку і не перевертаючи її, опустіть в кристалізатор з водою. Вода наповнює пробірку. На отриманий розчин подійте 1-2 краплями фенолфталеїну. Що спостерігаєте? Написати рівняння реакції одержання аміаку, розчинення його у воді.
Дослід 2. Виявлення іонів амонію в розчині.
Налийте в пробірку 2мл розчину амоній сульфату і добавте до нього стільки ж розчину натрій гідроксиду. Нагрійте рідину до кипіння і обережно понюхайте газ, що виділяється. Піднесіть до отвору пробірки лакмусовий папірець, змочений водою. Що спостерігається? Чому? Напишіть рівняння реакції в молекулярному і іонному виді.
Дослід 3. Утворення солей амонію.
До отвору пробірки з концентрованим розчином аміаку піднесіть скляну паличку, змочену концентрованою хлоридної кислотою. Як пояснити утворення диму? Дослід повторіть узявши замість хлоридної концентровану нітратні кислоту. Напишіть рівняння проведених реакцій.
6. Питання для самоперевірки.
6.1. Які фізичні властивості амоніаку? Як його добувають у лабораторії і промисловості. Напишіть відповідні рівняння реакцій.
6.2. Які реакції амоніаку з іншими речовинами ведуть до утворення іонів амонію.
6.3. Напишіть рівняння взаємодії амоніаку з сульфатною кислотою з утворенням середньої і кислої солі. Поясніть від чого це залежить.
6.4. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
![]()
6.5. Задача. З азоту і водню масою 140 та 30 кг отримали аміак масою 153 кг. Визначити вихід продукту відносно теоретичного.
7. Зміст звіту.
7.1. Мета роботи.
7.2. Аналіз хімічних дослідів.
7.3. Висновки.
8. Домашнє завдання.
8.1. Підготувати бланк звіту.
8.2. Знайти відповіді на запитання п.6.
9. Література.
Буринська Н.М. «Хімія». Підручник для 10 класу Київ, Ірпінь, 2005 .
Басов В.П. Хімія Навчальний посібник Київ «Каравела» 2003.


про публікацію авторської розробки
Додати розробку
