Лабораторний практикум з загальної хімії
 Міністерство освіти і науки України
Міністерство освіти і науки України
ХАРКІВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ
БУДІВНИЦТВА ТА АРХІТЕКТУРИ
Ю.М.Данченко, Т.М.Обіженко, Т.І.Уманська
«ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ» Лабораторний практикум
Навчально-методичний посібник
Харків 2018
Міністерство освіти і науки України
ХАРКІВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ БУДІВНИЦТВА ТА АРХІТЕКТУРИ
Ю.М.Данченко, Т.М.Обіженко, Т.І.Уманська
«ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ» Лабораторний практикум
Рекомендовано
науково-методичною радою університету як навчально-методичний посібник для студентів спеціальностей
194 «Гідротехнічне будівництво, водна інженерія та водні технології»,
144 «Теплоенергетика», 101 «Екологія» 161 «Хімічні технології та інженерія»
Харків 2018
УДК 54
Рецензенти:
В.П.Сопов, професор, доктор технічних наук., завідувач кафедри фізикохімічної механіки та технології будівельних матеріалів та виробів, Харківський національний університет будівництва та архітектури
Рекомендовано кафедрою загальної хімії, протокол № 8 від 07.02. 2018р. Затверджено науково-методичною радою університету, протокол № 8 від
31.05.18 р.
Автори: Ю.М.Данченко, Т.М.Обіженко, Т.І.Уманська
Л-12 – Ю.М. Данченко, Т.М.Обіженко, Т.І.Уманська. Основи загальної хімії. Лабораторний практикум. Навчально-методичний посібник. – Х.: ХНУБА,
2018.-51 с.
Іл.: 6 ; табл.: 3 бібліограф.: 6 назв.
Посібник охоплює основні розділи курсу загальної хімії для технічних спеціальностей вищих навчальних закладів: загально-теоретичні основи хімії, а також спеціальні розділи хімії, пов’язані зі специфікою будівельних спеціальностей.
Кожній лабораторній роботі передує стислий виклад основних теоретичних положень, необхідних для розуміння суті лабораторної роботи. Для закріплення матеріалу після кожної лабораторної роботи наведені запитання для самоперевірки.
Видання призначене для студентів спеціальностей «Гідротехнічне будівництво, водна інженерія та водні технології», «Екологія», «Теплоенергетика»,
«Хімічні технології та інженерія».
© Ю.М.Данченко, Т.М.Обіженко
Т.І.Уманська, 2018
ЗМІСТ
Загальні правила виконання лабораторних робіт… ……………………… 4 Правила техніки безпеки та перша допомога в разі виникнення нещас- 4 них випадків…. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Лабораторна робота №1 Основні класи неорганічних сполук……….. 5
Лабораторна робота №2 Визначення молярної маси еквівалента склад- 12 ної речовини…..................................................................................................
Лабораторна робота №3 Визначення теплових ефектів хімічних реак- 17 цій
Лабораторна робота №4 Залежність швидкості хімічної реакції від 20 концентрацій реагуючих речовин. . . . . . . . . .……………………………. . Лабораторна робота №5 Хімічна рівновага………………………………. 21
Лабораторна робота №6 Приготування розчину заданої концентрації і встановлення його титру………………………………............................ 23 Лабораторна робота №7 Електролітична дисоціація. Реакції в розчинах електролітів……………………………………………............................. 26
Лабораторна робота №8 Гідроліз солей………………………………... 29
Лабораторна робота №9 Дисперсні системи. Колоїдні розчини…….. 32
Лабораторна робота №10 Окисно-відновні реакції…………………… 35
Лабораторна робота №11 Гальванічні елементи………………………. 38
Лабораторна робота №12 Корозія металів……………………………… 41
Лабораторна робота №13 Визначення карбонатної жорсткості води… 44
Лабораторна робота №14 Визначення агресивного діоксиду вуглецю… 46
Список рекомендованої літератури………………………………………… 51 ЗАГАЛЬНІ ПРАВИЛА ВИКОНАННЯ ЛАБОРАТОРНИХ РОБІТ
Лабораторний практикум є однією з найважливіших складових частин курсу основ загальної хімії дисципліни „Хімія”. Він допомагає закріпленню лекційного матеріалу, сприяє розвитку навичок наукового експериментування, дослідницького підходу до вивчення хімії, логічного хімічного мислення.
Перед виконанням кожної лабораторної роботи студент повинен опрацювати відповідний розділ підручника, конспект лекцій та опис порядку проведення лабораторної роботи.
Під час підготовки до виконання лабораторної роботи та при оформленні звіту про виконану роботу всі записи слід заносити до лабораторного журналу, форма якого наведена далі (табл.1).
Таблиця 1 - Форма ведення лабораторного журналу
|
Номер досліду
|
Назва та короткий зміст роботи |
Спостереження |
Рівняння реакцій. Розрахунки. Висновки |
Під час проведення експерименту необхідно дотримуватися певних правил.
1 Досліди треба проводити в чистому посуді.
2 Не виливати надлишок реактиву з пробірки назад у реактивну склянку.
3 Сухі солі необхідно набирати чистим шпателем або ложечкою, до того ж надлишок реактиву не можна висипати назад у склянку.
4 Не слід плутати пробірки, піпетки або шпателі від інших склянок. У противному разі можна зіпсувати весь реактив у реактивній склянці.
5 Не можна забирати реактиви спільного користування на своє робоче місце.
6 Спрацьовані дорогі або рідкісні реактиви необхідно зливати в спеціально підготовлені для них склянки.
ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ ТА ПЕРША ДОПОМОГА В РАЗІ ВИНИКНЕННЯ НЕЩАСНИХ ВИПАДКІВ
Працюючи в хімічній лабораторії, треба постійно пам’ятати про техніку безпеки. Слід враховувати деякі загальні вказівки.
1 Не можна брати речовини руками та куштувати їх на смак. Для визначення запаху речовин склянку слід тримати на відстані і спрямовувати повітря рухом руки від склянки до носа.
2 Досліди з концентрованими кислотами та лугами, отруйними та леткими речовинами треба проводити у витяжній шафі.
3 Під час додавання реактивів не можна нахилятися над отвором посудини для уникнення потрапляння бризок на обличчя та одяг.
4 Не можна нахилятися над рідиною, що нагрівається для уникнення викиду. Під час нагрівання рідин у пробірках їх отвір слід направляти вбік від себе та оточуючих.
5 Під час розведення концентрованих кислот, особливо сірчаної, необхідно обережно вливати кислоту у воду!
6 З легкоспалахуючими рідинами не можна працювати поблизу нагрівальних приладів. У випадку спалахування горючих речовин треба погасити пальник, вимкнути електронагрівальні прилади, відставити посудину з вогненебезпечною речовиною і загасити пожежу.
При порушенні правил техніки безпеки в лабораторії трапляються випадки, що вимагають негайної медичної допомоги: порізи рук склом, опік їх гарячими предметами, кислотами, лугами. Слід пам’ятати основні правила першої допомоги:
1 У випадку поранення склом необхідно видалити осколки з рани, змазати край рани розчином йоду і перев’язати бинтом.
2 У випадку опіку рук або обличчя будь-якою речовиною треба змити її великою кількістю води, а потім або розведеною оцтовою кислотою (у випадку опіку лугом), або розчином соди (у випадку опіку кислотою), а далі знову водою.
3 У випадку опіку гарячою рідиною або гарячим предметом обпечену ділянку необхідно обробити свіжоприготовленим розчином перманганату калію, змазати обпечене місце маззю від опіків. Можна присипати опік содою і забинтувати.
4 У випадку хімічних опіків очей необхідно ретельно промити очі водою, використовуючи спеціальну ванночку, а потім звернутися до лікаря.
Лабораторна робота № 1
ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
1.1 Мета роботи ― ознайомлення з класифікацією та номенклатурою неорганічних сполук.
1.2 Загальні вказівки
Неорганічні речовини поділяють на прості речовини і сполуки, які в свою чергу поділяються на декілька класів за подібністю хімічної будови та властивостей (рис.1.1).
Найважливішими класами неорганічних сполук за функціональними ознаками є оксиди, основи, кислоти, амфотерні гідроксиди і солі.
Оксидами називають бінарні сполуки елементів з оксигеном (киснем) (ЕхОу).
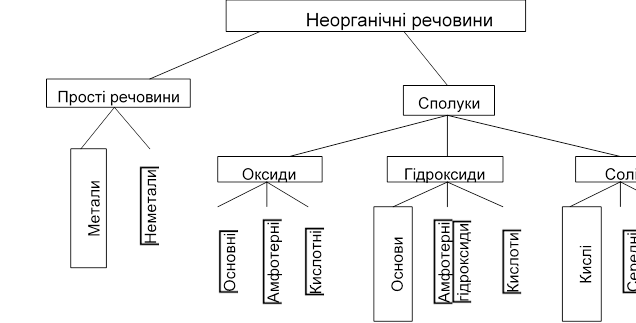
Рисунок 1.1 - Класифікація неорганічних речовин
За хімічними властивостями оксиди поділяють на солетворні й несолет-
![]()
наприклад: NO, N2O, CO тощо (таких оксидів відомо мало).
Солетворні оксиди у свою чергу поділяються на основні, кислотні та амфотерні.
Основними оксидами називаються оксиди, гідроксиди яких є основами. До основних оксидів, як правило, належать оксиди типових металів (Li, Na,K, Rb,Cs,Ca,Mg,Sr,Ba ), а також d-металів у нижчих ступенях окиснення (CrO, MnO, FeO тощо).
Під час взаємодії з кислотами або кислотними оксидами вони утворюють солі:
CaO H2SO4 CaSO4 H2O;
CaO CO2 CaSO3.
Кислотними оксидами називаються оксиди, гідроксиди яких є кислотами. Тому кислотні оксиди ще називаються ангідридами кислот. До них належать оксиди неметалів, наприклад: CO2,SO2,SO3 а також металів зі змінною валентністю у вищих ступенях окиснення, наприклад: CrO3, Mn2O7.
Під час взаємодії з основами або з основними оксидами вони утворюють солі:
SO2 2NaOH Na2SO3 H2O;
SO2 Na2O Na2SO3.
Амфотерні оксиди залежно від умов виявляють властивості основних або кислотних оксидів, тобто утворюють солі при взаємодії як з кислотами, так і з основами:
ZnO2HCl ZnCl2 H2O;
ZnO2NaOH Na2ZnO2 H2O.
До амфотерних належать оксиди деяких металів головних підгруп (Be, Al), а також оксиди багатьох d-металів побічних підгруп періодичної системи елементів у проміжних ступенях окиснення (Al2O3, Fe2O3, MnO2, Cr2O3, PbO, ZnO).
Назви оксидів елементів, які мають постійний ступінь окиснення, згідно з номенклатурними правилами ІЮПАК , складаються з двох слів: оксид + назва елемента в родовому відмінку (MgO- оксид магнію).
Якщо елемент утворює декілька оксидів, після назви елемента вказують його ступінь окиснення (римською цифрою в дужках): FeO- оксид феруму (П).
Називати оксиди можна також додаванням до слова оксид грецьких числівників: СО2 - діоксид вуглецю.
Основами називають сполуки, до складу молекул яких входять атом металу або іонNH4 і гідроксидні групи -ОН, здатні заміщуватись на кислотний залишок. Число гідроксидних груп у молекулі основи відповідає валентності металу й обумовлює кислотність основи.
З точки зору теорії електролітичної дисоціації основи – це електроліти, що дисоціюють у розчині з утворенням аніонів одного виду − гідроксид-іонів ОН:
NaOH Na OH.
Характерною властивістю основ є їхня здатність взаємодіяти з кислотами й кислотними оксидами з утворенням солей:
KOH HCl KCl H2O;
Ba(OH) 2 CO2 BaCO 3 H2O.
Назви основ утворюють з назви катіона і слова „гідроксид”. Якщо метал утворює декілька гідроксидів, ступінь його окиснення вказують римською цифрою в дужках або до слова „гідроксид” додають відповідний числівник:
Cu(OH)2− купрум (II) гідроксид; Fe(OH)3− ферум тригідроксид.
Кислотами (кислотними гідроксидами) називають сполуки, які в своїх молекулах містять атоми Гідрогену (водню), здатні заміщуватися на атоми металів з утворенням солей.
З точки зору теорії електролітичної дисоціації кислоти – це сполуки, які під час дисоціації здатні відщеплювати катіони лише одного типу − H .
Негативний іон, який утворюється в результаті відриву від молекули кислоти одного або кількох іонів Гідрогену (водню), називається кислотним залишком. Заряд його визначається числом іонів Гідрогену, що відірвалися від молекули.
За числом атомів Гідрогену (водню), здатних заміщуватися на метал з утворенням солей, кислоти поділяються на одноосновні (наприклад, азотна кислота або нітратна − HNO3), двохосновні (сірчана або сульфатна кислота − H2SO4, вугільна або карбонатна кислота − H2CO3), триосновні (ортофосфорна або ортофосфатна кислота − H3PO4).
За наявністю Оксигену (кисню) в складі молекули кислоти поділяються на оксигеновмісні (наприклад, H2SO4, HNO3) і безоксигенні (наприклад, HBr, H2S).
За міжнародними номенклатурними правилами назви оксигеновмісних кислот утворюють від кореня латинської назви кислотоутворюючого елемента, суфіксів ─ ат (вищий ступінь окиснення) або ─ ит (нижчий ступінь окиснення), а також закінчення ─ на і слова „кислота”. Якщо елемент може виявляти більше ніж два ступені окиснення в оксигеновмісних кислотах, то вживають префікси гіпо- (найнижчий ступінь окиснення) і пер- (найвищий). Наприклад, HClO - гіпохлоритна, HClO 4 - перхлоратна.
У полікислотах число атомів кислотоутворюючого елемента позначається грецьким префіксом. Назви безоксигенних кислот містять суфікс – ид. Кислоти, утворені елементом з певним ступенем окиснення, які відрізняються між собою числом молекул води, розрізняються за префіксами в назві кислоти: до назви найбагатшої на воду кислоти додають префікс орто- до назви найбіднішої – мета- . Наприклад, H3PO4 – ортофосфатна, HPO3– метафосфатна.
Деякі кислоти мають поширені побутові (тривіальні) назви. Наприклад, HCl – соляна кислота, HNO3– азотна, H2SO4– сірчана, H2CO3– вугільна.
Назви деяких кислот та їхніх кислотних залишків наведені в таблиці 2.
Характерними властивостями кислот є їхня здатність взаємодіяти з основами й основними оксидами з утворенням солей:
H2SO4 Ca(OH) 2 CaSO4 2H2O;
H2SO4 CaO CaSO4 H2O.
Амфотерні гідроксиди ― це сполуки, під час дисоціації яких можуть утворюватись як іони Н , так і іони ОН, тобто це гідроксиди, які проявляють як основні, так і кислотні властивості залежно від природи другого компонента, що бере участь у кислотно-основній взаємодії.
Таблиця 2 - Деякі кислоти та їхні залишки
|
|
Кислота
|
Кислотний залишок |
|
|
Формула |
Назва |
Формула |
Назва |
|
1 |
2 |
3 |
4 |
|
HF |
Фторидна, фтороводнева, плавікова |
F |
Фторид-іон |
|
HCl |
Хлоридна, хлороводнева, соляна |
Cl |
Хлорид-іон |
|
HBr |
Бромідна, бромоводнева |
Br |
Бромід-іон |
|
HI |
Іодидна, іодоводнева |
I |
Іодид-іон |
|
HCN |
Ціанідна, ціановоднева |
CN |
Ціанід-іон |
|
HNO3 |
Нітратна, азотна |
NO3 |
Нітрат-іон |
|
HNO2 |
Нітритна, нітратна (Ш), азотиста |
NO2 |
Нітрит-іон |
|
H2S |
Сульфідна, сірководнева |
HS
|
Гідрогенсульфід-іон, гідросульфід-іон, |
|
S2 |
Сульфід-іон |
||
|
H2SO4 |
Сульфатна, сірчана |
HSO4 |
Гідрогенсульфат-іон, гідросульфат-іон |
|
SO24 |
Сульфат-іон
|
||
|
H2SO3 |
Сульфітна, сульфатна(1V), сірчиста |
HSO3
|
Гідрогенсульфіт-іон, гідросульфіт-іон |
|
SO32 |
Сульфіт-іон, сульфат (1V)-іон |
||
|
H2CO3 |
Карбонатна, вугільна |
HCO3 |
Гідрогенкарбонат-іон, гідрокарбонат-іон |
|
CO32 |
Карбонат-іон |
||
|
H2SiO3 |
Силікатна, кремнієва |
HSiO3 |
Гідрогенсилікат-іон, гідросилікат-іон |
|
SiO32 |
Силікат-іон
|
||
Продовження таблиці 2
|
1 |
2 |
3 |
4 |
|
H3PO4 |
Ортофосфатна, ортофосфорна |
H2PO4
|
Дигідрогенфосфат- іон, дигідрофосфат- іон |
|
HPO24 |
Гідрогенфосфат-іон, гідрофосфат-іон |
||
|
PO34 |
Фосфат-іон, ортофосфат-іон |
||
|
HMnO4 |
Перманганатна, марганцева |
MnO4 |
Перманганат-іон, манганат (VП)-іон |
|
CH3COOH |
Ацетатна, оцтова |
CH3COO |
Ацетат-іон |
До амфотерних гідроксидів належать гідроксиди деяких металів головних підгруп (Be, Al), а також багатьох металів побічних підгруп періодичної системи елементів у проміжних ступенях окиснення: Zn(OH)2,Sn(OH)2, Pb(OH)2, Mn(OH)2, Fe(OH)2, Cr(OH)3, Al(OH)3, Bi(OH) 3.
Під час взаємодії з кислотами амфотерні гідроксиди проявляють властивості основ, а під час взаємодії з основами – властивості кислот:
Zn(OH)2 2HCl ZnCl2 H2O;
Zn(OH)2 2NaOH Na2ZnO2 2H2O.
Назви амфотерних гідроксидів утворюються подібно до назв основ: Zn(OH)2─ гідроксид цинку.
Солі можна розглядати як продукти повного чи часткового заміщення атомів Гідрогену (водню) у кислотах на атоми металів або як продукти повного чи часткового заміщення гідроксидних груп в основах на кислотні залишки.
Розрізняють такі типи солей: нормальні, або середні, кислі та основні.
Нормальні солі – це продукти повного заміщення атомів Гідрогену (водню) кислоти на атоми металу:
2NaOH H2SO4 Na2SO4 2H2O.
Кислі солі – це продукти неповного заміщення атомів гідрогену (водню) в молекулі кислоти на атоми металу:
NaOH H2SO4 NaHSO4 H2O.
Основні солі – це продукти неповного заміщення гідроксильних груп у молекулі багатокислотної основи або амфотерного гідроксиду на кислотні залишки:
Fe(OH)3 H2SO4 FeOHSO4 2H2O.
Можна вважати, що молекула солі утворюється із залишків основи і залишків кислоти.
За міжнародними номенклатурними правилами назва солі складається з назви металу та латинської назви кислотного залишку. Наприклад, Na2SO4- натрій сульфат або сульфат натрію.
У назві кислих солей до латинської назви аніона додають числівник, що відповідає числу атомів Гідрогену (водню) в молекулі кислоти і префікс “гідроген” (“гідро”). Наприклад, Na2HPO4 − натрій гідрогенфосфат або гідрофосфат натрію,NaH2PO4 − натрій дигідрогенфосфат або дигідрофосфат натрію.
У назвах основних солей до назви катіона додають грецький числівник (ди, три...) , який вказує на число незаміщених груп OH і префікс “гідроксо”-: FeOHCl - гідроксоферум (ІІ) хлорид, Al(OH) 2NO3 - дигідроксоалюміній нітрат або нітрат дигідроксоалюмінію.
1.3 Порядок виконання роботи
Дослід 1 Зміна забарвлення індикаторів у розчинах кислот і лугів Налити в три пробірки дистильовану воду і краплями добавити розчин лакмусу до появи помітного забарвлення. У першу пробірку добавити кілька крапель кислоти, в другу – лугу, третя пробірка є контрольною. Спостерігати змінення забарвлення індикатора лакмусу.
Такий самий дослід провести з індикаторами: метилоранжем та фенолфталеїном.
Заповнити наступну таблицю.
|
Індикатор |
З |
абарвлення індикато |
ра |
|
у воді |
в кислоті |
в лузі |
|
|
Лакмус Метилоранж Фенолфталеїн |
|
|
|
Дослід 2 Добування кислот і їхні властивості
1 У пробірку насипати невелику кількість сухого ацетату натрію і змочити розбавленим розчином сірчаної кислоти. За запахом визначити речовину, яка утворилась. В отвір пробірки, не торкаючись до стінок, помістити лакмусовий папірець. Що в цей час спостерігається?
2 Взаємодія кислот з металами. У три пробірки налити розчини сірчаної, соляної та оцтової кислот. У кожну пробірку опустити по кілька гранул цинку. Спостерігати виділення газу.
Дослід 3 Добування і властивості основ
1 Взаємодія гідроксидів із солями. У три пробірки налити невеликі кількості розчинів сульфату міді (П), хлориду заліза (Ш) і сульфату заліза (П). До розчинів добавити такі самі об’єми 10%-го розчину гідроксиду натрію. Зазначити забарвлення новоутворених осадів.
2 Реакція гідроксиду міді (П). Гідроксид міді (П) з попереднього досліду помістити в дві пробірки. В одну з них добавити розчин сірчаної кислоти й перемішати, а іншу пробірку нагрівати до появи чорного осаду.
1.4 Оформлення результатів роботи
Дослід 1 Скласти рівняння електролітичної дисоціації кислоти й лугу. Які іони зумовлюють зміну забарвлення індикатора? Досліди 2,3 Скласти рівняння реакцій.
Питання для самоперевірки
1 Визначити характер оксидів: СaO, MgO, Al2O3, PbO2,SO2,SO3, СО2, Pb2O5.
Які з них будуть взаємодіяти між собою. Написати рівняння відповідних реакцій.
2 Скласти формули вищих оксидів Сульфуру (сірки), Алюмінію, Мангану (марганцю), Нітрогену (азоту), Силіцію (кремнію). Назвати ці оксиди.
3 Як, виходячи із соляної кислоти, одержати: а) хлорид натрію, б) хлорид магнію, в) хлорид гідроксокальцію, г) хлорид дигідроксоалюмінію. Написати рівняння реакцій.
4 Із якими з перелічених речовин взаємодіє NaOH: з оксидом кальцію, оксидом сірки (1У), сірчаною кислотою, оксидом алюмінію. Написати рівняння відповідних реакцій.
5 Написати рівняння реакцій таких перетворень:Сa CaO Ca(OH)2 Ca(HSO4)2 CaSO4.
Лабораторна робота № 2
ВИЗНАЧЕННЯ МОЛЯРНОЇ МАСИ ЕКВІВАЛЕНТА СКЛАДНОЇ РЕЧОВИНИ
2.1 Мета роботи ― визначення молярної маси еквівалента карбонату ка-
льцію.
2.2 Загальні вказівки
Під час виконання даної роботи необхідно знати, що хімічним еквівален-
том (Е) називається реальна або умовна частинка речовини, яка може заміщувати, приєднувати, вивільняти або будь-яким іншим чином бути еквівалентною одному іону водню H у кислотно-основних, або одному електрону в окисновідновних реакціях.
Так, наприклад, у сполуках HCl, H2S,NH3 формули еквівалентів Хлору,
1 1
Сульфуру, Нітрогену мають вигляд: E(Cl) Cl, E(S) ![]() S, E(N)
S, E(N) ![]() N.
N.
2 3
Для визначення складу еквівалента хімічної сполуки необхідно виходити з конкретної реакції, в якій бере участь дана речовина. Наприклад, сульфатна кислота з гідроксидом натрію може взаємодіяти з утворенням кислої або середньої солі:
H2SO4 NaOH NaHSO4 H2O; H2SO4 2NaOH Na2SO4 2H2O.
У першому випадку еквівалент сульфатної кислоти EH2SO4 має склад,
H2SO4. Оскільки в реакцію вступає така кількість кислоти, яка відповідає одному атому Гідрогену. Отже EH2SO4 = H2SO4 . У другому випадку в реакції з гідроксидом натрію бере участь така кількість кислоти, яка відповідає двом
1
атомам Гідрогену. У такому разі EH2SO4 = ![]() 2H2SO4.
2H2SO4.
Масу 1 моль еквівалентів називають молярною масою еквівалента ( МЕ, г/моль.).
Молярні маси еквівалентів окремого елемента А і складних речовин можна розрахувати за формулами:
![]() МА МА
МА МА
М ;
Е(А) Валентність В
М оксиду М ![]() ;
;
Е(оксиду) Кількість атомів елемента Валентність елемента
М М
![]() М кислоти кислоти ;
М кислоти кислоти ;
Е(кислоти) Основність кислоти nН
М М
![]() М основи основи ;
М основи основи ;
Еоснови Кислотність основи n OH
М М
![]() M солі солі ;
M солі солі ;
Е(солі) Зарядкатіона кількість катіонів Z n
кат кат
![]() МЕіону | зарядМіонуіону | |МZ іону | .
МЕіону | зарядМіонуіону | |МZ іону | .
іону
Для розрахунку молярного об’єму еквівалента газу необхідно знати кількість молів еквівалентів в одному молі газу:
![]() VM .
VM .
VMEгазу νЕгазу
Слід також звернути увагу на формулювання закону еквівалентів: хімічні елементи сполучаються один з одним, а речовини взаємодіють і утворюються в еквівалентних кількостях.
Так, для реакції А ВС D закон еквівалентів має вигляд νE(A) νE(B) νE(C) νE(D) .
m
Оскільки νE(A) ![]() ,
,
ME
|
то |
m(A)
ME(A) |
m(B) , ME(B) |
m(B) ME(B)
|
Тобто, закон еквівалентів може бути сформульований наступним чином:
маси речовин, що взаємодіють або утворюються, є пропорційними молярних мас їхніх еквівалентів.
Для газів замість мас у законі еквівалентів можна використовувати відповідні об’єми:
![]()
![]() m(A) V(B) , або m(A) ME(A) .
m(A) V(B) , або m(A) ME(A) .
ME(A) VМE(B) V(B) VME(B)
2.3 Порядок виконання роботи
Для визначення молярної маси еквівалента карбонату кальцію використовується реакція взаємодії його з соляною кислотою:
CaCO3 2HCl CaCl2 CO2 H2O.
Вуглекислий газ, що утворюється при цьому, збирають і вимірюють його об’єм.
З цією метою в роботі використовується прилад для визначення об’єму газу (рис. 2.1).
Помістити наважку мармуру в колбу Вюрца 1, закрити ії пробкою з краплинною лійкою 2 і перевірити на герметичність. Для цього відкрити кран краплинної лійки і підняти хімічну лійку 3 з водою на деяку висоту. Закрити кран краплинної лійки, укріпити хімічну лійку 3 в штативі і слідкувати за рівнем рідини. Якщо рівень води в бюретці буде безперервно знижуватись, то прилад є негерметичним. Необхідно усунути причини, що викликають негерметичність. Якщо прилад є герметичним, то в перший момент під час опускання лійки рівень води в бюретці 4 трохи знизиться, а далі залишиться постійним. Після цього треба ще раз відкрити кран краплинної лійки і, пересуваючи хімічну лійку вгору, установити рівень води в бюретці на нульовій позначці або трохи нижче, а далі закрити кран краплинної лійки й опустити хімічну лійку.
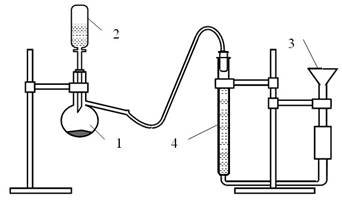
Рисунок 2.1 - Прилад для визначення молярної маси еквівалента
1– колба Вюрца; 2 – краплинна лійка; 3 – хімічна лійка; 4 – бюретка
Відмірявши циліндром 10 мл розведеної соляної кислоти, помістити її в краплинну лійку, а далі вилити в колбу Вюрца, до якої поміщений мармур. Кран краплинної лійки перекрити в той момент, коли в ній ще знаходиться декілька крапель кислоти з метою перешкоджання проникнення зовнішньої атмосфери в колбу Вюрца. Під тиском газу, що утворився в результаті хімічної реакції, рідина з бюретки переміщується в лійку. Після закінчення реакції й охолодження колби до кімнатної температури привести рідину в бюретці і лійці до одного рівня, тобто створити в бюретці тиск, що дорівнює атмосферному. Для цього лійку потрібно опустити вниз, записати новий рівень рідини в бюретці і показання термометра та барометра під час досліду.
2.4 Оформлення результатів роботи
Записати в журнал результати досліду:
1) масу мармуру mCaCO3 , г;
2) об’єм соляної кислоти, залитий у колбу Вюрца VHCl , мл;
3) рівень рідини в бюретці:
- до реакції Vпоч, мл;
- після реакції Vкін, мл;
4) температуру t, 0С; 5) тиск р, мм рт. ст.
Розрахувати об’єм газу, що виділився, за формулою
VCO2 Vкін Vпоч VHCl та абсолютну температуру Т за формулою Т=273+t, К.
Застосувавши рівняння Менделєєва-Клапейрона PV ![]() m RT, обчислити
m RT, обчислити
M
масу одержаного вуглекислого газу (mCO ).
2
Скориставшись законом еквівалентів
![]() mCaCO3 ME(CaCO3) ,
mCaCO3 ME(CaCO3) ,
mCO2 ME(CO2)
обчислити молярну масу еквівалента карбонату кальцію, маючи на увазі те, що молярна маса еквівалента CO2 в реакції нейтралізації, що проходить з утворенням середньої солі, дорівнює ![]() моля.
моля.
Обчислити відносну похибку досліду за формулою
теор експ
![]() П МЕ МЕ 100%,
П МЕ МЕ 100%,
теор
МЕ
де П− відносна похибка, %;
МЕтеор − теоретичне значення молярної маси еквівалента;
МекспЕ − значення молярної маси еквівалента, обчислене на основі вимірювань.
Питання для самоперевірки
1 Що називається еквівалентом речовини?
2 Які елементи мають змінні значення еквівалентів?
3 Як обчислюється молярна маса еквівалента елемента та складних речовин? У яких одиницях вона виражається?
4 Чи однакові молярні маси еквівалентів Феруму у сполуках FeCl2, FeCl3 та хрому у сполуках CrCl3, Cr2(SO4)3?
5 Як формулюється закон еквівалентів? Навести його математичне вираження.
6 На чому базується метод визначення молярної маси еквівалента карбонату кальцію?
7 Обчислити молярну масу еквівалента Купруму, якщо відомо, що 3,18 г міді повністю сполучилися з 0,8 г кисню з утворенням CuO.
Лабораторна робота № 3
ВИЗНАЧЕННЯ ТЕПЛОВИХ ЕФЕКТІВ ХІМІЧНИХ РЕАКЦІЙ
3.1 Мета роботи ― визначення теплоти гідратації солі на основі калориметричних вимірювань.
3.2 Загальні вказівки
Під теплотою гідратації солі слід розуміти тепловий ефект реакції утворення кристалогідрату з безводної солі, віднесений до одного моля речовини.
Оскільки в хімії часто відбуваються процеси за сталого тиску й сталої температури, то слід мати на увазі, що в ізобарно-ізотермічних процесах тепловий ефект реакції визначається зміною ентальпії системи ΔH в ході реакції. Ця величина пов’язана з теплотою, що виділяється або поглинається в ході перетворення, співвідношенням
ΔH = -Qp
У зв’язку з тим, що безпосередньо теплоту гідратації солі визначити важко, її знаходять на основі закону Гесса, визначаючи теплоти розчинення безводної солі та її кристалогідрату.
Згідно з законом Гесса тепловий ефект реакції не залежить від шляху її перебігу, а залежить лише від природи і фізичного стану вихідних речовин та продуктів реакції.
Таким чином, загальний тепловий ефект процесу розчинення кристалічної речовини дорівнює сумі теплових ефектів окремих стадій, що складають процес розчинення:
ΔH=ΔH1+ΔH2
У даній роботі процес розчинення сульфату міді у воді складається з двох стадій.
Перша стадія - процес гідратації солі, тобто утворення кристалогідрату сульфату міді:
CuSO4К 5H2OР →CuSO4 5H2OК;ΔHГІДР .
Друга стадія - розчинення кристалогідрату у воді:
СuSO4 5H2OК aq →CuSO4Р; ΔHР.КГ. .
Сумарний процес розчинення безводної солі
CuSO4К 5H2OР aq →CuSO4Р; ΔHР.Б.С.
має тепловий ефект згідно з законом Гесса:
ΔНР.Б.С. ΔНГІДР. ΔН Р.К Г.
Таке співвідношення дозволяє розрахувати теплоту гідратації сульфату міді.
3.3 Порядок виконання роботи
Дослід потрібно проводити у спрощеному калориметрі (рис. 3.1).
|
Рисунок 3.1– Калориметрична установка 1– мішалка, 2 – калориметрична склянка, 3 – зовнішня посудина, 4 – кришка, 5 - термометр
|
жку кристалогідрату. Під час проведення досліду слід звернути увагу на пониження температури після внесення кристалогідрату й відмітити найнижчу температуру розчину tmin
|
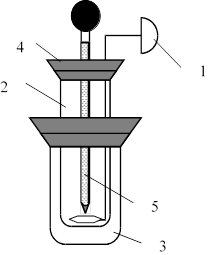 У внутрішню посудину налити 25 мл дистильованої води, опустити в неї термометр і заміряти температуру з точністю до 0,10С – початкову температуру досліду tпоч. Висипати наважку безводної солі в посудину з водою. Обережно перемішуючи розчин мішалкою, слідкувати за зміною температури, відмітити найвищу температуру розчину tmax.
У внутрішню посудину налити 25 мл дистильованої води, опустити в неї термометр і заміряти температуру з точністю до 0,10С – початкову температуру досліду tпоч. Висипати наважку безводної солі в посудину з водою. Обережно перемішуючи розчин мішалкою, слідкувати за зміною температури, відмітити найвищу температуру розчину tmax.
Дослід повторити, взявши нава-
3.4 Оформлення результатів роботи
Записати в лабораторний журнал дані досліду для обох солей: 1) масу солі mсолі, г;
2) об’єм води Vводи, мл;
3) початкову температуру tпоч., 0С;
4) максимальну (мінімальну) температуру (tmax, tmin), 0C.
Розрахувати зміну температури за формулою Δt = tmax(min) tïî÷. .
Визначити кількість теплоти, що виділяється або поглинається під час розчинення безводної солі та кристалогідрату, у перерахуванні на 1 моль речовини за формулою Δt·С·С p·Mc
Qp ![]() 3 ,
3 ,
mc·10
де Qp - кількість теплоти, кДж/моль;
Δt- різниця температур, 0С;
C - питома теплоємність розчину прийнята рівною теплоємності води, тобто 4,18 (Дж/г ∙ град);
mp - маса розчину, г; mc- маса солі, г;
Mc- молярна маса солі, г/моль. Записати теплові ефекти розчинення двох солей, виходячи з того, що
ΔH = -Qp.
Розрахувати теплоту гідратації ΔHгідр ΔНр.б.с. - ΔНр.к г .
Розрахувати відносну похибку досліду
теор - ΔНексп
ΔН гідр гідр
![]() П теор 100%,
П теор 100%,
ΔН
гідр
де П – відносна похибка, %;
ΔHтеорCuSO −77,8 кДж/моль; гідр 4
ΔHекспCuSO − розраховане значення теплоти гідратації. гідр 4
Питання для самоперевірки
1 Чим визначається тепловий ефект хімічної реакції? В яких одиниця він вимірюється?
2 Що називається теплотою утворення речовин?
3 Теплоти утворення яких речовин дорівнюють нулю?
4 Який закон лежить в основі термохімічних розрахунків? Сформулюйте цей закон.
5 Що називається теплотою гідратації солі? Як можна розрахувати теплоту гідратації солі?
Лабораторна робота № 4
ЗАЛЕЖНІСТЬ ШВИДКОСТІ ХІМІЧНОЇ РЕАКЦІЇ ВІД КОНЦЕНТРАЦІЙ РЕАГУЮЧИХ РЕЧОВИН
4.1 Мета роботи − вивчення впливу концентрації реагуючих речовин на швидкість хімічної реакції.
4.2 Загальні вказівки
Під час виконання даної роботи необхідно знати, що швидкість хімічної реакції визначається зміною концентрацій речовин, які вступають в реакцію або утворюються в результаті реакції за одиницю часу в одиниці об’єму (для гомогенних реакцій) або на одиниці поверхні поділу фаз (для гетерогенних реакцій). Знайдена таким чином швидкість є середньою швидкістю реакції за певний проміжок часу:
V = ±Ct = Ct22 --Ct11 ,
де C1 і C2 - концентрації будь-якої з речовин у моменти часу t1, t2.
Необхідно пам’ятати, що швидкість хімічних реакцій залежить від природи взаємодіючих речовин і від умов проведення реакцій, насамперед від концентрації реагуючих речовин і температури.
Залежність швидкості хімічної реакції від концентрації реагуючих речовин виражається законом дії мас: швидкість хімічної реакції за сталої температури пропорційна добутку концентрацій реагуючих речовин у степенях, що дорівнюють значенням стехіометричних коефіцієнтів.
У загальному вигляді для реакції аА + вВ + ... = ... закон дії мас має вигляд:
V = kCAa · CBâ,
де CA і CB - концентрації взаємодіючих речовин; k − константа швидкості, що залежить від природи взаємодіючих речовин, температури, каталізатора, але не залежить від концентрації речовин.
4.3 Порядок виконання роботи
Залежність швидкості реакції від концентрації реагуючих речовин вивчають на прикладі взаємодії тіосульфату натрію з сірчаною кислотою:
Na2S2O3 +H2SO4 →Na2SO4 +SO2 +S↓+H2O
Ознакою реакції є помутніння розчину внаслідок виділення сірки.
Необхідно приготувати розчини тіосульфату натрію різних концентрацій. Для цього в чотири великі пробірки потрібно послідовно за допомогою бюретки налити: в першу пробірку − 5 мл розчину тіосульфату натрію і 15 мл дистильованої води, в другу – 10 мл тіосульфату натрію і 10 мл дистильованої води, в третю – 15 мл тіосульфату натрію і 5 мл води, в четверту – 20 мл тіосульфату натрію.
У чотири маленькі пробірки потрібно налити по 5 мл сірчаної кислоти й долити кислоту по черзі в кожну з чотирьох пробірок з розчином тіосульфату натрію. Для перемішування розчину тіосульфату з розчином сірчаної кислоти пробірку потрібно закрити великим пальцем і двічі перевернути. Визначити час, через який в результаті перемішування почнеться помутніння в кожній пробірці.
4.4 Оформлення результатів роботи
Результати спостережень занести до наступної таблиці.
|
Номер пробірки |
Об’єм V, мл |
Відносна концентрація Na2S2O3 |
Об’єм V, мл H2SO4 |
Час t появи муті, с |
Відносна швидкість реакції 1/t |
||
|
Na2S2O3 |
H2O |
суміші |
|||||
Розрахувати швидкість реакції в умовних одиницях (1/t). Побудувати графік залежності швидкості реакції від концентрації тіосульфату натрію, відкладаючи на осі абсцис концентрацію, а на осі ординат – швидкість реакції в умовних одиницях. На основі графіка зробити висновок про залежність швидкості реакції від концентрації. Написати рівняння реакції і математичне вираження закону дії мас.
Питання для самоперевірки
1 Чим визначається швидкість хімічної реакції?
2 Від яких факторів залежить швидкість хімічних реакцій?
3 Який закон виражає залежність швидкості реакції від концентрації реагуючих речовин? Сформулюйте цей закон.
4 Що таке константа швидкості реакції?
Лабораторна робота № 5
ХІМІЧНА РІВНОВАГА
5.1 Мета роботи ― вивчення впливу концентрації реагуючих речовин на стан хімічної рівноваги.
5.2 Загальні вказівки
Слід мати на увазі, що хімічна рівновага можлива лише для оборотних реакцій. Стан системи, за якого швидкості прямої та зворотної реакцій стають однаковими, називається хімічною рівновагою. Концентрації реагуючих речовин не змінюються тому мають назву рівноважних концентрацій. Вони позначаються формулами речовин у квадратних дужках.
Величина, яка дорівнює відношенню добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій вихідних речовин у степенях, що дорівнюють стехіометричним коефіцієнтам, називається константою рівноваги. Наприклад, для оборотної реакції: 4HCl O2 2H2O 2Cl2 константа рівноваги має вигляд:
K [![]() H O]2 [Cl ]2 .
H O]2 [Cl ]2 .
Необхідно звернути увагу на те, що константа рівноваги не залежить від концентрації речовин у системі, а залежить лише від природи реагентів і температури.
Хімічна рівновага залишається незмінною доти, доки залишаються постійними параметри, за яких вона встановилася. У випадку зміни умов рівновага зміщується. Через деякий час у системі знову настає рівновага, яка характеризується новими рівноважними концентраціями всіх речовин і новою рівністю швидкостей прямої і зворотної реакцій.
У загальному випадку напрям зміщення рівноваги визначається за принципом Ле Шательє: якщо на систему, що знаходиться в рівновазі, впливати ззовні, то рівновага зміщується в напрямку тієї реакції, яка протидіє зовнішньому впливу.
5.3 Порядок виконання роботи
У даній роботі розглядається оборотна реакція взаємодії хлориду заліза (Ш) з роданідом калію. Роданід заліза Fe(SCN)3 надає розчину червоного кольору. За зміною інтенсивності кольору можна судити про зміну концентрації Fe(SCN)3, тобто про зміщення рівноваги в той чи інший бік. Для цього необхідно в склянці змішати 10 мл розведеного розчину хлориду заліза FeCl3 і 10 мл розчину роданіду калію KSCN , розлити приготовлений розчин порівну в чотири пробірки, одну з яких залишити як контрольну. В першу пробірку додати 1 мл концентрованого розчину хлориду заліза, в другу – невелику кількість кристалічного роданіду калію, в третю – кристалічного хлориду калію. Розчини в усіх пробірках розмішати. Звернути увагу на інтенсивність зміни забарвлення розчину, порівнюючи його з розчином у контрольній пробірці.
5.4 Оформлення результатів роботи
Записати рівняння реакцій між FeCl3 і KSCN . Зробити висновок щодо напрямку зміщення рівноваги за додання: хлориду заліза, роданіду калію, хлориду калію.
Пояснити зміни кольору, керуючись принципом Ле Шательє, записати вирази закону дії мас для прямої і зворотної реакції, а також константи рівноваги для даної системи.
Питання для самоперевірки
1 Який стан називається станом хімічної рівноваги? Для яких реакцій він є характерним?
2 Що таке константа рівноваги?
3 Від яких факторів залежить константа рівноваги?
4 Які фактори впливають на стан хімічної рівноваги?
5 Який принцип визначає напрям зміщення рівноваги? Сформулюйте цей принцип.
Лабораторна робота № 6
ПРИГОТУВАННЯ РОЗЧИНУ ЗАДАНОЇ КОНЦЕНТРАЦІЇ І ВСТАНОВЛЕННЯ ЙОГО ТИТРУ
6.1 Мета роботи ― набуття навичок приготування розчинів з більш концентрованого розчину.
6.2 Загальні вказівки
Склад розчину виражається концентрацією або часткою розчиненої речовини.
Молярна концентрація (См) визначається відношенням кількості речовини до об’єму розчину, моль/л:
реч.
См ![]() .
.
Vрозч.
Молярна концентрація еквівалента, або нормальність (Сн) визначається відношенням кількості речовини еквівалента до об’єму розчину, моль/л:
реч.екв.
Сн ![]() .
.
Vрозч.
Моляльна концентрація (Сm) визначається відношенням кількості речовини до маси розчинника, моль/кг:
реч.
Сm ![]() .
.
mрозч.
Масова концентрація (або титр) T визначається відношенням маси розчиненої речовини до об’єму розчину, г/мл:
T ![]() mреч .
mреч .
Vрну
Розрізняють такі частки розчиненої речовини: молярну, масову та об’ємну. Найчастіше вживаються масова та молярна частки.
Масова частка або процентна концентрація С%, визначається відношенням маси розчиненої речовини до маси всього розчину:
mреч. m ω ![]() m або С%
m або С% ![]() mрреч.ну 100%.
mрреч.ну 100%.
рну
![]()
![]() Молярна частка розчиненої речовини, або мольна частка N визначається відношенням числа молів розчиненої речовини до сумарного числа молів усіх компонентів розчину: Ni = +i , або в загальному вигляді: Ni =∑i j .
Молярна частка розчиненої речовини, або мольна частка N визначається відношенням числа молів розчиненої речовини до сумарного числа молів усіх компонентів розчину: Ni = +i , або в загальному вигляді: Ni =∑i j .
1 2
6.3 Порядок виконання роботи
Дослід 1 Приготування 0,1 н розчину HCl з більш концентрованого розчину
Спочатку треба розрахувати об’єм (мл) вихідного розчину кислоти, потрібний для приготування 100 мл 0,1 н розчину:
1 л 0,1 н розчину HCl містить 0,1 моль еквівалента HCl . Молярна маса еквівалента HCl дорівнює молярній масі, тому в 100 мл 0,1 н розчину HCl міститься 0,365 г HCl .
Далі необхідно розрахувати, об’єм концентрованої соляної кислоти, в якому міститься розрахована маса HCl . Із таблиці густини розчинів сильних кислот і лугів видно, що соляна кислота з густиною 1,06 г/см3 має концентрацію 12,2%. Оскільки,
![]() mHCl 100%,
mHCl 100%,
С%
mрну
то
![]() mHCl 100% .
mHCl 100% .
mрну
C%
Для перерахування знайденої маси кислоти на її об’єм потрібно скористатися формулою
m
V ![]() . ρ
. ρ
За допомогою мірного циліндра відміряти розрахований об’єм соляної кислоти, вилити кислоту в мірну колбу на 100 мл і довести дистильованою водою до позначки. Одержаний розчин ретельно перемішати.
Дослід 2 Встановлення концентрації (титру) приготовленого розчину
Для перевірки концентрації приготовленого розчину соляної кислоти користуються методом титрування, який полягає в тому, що до певного, точно виміряного об’єму кислоти поступово додають з бюретки розчин лугу відомої концентрації до досягнення еквівалентної кількості, яка визначається за допомогою індикатора.
Титрування потрібно провести наступним чином. Бюретку наповнити 0,1 н розчином NaOH. Потім, підставивши під неї колбу або склянку і відкривши затискач, заповнити відтягнуту трубку бюретки так, щоб у ній не залишилось бульбашок повітря. Встановити рівень розчину на нульовій позначці.
У чисту конічну колбу перенести піпеткою 10 мл приготовленого розчину кислоти й додати 2 – 3 краплі індикатора – фенолфталеїну (в кислому й нейтральному середовищах фенолфталеїн стає безбарвним, у лужному середовищі він має малиновий колір). Колбу з кислотою потрібно поставити на аркуш білого паперу для отримання можливості спостерігати за зміною кольору індикатора. Луг додавати краплями з бюретки в колбу (вміст колби перемішувати) доти, доки від однієї краплі лугу розчин в колбі набуде блідо-рожевого кольору. Повторювати дослід декілька разів, доки останні три відліки не будуть відрізнятися один від одного не більше ніж на 0,2 – 0,3 мл.
6.4 Оформлення результатів роботи
Дослід 1 Занести в графу “розрахунки” дані, необхідні для приготування 100 мл 0,1 н розчину HCl .
Дослід 2 Результати титрування оформити в вигляді таблиці:
|
Номер проби |
Об’єм кислоти, мл |
Об’єм лугу, мл |
Нормальність лугу, моль/л |
Розрахувати нормальність кислоти, користуючись формулою Сн(к - ти) V(лугу)
![]() .
.
Сн(лугу) V(к-ти)
Розрахувати відносну похибку досліду за формулою
![]() П Снтеор Секспн 100% ,
П Снтеор Секспн 100% ,
теор
Сн
де П− відносна похибка, %;
Снтеор − теоретичне значення нормальності розчину (в даному разі – 0,1);
Секспн − обчислене значення нормальності розчину.
Розрахувати титр приготовленого розчину кислоти за формулою:
Т Сн ME ,
1000
де T − титр приготовленого розчину кислоти, г/мл;
Cн − нормальність приготовленого розчину кислоти, моль/л; ME − молярна маса еквівалента кислоти, г/моль.
Питання для самоперевірки
1 Чим виражається склад розчину?
2 Скільки грамів HCl міститься в 100 мл 0,1 н розчину HCl ?
3 Визначити молярну й нормальну концентрації 30% розчину сірчаної кислоти з густиною 1,224 г/см3.
4 Що таке титр розчину? Які розчини називаються титрованими?
5 У чому полягає процес титрування?
Лабораторна робота № 7
ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ. РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ
7.1 Мета роботи ― вивчення хімічної рівноваги та можливості перебігу реакцій в розчинах електролітів.
7.2 Загальні вказівки
Під час виконання лабораторної роботи необхідно знати, що електроліти – це речовини, які розпадаються в розчинах або розплавах на позитивно заряджені іони (катіони) і негативно заряджені іони (аніони). Процес розпаду молекул на іони – електролітична дисоціація – відбувається під дією полярних молекул розчинника. При цьому одні речовини розпадаються на іони повністю (сильні електроліти), а інші − лише частково (слабкі електроліти).
До сильних електролітів належать майже всі солі, деякі мінеральні кислоти (HNO3, H2SO4розв, HCl, HBr, HJ ) і основи, утворені лужними та лужноземельними металами (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH) 2.
До слабких електролітів належать вода, практично всі органічні кислоти, деякі мінеральні кислоти (H2S, H2CO3, H2SiO3, HCN ), а також основи, утворенні p,d,f - металами, та Mg(OH)2, NH4OH.
Здатність електролітів до дисоціації на іони визначається ступенем дисоціації і константою дисоціації К.
nдис [K ][A] (для електроліту КА),
, К
n [KA]
де n дис − число молекул, що розщепилися на іони; n − загальне число розчинених молекул;
[K],[A],[KA] − рівноважні концентрації іонів та недисоційованих молекул.
Необхідно звернути увагу на те, що більш зручною характеристикою сили електроліту є константа дисоціації, оскільки К, як і , залежить від природи розчиненої речовини й розчинника та від температури, але на відміну від вона не залежить від концентрації розчину.
Слід мати на увазі, що багатоосновні кислоти й багатокислотні основи дисоціюють ступінчасто. Наприклад:
H3PO4 H H2PO4 /перший ступінь/; H2PO4 H HPO24 /другий ступінь/;
HPO24 H PO34 /третій ступінь/.
У водних розчинах електролітів необхідно враховувати дисоціацію води як слабкого електроліту:
H2OHOH
Іонний добуток води [H] · [OH] для будь-яких водних розчинів є постійною величиною, що дорівнює 10-14 (t=220C).
Для характеристики реакції середовища доцільно користуватися водневим показником pH lg[H]. В нейтральних розчинах рН=7, в кислих рН < 7, в лужних рН > 7.
Для якісного визначення реакції середовища застосовують індикатори, колір яких змінюється залежно від величини pH розчину. Найчастіше використовують такі індикатори: лакмус, фенолфталеїн і метилоранж.
Необхідно пам’ятати, що реакції обміну в розчинах електролітів практично відбуваються в бік утворення осаду (малорозчинних речовин), газів (летких речовин) і слабких електролітів (малодисоційованих сполук).
Під час складання іонних рівнянь реакцій треба керуватися тим, що сильні розчинні електроліти, як практично повністю дисоційовані, пишуться у вигляді іонів, а речовини малодисоційовані, малорозчинні й газоподібні записують у молекулярному вигляді.
7.3 Порядок виконання роботи
Дослід 1 Хімічна рівновага в розчинах слабких електролітів
1 У дві пробірки налити по 5 мл дистильованої води й додати в кожну з них по 2 краплі метилоранжу. Одну з пробірок залишити контрольною для порівняння кольору. У другу з пробірок додати одну краплю концентрованої оцтової кислоти СН3СООНі звернути увагу на зміну кольору. Розділити вміст другої пробірки на дві частини і до однієї з них додати невелику кількість кристалічного ацетату натрію СН3СООNa ретельно перемішати і порівняти колір розчинів у всіх трьох пробірках.
2 У дві пробірки налити по 5 мл дистильованої води й додати в кожну з них по 2 краплі фенолфталеїну. Одну з пробірок залишати контрольною для порівняння кольору. У другу з пробірок додати одну краплю концентрованого розчину гідроксиду амонію NH4OH. Звернути увагу на зміну кольору. Розділити вміст другої пробірки на дві частини. До однієї з них додати трохи кристалічного хлориду амонію NH4Cl, ретельно перемішати й порівняти колір розчинів у всіх трьох пробірках.
Дослід 2 Реакції в розчинах електролітів
1 У пробірку налити 2-3 мл розчину нітрату калію KNO3 й додати туди стільки ж розчину хлориду натрію NaCl . Звернути увагу на те, що відбувається.
2 В одну з пробірок налити 2 мл розчину сульфату магнію MgSO4, в другу стільки ж розчину сульфату хрому Cr2(SO4)3, в третю – сірчаної кислоти H2SO4 . У кожну з пробірок додати по 3 мл хлориду барію BaCl 2. Звернути увагу на те, що відбувається.
3 Налити в одну пробірку 2 мл розчину сульфату хрому Cr2(SO4)3, в другу − стільки ж розчину хромату калію K2CrO4 і додати до в кожної з них по кілька крапель розчину гідроксиду калію KOH . Звернути увагу на те, що відбувається в кожній із пробірок.
4 Налити в пробірку 2 мл розчину карбонату натрію Na2CO3 і додати стільки ж розчину соляної кислоти HCl . Звернути увагу на те, що відбувається.
7.4 Оформлення результатів роботи
Дослід 1 Скласти рівняння дисоціації оцтової кислоти й гідроксиду амонію, вираз швидкостей прямої і зворотної реакцій, а також констант дисоціації для вказаних рівноважних систем. Записати рівняння дисоціації ацетату натрію і хлориду амонію.
Зробити висновок щодо причини зміни забарвлення розчинів.
Зробити загальний висновок про вплив додання однойменного іона на дисоціацію слабкого електроліту.
Дослід 2 Скласти рівняння реакцій в молекулярному та іонному виглядах.
На якій основі можна зробити висновок про те, що в розчинах електролітів реакції відбуваються між іонами, а не між молекулами? Пояснити, в яких випадках відбуваються реакції в розчинах електролітів.
Питання для самоперевірки
1 Що таке електроліти та неелектроліти?
2 Який процес називається електролітичною дисоціацією?
3 Що таке ступінь та константа дисоціації? Від яких факторів вони залежать?
4 За якою ознакою електроліти поділяють на слабкі та сильні?
5 В яких випадках можуть відбуватися реакції в розчинах електролітів?
6 Написати рівняння ступінчатої дисоціації сірководневої кислоти і вирази констант дисоціації.
Лабораторна робота № 8
ГІДРОЛІЗ СОЛЕЙ
8.1 Мета роботи ― вивчення реакції середовища в розчинах різних солей а також факторів, які впливають на перебіг гідролізу.
8.2 Методичні вказівки
Гідроліз є реакцією обмінної взаємодії іонів розчиненої солі з водою, в результаті якої утворюються малодисоційовані сполуки (молекули слабких кислот або основ, аніони кислих або катіони основних солей) і змінюється pHсередовища.
Щоб зрозуміти суть гідролізу, треба знати, що всі солі є сильними електролітами. Іони основних і кислотних залишків, на які дисоціюють солі, можуть сполучати H або OH іони води. Внаслідок сполучення одного з іонів води відбувається зміщення рівноваги процесу дисоціації води вправо і нагромадження в розчині одного з іонів H або OH, в результаті чого змінюється рН середовища. З іонами води можуть сполучатись тільки ті іони солі, які утворюють слабку кислоту або слабку основу. Тому гідролізу підлягають солі, до складу яких входять катіон слабкої основи (AlCl 3, ZnSO4) або аніон слабкої кислоти (CH3COONa, Na2S), або і катіон і аніон слабких електролітів одночасно (Al2S3, (NH4)2S).
Солі, утворені сильною основою і сильною кислотою, не гідролізують, оскільки їхні іони не можуть утворити слабких електролітів з водою.
Залежно від типу солі процес гідролізу може відбуватися по-різному. Розрізняють гідроліз солей: 1) за катіоном (катіон від слабкої основи); 2) за аніоном (аніон від слабкої кислоти); 3) за катіоном і аніоном (і катіон і аніон від слабких електролітів). Схеми гідролізу за катіоном і аніоном мають вигляд:
Me H2O MeOH H;
A H2O HA OH.,
де A і Me − відповідно умовні аніон слабкої кислоти HA і катіон слабкої основи MeOH .
Солі, утворені багатозарядним катіоном або багатозарядним аніоном, гідролізують ступінчасто. Взаємодія багатозарядних іонів (Fe3, Cu2, CO32,
PO34 та ін.) з водою звичайно відбувається до утворення основного або кислого іонів (перший ступінь гідролізу), наприклад:
Fe3 H2O FeOH2 H;
CO32 H2O HCO3 OH.
Гідроліз за катіоном призводить до сполучення гідроксид–іонів води й нагромадження іонів водню (середовище кисле, рН<7).
Гідроліз за аніоном призводить до сполучення іонів водню від води і нагромадження іонів OH (середовище лужне, pH >7).
Необхідно пам’ятати, що процес гідролізу є оборотним, тому в більшості випадків до кінця не проходить.
Найбільш сильному гідролізу піддаються солі, утворені слабкою основою і слабкою кислотою. Реакція гідролізу може відбуватися практично до кінця і бути необоротною, якщо продукти гідролізу виводяться зі сфери реакції, наприклад:
Al2S3 6H2O 2Al(OH) 3 3H2S.
У наведеному рівнянні продуктами гідролізу є слабка основа і слабка кислота, які до того ж видаляються з розчину, зміщуючи тим самим рівновагу гідролізу праворуч.
8.3 Порядок виконання роботи
Дослід 1 Визначення характеру середовища
У п’ять пробірок налити нейтральний розчин лакмусу на чверть об’єму пробірки. Одну пробірку залишити для порівняння, а в інші чотири додати на кінчику шпателя кристали солей: у першу – карбонату натрію Na2CO3, у другу – хлориду алюмінію AlCl 3, у третю – хлориду калію KCl , у четверту – ацетату амонію CH3COONH4. Розмішувати розчин у кожній пробірці треба окремою паличкою. Порівняти колір розчинів у пробірках з кольором розчину в контрольній пробірці.
Дослід 2 Вплив температури на ступінь гідролізу солі
У пробірку налити на чверть її об’єму дистильованої води, додати на кінчику шпателя ацетат натрію CH3COONa , розмішати, далі додати 1-2 краплі фенолфталеїну. Пробірку обережно нагріти до кипіння, а потім охолодити. Звернути увагу на зміну кольору під час нагрівання і при охолодженні.
Дослід 3 Повний (необоротний) гідроліз солей
До 1-3 мл розчину сульфату алюмінію Al2(SO4)3 додати такий самий об’єм розчину соди Na2CO3. Звернути увагу на те, що відбувається.
8.4 Оформлення результатів роботи
Дослід 1 За зміною кольору лакмусу зробити висновок про реакцію середовища в розчині кожної солі. Одержані результати оформити у вигляді таблиці:
|
Номер пробірки |
Формула солі |
Колір лакмусу |
Реакція середовища: кисла, лужна, нейтральна |
Порядок pHрозчину: pH7,pH 7,pH7 |
Написати молекулярні та іонні рівняння реакцій гідролізу.
Дослід 2 Написати молекулярне та іонне рівняння гідролізу ацетату натрію. Зробити висновок про зміну концентрації іонів OH у розчині на підставі зміни кольору фенолфталеїну. Зробити висновок щодо впливу температури на ступінь гідролізу солі.
Дослід 3 Написати рівняння реакцій між сульфатом алюмінію i содою та гідролізу карбонату алюмінію. Пояснити причину появи гідроксиду алюмінію. Питання для самоперевірки
1 Чим визначається реакція середовища? Якою величиною можна кількісно охарактеризувати реакцію середовища?
2 Що таке іонний добуток води? Чому він дорівнює?
3 Що таке гідроліз солей?
4 Від яких факторів залежить гідроліз солей?
5 Які з солей K2S, Pb(NO3)2, NaCl піддаються гідролізу? Скласти молекулярні та іонні рівняння реакцій гідролізу відповідних солей. Яке значення pH мають розчини цих солей?
Лабораторна робота № 9
ДИСПЕРСНІ СИСТЕМИ. КОЛОЇДНІ РОЗЧИНИ
9.1 Мета роботи ― одержання дисперсних систем (емульсія, суспензія, золь) і вивчення їхніх властивостей.
9.2 Загальні вказівки
Під час виконання роботи треба знати, що до дисперсних систем належать гетерогенні системи з дуже розвиненою поверхнею поділу фаз. Залежно від розміру часточок дисперсної фази дисперсні системи поділяються на грубодисперсні (розмір часточок складає 10-5 – 10-7 м), до яких належать суспензії й емульсії та тонкодисперсні – колоїдні розчини або золі (розмір часточок складає 10-7 – 10-9 м). Якщо розмір часточок дисперсної фази є меншим за 10-9 м, то утворюються істинні розчини.
Під час дослідження властивостей дисперсних систем необхідно враховувати, що колоїдні системи відрізняються від суспензій і емульсій здатністю до агрегативної та кінетичної стійкостей. Причиною агрегативної стійкості колоїдних розчинів є однойменний заряд гранул колоїдних частинок, кінетична стійкість зумовлюється наявністю броунівського руху.
Розглянемо будову колоїдної частинки на прикладі золю йодиду срібла, який утворюється під час змішування розведених розчинів нітрату срібла і йодиду калію:
AgNO3 KJ AgJ KNO3
Залежно від того, який з реагентів узятий в надлишку (AgNO3чи KJ ), колоїдна частинка золю буде мати різну будову. Одержані в результаті реакції молекули нерозчинної речовини AgJ злипаються, утворюючи мікрокристалик – агрегат. Оскільки розмір молекул дуже малий, то для утворення агрегату повинна об’єднатися велика кількість молекул AgJ . Позначимо агрегат через [mAg]. На поверхні агрегату відбуваються адсорбційні процеси, причому переважно адсорбуються іони, які знаходяться в надлишку і входять до складу агрегату. Їх називають потенціалвизначальними іонами. Якщо в надлишку AgNO3, то на поверхні мікрокристалика переважно будуть адсорбуватися n іонів Ag .
Агрегат разом з адсорбованими іонамиAg називають ядром. До ядра притягуються іони з протилежним знаком, які знаходяться в надлишку (NO3). Вони називаються протиіонами і їхня кількість завжди менша за кількість початково адсорбованих іонів (Ag ).
Агрегат разом з адсорбційним шаром утворює гранулу. Оскільки кількість початково адсорбованих іонів завжди є більшою за кількість протиіонів, то гранула має заряд, що дорівнює алгебраїчній сумі зарядів усіх іонів, що входять до адсорбційного шару. Біля поверхні гранули концентрується х протиіонів NO3, утворюючи так званий дифузний шар. Гранулу разом з дифузним шаром називають міцелою. Міцела є електронейтральною частинкою (рис. 9.1).
дифузний
агрегат адсорбційний шар шар

Рисунок 9.1– Будова міцели золю AgJ (у надлишку AgNO3)
Якщо в розглянутій реакції в надлишку взяти KI , то міцела буде мати іншу будову, (рис. 9.1а).
дифузний
агрегат адсорбційний шар шар
![]()
mAgJ nJ n x K xK
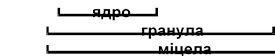
Рисунок 9.1, а – Будова міцели золю AgJ (у надлишку KJ )
Необхідно звернути увагу на те, що під час утворення багатьох золів до адсорбційного шару входять багатозарядні іони. Під час складання формул міцел таких золів необхідно враховувати багатозарядність іонів.
Треба знати, що порушення агрегативної стійкості призводить до укрупнення колоїдних частинок – коагуляції. Коагуляція викликає порушення кінетичної стійкості системи, що призводить до утворення осаду (коагуляту). Під час дослідження коагуляції золів електролітами необхідно звернути увагу на те, що коагуляцію викликають іони, які мають заряд, протилежний за знаком заряду гранули, причому чим більший заряд іона, тим вищою є його коагуляційна здатність.
9.3 Порядок виконання роботи
Дослід 1 Приготування суспензії крейди у воді
У дві пробірки налити дистильованої води до половини об’єму. В одну з них додати 1 мл 0,5% розчину желатину. Потім в обидві пробірки внести по одному мікрошпателю розтертої в порошок крейди й інтенсивно перемішати. Відзначити відносну швидкість розшарування суспензії в обох пробірках.
Дослід 2 Приготування емульсії олії в воді
У дві пробірки налити по 5 мл води і по 5 мл олії. В одну з пробірок додати 5 крапель 2% розчину мила. Закрити пробірки пробками й енергійно перемішати. Відзначити, в якій пробірці розшарування емульсії відбувається швидше.
Дослід 3 Одержання золю гідроксиду заліза (Ш) реакцією повного гідролізу хлориду заліза (Ш)
Нагріти до кипіння 20-30 мл дистильованої води, до неї краплями додати 2% розчину хлориду заліза (Ш) FeCl3 до утворення золю кольору настою міцного чаю. Одержаний розчин зберегти для наступного досліду.
Дослід 4 Коагуляція золю гідроксиду заліза (Ш), одержаного в попередньому досліді.
У три пробірки налити по 2 мл золю гідроксиду заліза (Ш). В першу пробірку додати декілька крапель розчину фосфату натрію, в другу – декілька крапель розчину хлориду натрію, третю залишити для порівняння. Відзначити зміни, які відбуваються.
9.4 Оформлення результатів роботи
Досліди 1 і 2 Зробити висновок про стійкість суспензій та емульсій. Що в цих системах є дисперсною фазою, а що – дисперсійним середовищем? До якого виду дисперсних систем вони належать? Як впливають мило і желатин на стійкість даних дисперсних систем? Як називаються такі речовини?
Дослід 3 Написати рівняння реакції повного гідролізу хлориду заліза, що відбувається під час нагрівання, до утворення гідроксиду заліза. Скласти схему будови міцели золю гідроксиду заліза, враховуючи, що потенціал- визначальними іонами є іони заліза.
Дослід 4 Зробити висновок щодо іонів, які викликають коагуляцію. Як впливає заряд коагулюючого іона на швидкість коагуляції?
Питання для самоперевірки
1 Які системи називаються дисперсними? З чого вони складаються?
2 Яка існує різниця між поняттями „істинний розчин” і „колоїдний розчин”?
3 У чому проявляється кінетична та агрегативна стійкість золів? Чим вона пояснюється?
4 Якими способами можна викликати коагуляцію колоїдного розчину?
Лабораторна робота № 10
ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
10.1 Мета роботи – вивчення окисно-відновних властивостей різних речовин. Освоєння методики складання рівнянь окисно-відновних реакцій.
10.2 Загальні вказівки
До окисно-відновних реакцій належать реакції, які відбуваються зі зміною ступенів окиснення одного або кількох елементів, що входять до складу реагуючих речовин. Зміна ступеня окиснення зумовлена переходом або зміщенням електронів до більш електронегативного атома.
Окиснення – це процес віддачі електронів, а відновлення – процес приєднання електронів. Частинки, які віддають електрони, є відновниками. У процесі реакції вони окиснюються (їхній ступінь окиснення підвищується). Частинки, які приєднують електрони, є окисниками, під час реакції вони відновлюються (ступінь окиснення знижується). Елементи, які знаходяться в найвищому ступені окиснення можуть тільки відновлюватися, тому що їхні атоми спроможні лише приймати електрони: азот у ступені окиснення (+5) (HNO3 і нітрати), сірка (+6) (H2SO4), манган (+7) (KMnO4), хром (+6) (K2CrO4, K2Cr2O7) та ін.
Елементи, які знаходяться в найнижчому ступені окиснення, можуть тільки окиснюватися, оскільки їхні атоми здатні лише віддавати електрони: сірка в ступені окиснення (-2) (Н2S і сульфіди), йод (-1) (HJ і йодиди) та ін.
Речовини, які містять елементи в проміжних ступенях окиснення, мають окисно-відновну двоїстість. Вони здатні і приймати і віддавати електрони, залежно від того, з якою сполукою вони взаємодіють (KNO2, Na2SO3 та ін.).
При складанні рівнянь окисно-відновних реакцій користуються двома методами підбору коефіцієнтів: методом електронного балансу і методом електронно-іонного балансу.
Метод електронного балансу дає змогу складати рівняння окисновідновних реакцій, які відбуваються у водних розчинах, в газовій та твердій фазах.
Метод електронно-іонного балансу використовують при складанні рівнянь реакцій, які відбуваються в розчинах електролітів. У цьому випадку при визначенні коефіцієнтів у рівнянні окисно-відновної реакції виходять не із ступенів окиснення, а з реальних зарядів тих іонів, що існують у розчині.
Загальний хід складання рівнянь за обома методами є однаковим. Вони відрізняються лише за п. 4 наведеної далі послідовності операцій.
1 Записати формули речовин, що вступають у реакцію.
2 Визначити, яка з речовин даної реакції виявляє окисні, а яка – відновні властивості. Для цього за формулами речовин знайти ступені окиснення всіх елементів і згідно з їх положенням у періодичній системі визначити, які з них мають вищі ступені окиснення, а які – нижчі.
3 Записати формули речовин, на які перетворюються окисники внаслідок відновлення, а відновники − внаслідок окиснення.
4 Скласти електронні (метод електронного балансу) або електронноіонні схеми (метод електронно-іонного балансу) процесів окиснення та відновлення. Підібрати коефіцієнти для цих схем так, щоб загальне число електронів, які віддає відновник, дорівнювало загальному числу електронів, які приєднує окисник.
5 Розставити коефіцієнти в молекулярному рівнянні реакції так, щоб загальна кількість атомів кожного елемента була однаковою в лівій і правій частинах рівняння.
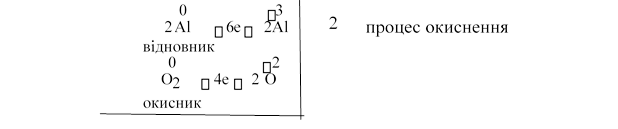
Приклад 1. Визначимо коефіцієнти за методом електронного балансу в рі-
0 0 3 2
внянні реакції AlO2 Al2 O3
 3 процес відновлення
3 процес відновлення
0 0 3 2
4Al12e3O212e 4Al6O
0 0
4Al3O2 2Al2O3
У випадку використання електронно-іонного балансу треба мати на увазі наступне: якщо в напівреакції є незбалансований кисень, то надлишок кисню в лівій частині напівреакції в кислому середовищі зв’язується іонами водню з утворенням молекул води, а в нейтральному та лужному – молекулами води з утворенням гідроксид-іонів OH.
MnO4 8H 5e Mn2 4H2O (кисле середовище);
MnO4 2H2O3e MnO2 4OH (нейтральне середовище).
Нестача кисню в лівій частині напівреакції поповнюється в кислому та нейтральному середовищах киснем з молекул води, при цьому утворюються іони водню, а в лужному середовищі – за рахунок гідроксид-іонів з утворенням молекул води. Наприклад:
SO32 H2O2e SO24 2H (нейтральне середовище);
SO32 2OH- 2e SO24 H2O (лужне середовище).
Приклад 2 . Визначимо коефіцієнти за методом електронно-іонного балансу в рівнянні реакції:
2 6 3 3
FeSO4 K2 Cr2 O7 H2SO4 Fe2(SO4)3 Cr2(SO4)3 K2SO4 H2O
Fe2 SO24 2K Cr2O72 2H SO42
2Fe3 3SO24 2Cr3 3SO24 2K SO42 H2O
2 3
|
2Fe 2e 2Fe відновник |
3 процес окиснення; |
|
Cr2O72 14H 6e 2Cr3 7H2O окисник
|
1 процес відновлення; |
6Fe2 6eCr2O72 14H 6e 6Fe3 2Cr3 7H2O
6FeSO4 K2Cr2O7 7H2SO4 3Fe2(SO4)3 Cr2(SO4)3 K2SO4 7H2O
На характер перебігу окисно-відновних реакцій значно впливає середовище. Для створення кислого середовища звичайно використовують розведену H2SO4, а лужне середовище створюють, додаючи в розчин KOH або NaOH.
10.3 Порядок виконання роботи
Дослід 1 Окисно-відновні властивості нітриту натрію NaNO2
Узяти дві пробірки. У першу пробірку налити 3 мл розчину йодиду калію KJ , додати декілька крапель розведеного розчину H2SO4 і розчин NaNO2 до змінення кольору. В другу пробірку налити 3 мл розчину KMnO 4, підкислити його розведеним розчином H2SO4 і додати розчин NaNO2 до утворення безбарвного розчину. Відзначити зміни, які відбуваються.
Дослід 2 Вплив pH середовища на окисно-відновні реакції
У три пробірки налити по 3 мл розчину перманганату калію. У першу з них додати 2 мл H2SO4, в другу – 2 мл H2O, в третю – 2 мл KOH. У кожну пробірку додати по 3 мл розчину сульфіту натрію Na2SO3.
10.4 Оформлення результатів роботи
Дослід 1 Скласти рівняння окисно-відновних реакцій, використовуючи метод електронно-іонного балансу. Зробити висновок про те, в якому випадку нітрит-іони мають відновні, а в якому – окисні властивості.
Дослід 2 Написати рівняння реакцій між KMnO4 і Na2SO3 в кислому, нейтральному та лужному середовищах, враховуючи, що фіолетовий колір є характерним для іонів MnO4 , слабо-рожевий, майже безбарвний - для іонів
Mn2, зелений – для іонів MnO24, бурий колір має осад MnO2. Зробити висновок щодо впливу pH середовища на глибину перебігу окисно-відновних процесів.
Питання для самоперевірки
1 Які реакції називаються окисно-відновними?
2 Що таке ступінь окиснення?
3 Що таке окисник і відновник?
4 Які сполуки мають окисно-відновну двоїстість?
5 Для яких реакцій використовують методи електронного та електронноіонного балансів?
Лабораторна робота № 11
ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ
11.1 Мета роботи ― ознайомлення з роботою гальванічного елемента (ГЕ) і вивчення впливу природи електродів на величину ЕРС гальванічного елемента.
11.2 Загальні вказівки
Гальванічний елемент – це прилад, що служить для перетворення хімічної енергії окисно-відновної реакції на електричну, причому електрони переходять від відновника до окисника не безпосередньо, а через зовнішній провідник.
В основі роботи ГЕ лежать явища, що відбуваються на межі поділу метал – розчин електроліту, а саме: утворення подвійного електричного шару,
що приводить до виникнення стрибка потенціалу (електродного потенціалу) Men/Me.
Величину електродного потенціалу визначають за рівнянням Нернста, яке для t = 25 0С має вигляд
Me0 n/.Me ![]() 0,059n lgCMen ,
0,059n lgCMen ,
де Me0 n/Me − стандартний електродний потенціал, В; n − число електронів, що беруть участь у процесі; [С n ]− рівноважна концентрація іонів металу в розчині.
Ме
Величину стандартного електродного потенціалу φ0 можна знайти в довідкових таблицях (“ряд стандартних електродних потенціалів”). Положення металу в ряду характеризує його відновну здатність, а також окисні властивості іонів металу у водних розчинах. Чим менше значення φ0, тим активнішим є метал, тим сильніші відновні властивості виявляє він у вигляді простої речовини. Так, метал, який стоїть в ряду попереду, здатний витиснути із сполук метали, які стоять після нього.
При складанні ГЕ треба знати, що більш активний метал завжди є анодом, а менш активний – катодом. При цьому необхідно пам’ятати, що на аноді відбуваються процеси окиснення (віддачі електронів), а на катоді – процеси відновлення (приєднання електронів). Роботу ГЕ розглянемо на прикладі мідно-цинкового ГЕ (див. рис. 11.1).
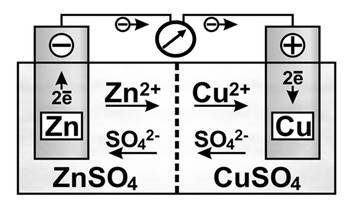
Рисунок 11.1 – Схема гальванічного елемента Даніеля-Якобі
На межі поділу фаз виникають різниці потенціалів і встановлюються рівноваги:
![]()
![]() Zn0 Zn2 2e; Cu0 Cu2 2e
Zn0 Zn2 2e; Cu0 Cu2 2e
Потенціал цинкового електрода має більш негативне значення, ніж потенціал мідного електрода, тому під час з’єднання цинкової пластини з мідною металевим дротом електрони будуть переміщуватись від цинку до міді. У результаті цього рівновага на цинковому електроді зміститься праворуч, а отже в розчин перейде додаткова кількість іонів цинку. У той самій час рівновага на мідному електроді зміститься ліворуч і на ньому відбудеться осідання іонів міді з розчину у вигляді атомів.
Таким чином, цинковий електрод є анодом, оскільки на ньому відбувається процес окиснення цинку, а мідний електрод − катодом, бо на ньому відбувається процес відновлення іонів міді:
![]()
![]() Zn0 2e Zn2; Cu2 2e Cu0
Zn0 2e Zn2; Cu2 2e Cu0
На внутрішній ділянці ланцюга аніони SO24 переміщуються від мідного електрода до цинкового, а катіони Zn2 і Cu2 − у зворотному напрямку. Внаслідок такого переміщення зарядів розчини біля обох електродів залишаються електронейтральними.
Сумарний процес виражається рівнянням
Zn0 Cu2 Zn2 Cu0
або в молекулярній формі:
Zn CuSO4 ZnSO4 Cu .
Електрохімічні системи ГЕ зображуються у вигляді схем, наприклад: Zn | Zn2 || Cu2 | Cu
Ознайомившись з роботою гальванічного елемента, необхідно розрахувати його електрорушійну силу (ЕРС) за формулою
ЕРС = k a,
де k і a - потенціали відповідно катода і анода, В.
11.4 Порядок виконання роботи
Зібрати мідно-цинковий, залізо-цинковий і залізо-мідний ГЕ. Для цього потрібно в окремі склянки налити 0,01М розчини СuSO4, ZnSO4, FeSO4, занурити в них електроди з відповідного металу і з’єднати попарно розчини U- подібною трубкою, наповненою насиченим розчином KCl у суміші з агар-агаром (електролітичний місток). З’єднати електроди зібраного ГЕ з вольтметром. Замкнути ланцюг і відзначити напрямок струму (див. рис. 13.1). Зняти показання за шкалою вольтметра.
11.5 Оформлення результатів роботи
1 Скласти схеми ГЕ. Вказати напрямок переміщення електронів по зовнішніх ланцюгах. Записати рівняння електродних процесів, скласти загальні рівняння реакцій, що відображають роботу кожного ГЕ.
2 Розрахувати теоретичні величини ЕРС кожного з досліджених елементів, використовуючи рівняння Нернста.
3 Порівняти теоретичні значення ЕРС з експериментальними.
4 Зробити висновок щодо впливу природи електродів на величину ЕРС гальванічного елемента.
Питання для самоперевірки
1 Обчислити потенціал цинкового електрода, зануреного в 0,01 М розчин сульфату цинку; потенціал водневого електрода, зануреного в чисту воду за температури 25 0С і тиску 1 атм.
2 Скласти схеми роботи двох ГЕ, в одному з яких мідь була б анодом, а в іншому – катодом. Написати рівняння реакцій, що відбуваються під час роботи цих елементів, і розрахувати ЕРС елементів за стандартних умов.
3 Користуючись таблицею стандартних електродних потенціалів, визначити, який з наведених нижче атомів та іонів може:
а) окиснюватися за допомогою H:
Al, Zn, Ca, Ag, Fe,Hg ;
б) відновлюватися за допомогою Zn :
Na, Mg2,Cu2, Zn2. Скласти можливі молекулярні та іонні рівняння реакцій.
Лабораторна робота № 12
КОРОЗІЯ МЕТАЛІВ
12.1 Мета роботи ― ознайомлення з корозією металів і засобами захисту від неї.
12.2 Загальні вказівки
Корозія металів є гетерогенним процесом, в якому хімічні та електрохімічні процеси відбуваються на межі поділу двох фаз – метал і зовнішнє середовище, причому метал переходить в іонний (окиснений) стан.
Особливу увагу необхідно звернути на електрохімічну корозію, яка відбувається в середовищі електроліту і супроводжується виникненням у системі електричного струму.
У процесі електрохімічної корозії руйнування металу відбувається внаслідок роботи багатьох мікрогальванічних елементів – гальванопар, які утворюються внаслідок різниці потенціалів на різних ділянках поверхні металу. Причиною різниці потенціалів можуть бути контакт двох різних металів, наявність домішок у металі, структурна неоднорідність металу тощо. При цьому треба пам’ятати, що анодними є ділянки металу, які мають менше значення електродного потенціалу. На анодних ділянках метал окиснюється, іони металу переходять у розчин і гідратуються, звільняючи зайві електрони, які, залишившись на металі, рухаються до катодної ділянки. На катодних ділянках поверхні металу зайві електрони поглинаються окисником.
Під час корозії залежно від реакції середовища окисниками можуть бути іони водню електроліту або розчинений в електроліті кисень повітря, хлор Cl2 іони Fe3+, NO3 та ін. Для прикладу розглянемо корозію заліза з домішками міді в кислому середовищі (рис. 12.1):
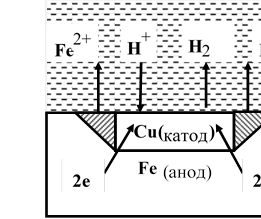
Рисунок 12.1– Схема електрохімічної корозії заліза в кислому середовищі
− на аноді: Fe − 2e → Fe2+ − на катоді: 2Н+ + 2е → Н2
Отже, в кислому середовищі (рН<7) залізо руйнується в місці контакту, а на міді виділяється водень.
У нейтральному і лужному середовищах (pH 7) процес корозії виражається рівняннями:
− на аноді: Fe2e Fe2
− на катоді: O2 2H2O4e 4OH
− у розчині: Fe2 2OH Fe(OH)2
Під впливом кисню повітря Fe(OH)2 окиснюється далі за рівнянням:
4Fe(OH)2 O2 2H2O4Fe(OH)3
12.3 Порядок виконання роботи
Дослід 1 Вплив контакту металів на розчинення їх у кислотах
1 У пробірку налити 5-6 мл 10% розчину сірчаної кислоти, помістити туди шматочок гранульованого цинку (чистого). Відмітити, як швидко відбувається взаємодія цинку з кислотою (за швидкістю виділення бульбашок водню). Занурити в розчин мідну дротинку, доторкнутися нею до цинку. Спостерігати за зміною швидкості виділення водню. На якому з металів у даному випадку виділяється водень?
Дослід 2 Електрохімічна корозія оцинкованого і лудженого заліза 1 Попередні випробування на іон Fe2+.
У результаті електрохімічної корозії заліза в розчин потрапляють іони Fe2+, які можна виявити за допомогою гексаціаноферату(III)калію K3[Fe(CN)6], що утворює з ними комплексну сполуку Fe3[Fe(CN)6]2 інтенсивно синього кольору під назвою “турнбулева синь”. Поява такого кольору свідчить про наявність іонів заліза Fe2+ у розчині, а отже, про корозію заліза.
Налити в пробірку декілька мілілітрів розведеного розчину FeSO4 і додати декілька крапель розчину гексаціаноферату(III)калію Fe3[Fe(CN)6]. Спростерігати за зміною забарвлення розчину в синій колір.
2 У дві пробірки налити по 2-3 мл розбавленої сірчаної кислоти й додати по 2-3 краплі гексаціаноферату(III)калію. Узяти дві залізні канцелярські скріпки, в одну з них затиснути шматочок цинку, в іншу – олова і занурити в приготовлені пробірки. Через 5 хвилин відзначити зміну кольору розчину.
Дослід 3 Гальмування корозії за допомогою інгібіторів
У дві пробірки налити по 2-3 мл 1 н розчину соляної кислоти і помістити по шматочку цинку. Після того, як виділення водню стане досить інтенсивним (якщо реакція проходить повільно, підігріти пробірки) в одну з них додати уротропін на кінчику шпателя. Як змінилась інтенсивність виділення водню?
12.4 Оформлення результатів роботи
Дослід 1 Скласти рівняння реакції взаємодії цинку з розчином сірчаної кислоти в молекулярній та іонній формах. Указати катод і анод та скласти рівняння реакцій катодного й анодного процесів під час контакту цинку з міддю. Зробити висновок щодо впливу на швидкість корозії цинку його контакту з менш активним металом.
Дослід 2 Зобразити схему електрохімічної корозії лудженого й оцинкованого заліза. Зробити висновок про те, де швидше проходить корозія заліза. Чому? В якому випадку під час руйнування захисного покриття (цинку або олова) корозія заліза буде проходити швидше?
Дослід 3 Зробити висновок щодо впливу уротропіну на швидкість корозії цинку.
Питання для самоперевірки
1 Що таке корозія металів?
2 Які існують основні типи корозії?
3 Як на швидкість корозії цинку впливає його контакт з міддю?
4 У чому полягає механізм електрохімічної корозії?
5 Що буде відбуватися при пошкодженні захисного покриття олова на залізному виробі, якщо виріб знаходиться у воді? Скласти рівняння катодного та анодного процесів.
6 Під час контакту з яким із двох металів: міддю чи свинцем, залізо буде руйнуватися швидше? Чому?
Лабораторна робота № 13
ВИЗНАЧЕННЯ КАРБОНАТНОЇ ЖОРСТКОСТІ ВОДИ
13.1 Мета роботи – освоєння методики визначення карбонатної жорсткості води.
13.2 Загальні вказівки
Однією з найважливіших характеристик природних вод є їхня жорсткість, яка обумовлена вмістом у них іонів Ca2+ і Mg2+.
Розрізняється жорсткість загальна, гідрокарбонатна (гідрогенкарбонатна) або тимчасова, карбонатна, зумовлена переважно гідрокарбонатами кальцію і магнію, і некарбонатна, обумовлена хлоридами й сульфатами кальцію і магнію, яку часто називають постійною жорсткістю.
Вимірюється жорсткість води кількістю мілімоль еквівалентів (ммоль екв) катіонів Са2+ і Mg2+ або відповідних солей в 1 л води.
Під час розрахунків, пов’язаних із жорсткістю води, необхідно враховувати, що
Са2 Mg2
ЕСа2 ![]() 2 і ЕMg2
2 і ЕMg2 ![]() 2 ;
2 ;
M 2 M
![]() ME(Ca2) Са2 20 г/моль; ME(Mg2 )
ME(Ca2) Са2 20 г/моль; ME(Mg2 ) ![]() Mg2 2 12 г/моль.
Mg2 2 12 г/моль.
Вода, в якій містяться солі некарбонатної жорсткості, може бути пом’якшена термічною обробкою:
t0
Ca(HCO3)2 CaCO3 CO2 H2O
або вапнуванням ( додаванням гашеного вапна):
Ca(HCO3)2 CaОН2 ↓ 2СаCO3 ↓2H2O
Вода, в якій містяться солі некарбонатної жорсткості, може бути пом’якшена реагентними методами (наприклад, додаванням соди Na2CO3) або методами іонного обміну:
СaSO 4 Na2CO3 Na2SO4 CaCO3 ↓
Під час визначення карбонатної жорсткості води необхідно враховувати, що аніон HCO3 у воді гідролізує, в результаті чого вода набуває лужного середовища:
HCO3 H2O H2CO3 OH
що в молекулярному вигляді можна записати так:
Ca(HCO3)2 2H2OCa(OH)2 2H2O 2CO2 (17.1)
Саме тому карбонатну жорсткість визначають методом титрування проби води соляною кислотою в присутності індикатора метилоранжу до зміни жовтого кольору індикатора (характерного для лужного середовища) на рожевий.
Під час титрування такої води розчином соляної кислоти відбувається реакція нейтралізації:
OH H H2O
або
Ca(OH)2 2HCl CaCl2 2H2O (17.2)
Склавши рівняння 17.1 і 17.2, одержимо рівняння реакції, яка відбувається під час визначення карбонатної жорсткості води за допомогою розчину соляної кислоти:
Сa(HCO3)2 2HCl CaCl2 2H2O 2CO2
13.3 Порядок виконання роботи
У конічну колбу за допомогою циліндра відміряти 100 мл води, що досліджується, додати 1–2 краплі метилоранжу. Приготовану пробу відтитрувати 0,1н розчином соляної кислоти до зміни жовтого кольору індикатора на рожевий. Визначити об’єм кислоти, витраченої на титрування. Титрування повторити три рази (результати титрування не повинні розбігатися більш як на 0,1 мл). Знайти середнє значення об’єму розчину кислоти, витраченої на титрування води.
13.4 Оформлення результатів роботи
Результати титрування записати в таблицю:
|
Номер проби |
Об’єм води, мл |
Об’єм мл |
кислоти, |
Нормальність кисло- ти, моль екв∙л–1 |
Розрахувати жорсткість води ( ![]() ммоль екв ) за формулою л
ммоль екв ) за формулою л
VHCl Cн HCl
Жв ![]() 1000,
1000,
Vв
де VHCl − середній об’єм розчину соляної кислоти, витрачений на титрування, мл;
CН HCl − нормальність розчину соляної кислоти, моль екв/л; Vв − об’єм проби води, взятої для титрування, мл.
Питання для самоперевірки
1 Наявність яких сполук обумовлює жорсткість води?
2 Які солі обумовлюють карбонатну, а які − некарбонатну жорсткість води?
3 У яких одиницях вимірюється жорсткість води?
4 У чому полягає метод визначення карбонатної жорсткості води?
5 Чому вода, що містить солі карбонатної жорсткості, має лужне середовище? 6 Якими способами можна усунути жорсткість води?
Лабораторна робота № 14
ВИЗНАЧЕННЯ АГРЕСИВНОГО ДІОКСИДУ ВУГЛЕЦЮ
14.1 Мета роботи − визначення кількості вільного і зв’язаного діоксиду вуглецю в пробах води та розрахування (на основі одержаних результатів) кількості агресивного діоксиду вуглецю у воді.
14.2 Загальні вказівки
Діоксид вуглецю, звичайно, присутній в усіх природних водах у двох формах: вільний діоксид вуглецю (СО2 і Н2СО3) і зв’язаний діоксид вуглецю (HCO3 і CO32).
Саме наявність діоксиду вуглецю у воді в основному зумовлює корозійні властивості води відносно вапняних і бетонних споруд. Між різними формами вугільної кислоти у водних розчинах існує динамічна карбонатна рівновага:
CO2 H2O H2CO3 H HCO3 2H CO32
Оскільки дисоціація вугільної кислоти за другим ступенем є незначною, то основна карбонатна рівновага природних вод є системою з вільної кислоти і гідрокарбонат-іонів:
СO2 H2O H2CO3 H HCO3.
Необхідно звернути увагу на той факт, що практично нерозчинний у воді карбонат кальцію CaCO3 може взаємодіяти з розчиненим у воді діоксидом вуглецю CO2, перетворюючись на добре розчинний гідрокарбонат кальцію Ca(HCO3)2, і тим самим спричиняти вуглекислотну корозію бетонних і вапнякових споруд:
CaCO3 CaCO3 CO2 H2O Ca(HCO3)2.
тв. речов. розчин
Константа цієї рівноваги має вигляд:
![]() [Ca(HCO3)2]
[Ca(HCO3)2]
Kрівн [CaCO3][CO2][H2O]
Враховуючи сталість концентрацій [CaCO3] і [H2O] вона перетворюєтьсяна константу карбонатної рівноваги:
![]() KCO2 [Ca(HCO[CO2]3)2]
KCO2 [Ca(HCO[CO2]3)2]
Та частина вільного діоксиду вуглецю CO2, яка входить у вираз константи карбонатної рівноваги і підтримує рівновагу між карбонатами та гідрокарбонатами, безпечна для будівельних споруд і називається рівноважним або інактивним діоксидом вуглецю. Вуглекислотну корозію будівельних споруд викликає перевага кількості вільного діоксиду вуглецю над кількістю рівноважного. Ця величина називається агресивним діоксидом вуглецю. Кількість його дорівнює різниці між вмістом вільного діоксиду вуглецю у воді та рівноважного.
14.3 Порядок виконання роботи
Дослід 1 Визначення вільного діоксиду вуглецю
Відібрати піпеткою 100 мл води і перенести в конічну колбу, додати 2-3 краплі фенолфталеїну та відтитрувати 0,1н розчином їдкого натру за постійного перемішування до появи блідо-рожевого забарвлення, яке не зникає на протязі 1 хвилини. Визначити об’єм лугу, витраченого на титрування. Титрування повторити три рази.
Дослід 2 Визначення зв’язаного діоксиду вуглецю
Відібрати піпеткою 100 мл води і перенести в конічну колбу. Додати 2-3 краплі метилоранжу і відтитрувати 0,1н розчином соляної кислоти за постійного перемішування до зміни блідо-жовтого забарвлення на блідо-рожеве. Визначити об’єм кислоти, витраченої на титрування. Титрування повторити три рази.
14.4 Оформлення результатів роботи
Дослід 1 Результати титрування записати в таблицю:
|
Номер проби |
Об’єм води, мл
|
Об’єм NaOH, мл |
Нормальність NaOH, моль екв∙л–1 |
Знайти середнє значення об’єму розчину лугу, витраченого на титрування.
Скласти рівняння реакції, що відбувається під час титрування води, яка вміщує вільний діоксид вуглецю, розчином лугу. Масу вільного діоксиду вуглецю (мг/л) розраховувати за формулою
VNaOH Cн NaOH 100044
mCO2 вільн. ![]() VB ,
VB ,
де VB − об’єм води, взятий для титрування, мл;
VNaOH − середній об’єм лугу, витраченого на титрування, мл;
Cн NaOH − нормальність розчину лугу, (моль екв/л);
44 – молярна маса еквівалента вільного діоксиду вуглецю в реакції утворення кислої солі, г/моль екв. Дослід 2 Результати, одержані під час титрування, записати в таблицю:
|
Номер проби |
Об’єм води, мл |
Об’єм HCl , мл
|
Нормальність HCl , моль екв∙л–1 |
Знайти середнє значення об’єму кислоти, витраченої на титрування. Скласти рівняння реакції, що відбувається під час титрування води, яка містить гідрокарбонат-іони, розчином соляної кислоти.
Масу зв’язаного діоксиду вуглецю (мг/л) розрахувати за формулою
VHCl Cн HCl 100044
mCO2 зв'яз. ![]() VB ,
VB ,
де VB − об’єм води, взятий для титрування, мл;
VHCl − середній об’єм кислоти, витрачений на титрування, мл;
Сн HCl − нормальність кислоти, (моль екв/л);
44 – молярна маса еквівалента зв’язаного діоксиду вуглецю в даній реакції, г/моль екв.
Кількість агресивного діоксиду вуглецю розрахувати на основі результатів визначення кількості вільного і зв’язаного діоксиду вуглецю, використовуючи таблицю Леманна і Реуса.
Розрахувати величину А за формулою
1
A mCO2 вільн. ![]() 2 mCO2 зв'яз.
2 mCO2 зв'яз.
У таблиці Леманна і Реуса (табл.3) за величиною А знайти відповідну їй величину Б і далі з формули
1
Б mCO2 агр. ![]() 2 mCO2 зв'яз.
2 mCO2 зв'яз.
знайти кількість агресивного діоксиду вуглецю (мг/л).
Питання для самоперевірки
1 Які форми діоксиду вуглецю присутні в природних водах?
2 Що таке карбонатна рівновага?
3 Який діоксид вуглецю називається рівноважним, а який − агресивним?
4 Який діоксид вуглецю спричиняє вуглекислотну корозію бетону? 5 У чому полягає метод визначення агресивного діоксиду вуглецю?
Таблиця 3 – Коефіцієнти А і Б для визначення вмісту агресивного СО2 у воді
|
А |
Б |
А |
Б |
А |
Б |
А |
Б |
|
1 |
1 |
56 |
52,4 |
111 |
91,6 |
166 |
121,0 |
|
2 |
2 |
57 |
53,2 |
112 |
92,2 |
167 |
121,5 |
|
3 |
3 |
58 |
54,0 |
113 |
92,8 |
168 |
122,0 |
|
4 |
4 |
59 |
54,8 |
114 |
93,4 |
169 |
122,5 |
|
5 |
5 |
60 |
55,7 |
115 |
94,0 |
170 |
123,0 |
|
6 |
6 |
61 |
56,5 |
116 |
94,6 |
171 |
123,4 |
|
7 |
7 |
62 |
57,2 |
117 |
95,1 |
172 |
123,9 |
|
8 |
8 |
63 |
58,1 |
118 |
95,8 |
173 |
124,3 |
|
9 |
9 |
64 |
58,8 |
119 |
96,3 |
174 |
124,7 |
|
10 |
10 |
65 |
59,8 |
120 |
97,0 |
175 |
125,2 |
|
11 |
11 |
66 |
60,4 |
121 |
97,6 |
176 |
125,7 |
|
12 |
12 |
67 |
61.2 |
122 |
98,1 |
177 |
126,2 |
|
13 |
13 |
68 |
62,0 |
123 |
98,6 |
178 |
126,6 |
|
14 |
13,9 |
69 |
62,8 |
124 |
99,2 |
179 |
127,0 |
|
15 |
14,9 |
70 |
63,5 |
125 |
99,8 |
180 |
127,5 |
|
16 |
15,9 |
71 |
64,3 |
126 |
100,4 |
181 |
127,9 |
|
17 |
16,9 |
72 |
65,0 |
127 |
100,9 |
182 |
128,4 |
|
18 |
17,8 |
73 |
65,8 |
128 |
101,5 |
183 |
128,8 |
|
19 |
18,8 |
74 |
66,5 |
129 |
102,1 |
184 |
129,2 |
Продовження таблиці 3
|
А |
Б |
А |
Б |
А |
Б |
А |
Б |
|
20
|
19,8
|
75
|
67,3
|
130
|
102,6
|
185
|
129,7
|
|
21 |
20,8 |
76 |
68,0 |
131 |
103,2 |
186 |
130,2 |
|
22 |
21,7 |
77 |
68,8 |
132 |
103,7 |
187 |
130,6 |
|
23 |
22,7 |
78 |
69,5 |
133 |
104,8 |
188 |
131,0 |
|
24 |
23,7 |
79 |
70,3 |
134 |
104,8 |
189 |
131,4 |
|
25 |
24,6 |
80 |
71,0 |
135 |
105,2 |
190 |
131,9 |
|
26 |
25,5 |
81 |
71,7 |
136 |
105,9 |
191 |
132,3 |
|
27 |
26,5 |
82 |
72,4 |
137 |
106,5 |
192 |
132,7 |
|
28 |
27,5 |
83 |
73,1 |
138 |
106,9 |
193 |
133,2 |
|
29 |
28,4 |
84 |
73,8 |
139 |
107,5 |
194 |
133,7 |
|
30
|
29,4
|
85
|
74,5
|
140
|
108,1
|
195
|
134,0
|
|
31 |
30,3 |
86 |
75,2 |
141 |
108,6 |
196 |
134,4 |
|
32 |
31,2 |
87 |
75,9 |
142 |
109,1 |
197 |
134,8 |
|
33 |
33,2 |
88 |
76,6 |
143 |
109,6 |
198 |
135.2 |
|
34 |
33,1 |
89 |
77,3 |
144 |
110,0 |
199 |
135,7 |
|
35 |
34,0 |
90 |
78,0 |
145 |
110,7 |
200 |
136,0 |
|
36 |
34,9 |
91 |
78,7 |
146 |
111,2 |
210 |
141,6 |
|
37 |
35,9 |
92 |
79,3 |
147 |
111,7 |
220 |
145,6 |
|
38 |
36,8 |
93 |
80,0 |
148 |
112,2 |
230 |
149,8 |
|
39 |
37,7 |
94 |
80,8 |
149 |
112,5 |
240 |
153,8 |
|
40 |
38,6 |
95 |
81,4 |
150 |
113,2 |
250 |
157,5
|
|
41 |
39,5 |
96 |
82,1 |
151 |
113,7 |
260 |
161,2 |
|
42 |
40,3 |
97 |
82,7 |
152 |
114,2 |
270 |
164,9 |
|
43 |
41,2 |
98 |
83,3 |
153 |
114,7 |
280 |
168,5 |
|
44 |
42,1 |
99 |
84,0 |
154 |
115,3 |
290 |
171,9 |
|
45 |
43,0 |
100 |
84,6 |
155 |
115,8 |
300 |
175,3 |
|
46 |
43,9 |
101 |
85,3 |
156 |
116,3 |
310 |
178,8 |
|
47 |
44,7 |
102 |
85,9 |
157 |
116,6 |
320 |
182,1 |
|
48 |
45,6 |
103 |
86,5 |
158 |
117,3 |
330 |
185,0 |
|
49 |
46,5 |
104 |
87,2 |
159 |
117,6 |
340 |
188,3 |
|
50 |
47,3 |
105 |
87,6 |
160 |
118,1 |
350 |
191,3 |
|
51 |
48,2 |
106 |
88,4 |
161 |
118,6 |
360 |
194,2 |
|
52 |
49,0 |
107 |
89,1 |
162 |
119,1 |
370 |
197,3 |
|
53 |
49,9 |
108 |
89,7 |
163 |
119,6 |
380 |
199,9 |
|
54 |
50,7 |
109 |
90,4 |
164 |
120,1 |
390 |
202,8 |
|
55 |
51,5 |
110 |
90,9 |
165 |
120,6 |
400 |
205,7 |
СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ
1. Степаненко О.М., Рейтер Л.Т., Ледовських В.М., Іванов С.В. Загальна та неорганічна хімія: В 2ч.- К.: Педагогічна преса,- 2000. –Ч.1.- 520 с.
2. Романова Н.В. Загальна та неорганічна хімія.- К.; Ірпінь: ВТФ “Перун”,- 1998.- 480 с.
3. Телегус В.С., Бодак О.І., Заречнюк О.С., Кінжибало В.В. Основи загальної хімії.- Львів: Світ,- 2000.- 424 с.
4. Коровин Н.В. Общая химия.- М.: Высш. шк.,- 1998.- 539 с.
5. Коровин Н.В., Мингулина Э.И. Рыжова Н.Г. Лабораторные работы по химии.- М.: Высш. школа , 1998.- 239 с.
6. Курс химии. Ч.2. Специальная для строит. институтов и факультетов /Под ред. Киреева В.А.- М.: Высш.шк.- 1975.- 236 с.
Навчальне видання
ДАНЧЕНКО Юлія Михайлівна
ОБІЖЕНКО Тетяна Миколаївна УМАНСЬКА Тетяна Іванівна
«ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ» Лабораторний практикум
Навчально-методичний посібник
Роботу до видання рекомендував Ю.В.Журавльов
Редактор В.І. Пуцик
План 2018р., поз. 7.0 Формат 60*84 1/16. Папір друк.№2.
Підп. до друку 21.05.18 Обл.-вид. 2,3. Безкоштовно.
Надруковано на ризографі. Умов. друк. арк. 2,5.
Тираж 100 прим. Зам. №.5249
![]()
ХНУБА, Україна, 61002, Харків, вул. Сумська 40
![]()
Підготовлено та надруковано РВВ Харківського національного університету будівництва та архітектури


про публікацію авторської розробки
Додати розробку
