Лужні метали. Властивості, застосування.
Тема. Лужні елементи. Фізичні та хімічні властивості простих речовин, основний характер їх оксидів та гідроксидів, біологічна роль елементів.
Мета: вивчити властивості лужних металів та їхніх оксидів, пояснити біологічну роль елементів, продемонструвати властивості експериментально.
Очікуваний результат:
Учень:
- розпізнає лужні метали та їхні сполуки,
- називає сполуки лужних металів,
- пояснює хімічні та фізичні властивості лужних металів,
- характеризує та доводить експериментально характер оксидів та гідроксидів,
- обґрунтовує біологічну роль лужних елементів для організму,
- робить висновки.
Тип уроку: урок засвоєння нових знань.
Форми проведення: інтерактивна вправа «Мікрофон», робота з підручником, із схемою про лужні метали та складання кіл Вена, практичний експеримент, вправи на закріплення матеріалу.
Обладнання та реактиви: літій, вода, лакмусовий папірець, фенолфталеїн, кислота, штатив з пробірками.
І. Організаційний момент.
ІІ. Мотивація навчальної діяльності.
Вчитель. Дотепер ми вивчали властивості металів у загальних рисах. Сьогодні переходимо до вивчення окремих властивостей конкретних металів. Почнемо із лужних металів, оскільки їхня роль для живих організмів є дуже велика. Запишіть тему сьогоднішнього уроку.
ІІІ. Вивчення нового матеріалу.
Вчитель.
«Мікрофон»:
- Які ви знаєте лужні метали?
- Де вони розташовані у періодичній системі?
- Чим відрізняються один від одного?
- Чим подібні один до одного?
- Намалюйте будову атомів елементів Калію та Літію.
- Чим подібні та відмінні атоми цих елементів, виходячи з їх будови?
- Чи буде, на вашу думку, будова атомів металів впливати на їх властивості?
- Які фізичні та хімічні властивості можна передбачити для лужних металів, виходячи з будови атомів та положення у періодичній системі?
Випишемо з підручника у зошит загальну характеристику лужних металів:
- Лужні метали легші за воду, м’які, легкоплавкі. Їхня твердість і температура плавлення зменшується від літію до цезію.
- Мають 1 валентний електрон s-типу.
- Ступінь окиснення у сполуках: +1.
- Хімічна активність дуже висока і збільшується від Na до Cs.
- Вища валентність в оксидах, солях, гідроксидах рівна – І.
- Лужні метали належать до І групи головної підгрупи.
Вчитель. Порівняйте фізичні властивості лужних металів із властивостями інших металів за допомогою кіл Вена (учні заповнюють самостійно за підручником):
Лужні метали Метали
М'які Проводять тепло, Тверді
Легкі струм Важкі
Легкоплавкі Мають металічний Тугоплавкі
блиск
Куються
Літій належить до лужних металів, але його властивості більш подібні на властивості Mg. Така «діагональна аналогія» притаманна іншим елементам ІІ періоду Ве→Al, B→ Si.
Лужні метали відіграють особливу роль для живих організмів. Це називається їхньою біологічною роллю. Йони натрію та калію входять до складу біологічних рідин: крові, поту, міжклітинної речовини. Плазма крові містить високу концентрацію йонів натрію та калію, іншими словами, високу концентрацію солей. Вміст солей у крові обумовлює її осмотичний тиск. Щоб клітини могли правильно функціонувати, осмотичний тиск повинен регулюватися. Він регулюється за допомогою нирок, і цей процес називається осморегуляцією. Він входить в загальний процес гомеостазу. Натрій хлорид входить до складу поту – це один з проявів гомеостазу. Головну роль в роботі центральної нервової системи (ЦНС) відіграють йони s-металів, знову таки Na+, К+. Сигнали нервової системи являють собою слабкі електричні імпульси, що виникають через раптову зміну концентрації йонів Na+та К+ у нервових клітинах. Ці йони відіграють також важливу роль у дифузії речовин крізь клітинні мембрани (калієво-натрієвий насос: калій виносить речовини з клітини, а натрій заносить). Організм сам відновлює йони калію, а вміст йонів натрію ми поповнюємо за рахунок вживання в їжу кухонної солі. Літій карбонат використовують як антидепресивний лікарський засіб, його призначають для вживання під час лікування шизофренії та інших психічних захворювань. Застосування рубідію і цезію обмежені через велику реакційну здатність, однак, рубідій використовують для стерилізації ліків.
Переходимо до вивчення хімічних властивостей лужних металів за допомогою схеми:
 Лужні метали – сильні відновники. Вони енергійно реагують з усіма
Лужні метали – сильні відновники. Вони енергійно реагують з усіма
3 неметалами, включаючи водень.
Li 6,941
2S1 1. з галогенами:
 Літій + Cl2 → 2МеCl
Літій + Cl2 → 2МеCl
2/1
![]() 11 2. з іншими неметалами:
11 2. з іншими неметалами:
Na 22,990 + S → Me2S
 3S1 + N2 → Me3N(тільки літій безпосередньо реагує)
3S1 + N2 → Me3N(тільки літій безпосередньо реагує)
Натрій 3. з воднем:
![]() 2/8/1 + Н2 → 2МеН
2/8/1 + Н2 → 2МеН
![]()
19
![]() К 39,098 2Ме0 з складними речовинами
К 39,098 2Ме0 з складними речовинами
4S1
Калій 4. з водою:
2/8/8/1 + 2НОН → 2МеОН +Н2↑
![]()
37 З кислотами лужні метали не реагують, оскільки реагують
Rb 85,468 активніше з водою, що міститься в кислотах.
5S1
Рубідій
2/8/18/8/1 З киснем при горінні тільки літій утворює оксид складу Ме2О:
4Li + O2 → 2Li2O
![]()
55 Інші лужні метали утворюють пероксиди складу Ме2О2:
Cs 132,91 2Na + O2 → Na2O2
6S1
Цезій Пероксиди є солями пероксиду водню Н2О2, ступінь окиснення
2/8/18/18/8/1 Оксигену у пероксидах – 1.
Вчитель. Деякі з цих властивостей ми доведемо експериментально. Також звернемо увагу на основний характер їхніх оксидів та гідроксидів. Згадуємо правила безпеки під час роботи з хімічними речовинами.
Вчитель обирає учня-асистента, який проводитиме експерименти.
Дослід 1. Взаємодія літію з водою.
Асистент. Для досліду ми беремо невеликий шматочок літію, добре його протираємо від рідини, у якій він зберігається. (Літій – активний метал, енергійно реагує з водою, навіть з вологою повітря, тому його зберігають у специфічній жирній рідині). У пробірку чи хімічний стакан наливаємо невелику кількість води, кидаємо туди шматок літію. Спостерігаємо бурхливу взаємодію літію з водою з виділенням газу водню та літій гідроксиду.
2Li + 2НОН → 2LiОН +Н2↑
Дослід 2.
Щоб переконатися у тому, що утворена у досліді 1 речовина дійсно літій гідроксид, опускаємо у пробірку лакмусовий папірець. Він набуває синього кольору. Ще можна перевірити вміст пробірки фенолфталеїном. Розчин фенолфталеїну у лужному середовищі стає малиновим.
Дослід 3. Можна скористатися іншим способом, щоб довести основний характер утвореного літій гідроксиду. Для цього до забарвленого фенолфталеїном розчину лугу додаємо невелику кількість хлоридної кислоти. Спостерігаємо виділення бульбашок води та зміну забарвлення. Розчин став прозорим. Перевіряємо його лакмусовим папірцем та підтверджуємо утворене нейтральне середовище.
LiОН + НСІ → LiСІ + НОН
Аналогічно основний характер мають і оксиди лужних металів.
ІV. Закріплення вивченого.
Завдання 1.
Який з гідроксидів лужних металів – найслабший, а який найсильніший? Чому?
Завдання 2.
Напишіть рівняння реакції за схемою:
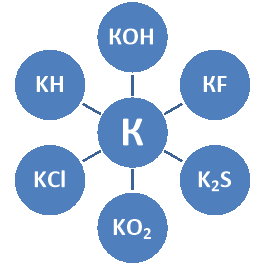
Завдання 3.
Натрій масою 2,3 г прореагував з водою. Який об'єм водню виділився при цьому?
V. Рефлексія.
- Чи сподобався вам сьогоднішній урок?
- Що нового ви сьогодні вивчили на уроці?
- Як ви думаєте, чи могла б людина прожити без кухонної солі?
- Як би ви провели цей урок, будучи вчителем?
VІ. Домашнє завдання: відповідні параграф у підручнику та сторінка у друкованому робочому зошиті з хімії (автор М.М.Савчин).


про публікацію авторської розробки
Додати розробку
