Маса та розміри атомів і молекул. Кількість речовини
1
КЗ «Василівська загальноосвітня школа І-ІІІ ступенів № 3» ВРР ЗО
Розробка уроку на тему:
«Маса та розміри атомів і молекул. Кількість речовини.»
Підготувала
викладач фізики
Таран Л. О.
м. Василівка
Маса розміри атомів і молекул. Кількість речовини.
Мета: навчальна: формуваня знань про відносну атомну масу та молярну масу, молекулярну масу, сталу Авогадро та її фізичний зміст, про способи обчислення маси молекул такількість молекул, які містяться в певному об`ємі речовини;
розвивальна: розвивати вміння систематизувати, встановлювати зв`язки нового з раніше вивченим, аналізувати навчальний матеріал, умову задачі, хід розв’язання;стисло та правильно висловлювати свої міркування та обгрунтовувати їхню правильність;формувати вміння самостійно працювати з коментуванням своїх дій; сприяти розвитку спостережливості, уваги, пам’яті, уяви, мислення, сприяти розвитку спостережливості, уваги, пам`яті, уяви, мислення;
виховна: виховувати почуття гордості за досягнення вчених-фізиків; формувати такі якості особистості, як відповідальність, організованість, дисциплінованість, обов’язок, порядність, правдивість, почуття колективізму.
Тип уроку: урок засвоєння нових знань.
Міжпредметні зв’язки: хімія, історія.
Хід уроку
I. Організаційний етап
Забезпечити робочу обстановку на уроці, створити сприятливий психологічний клімат
- привітання;
- перевірка готовності учнів до уроку;
- організація уваги.
ІІ. Перевірка домашнього завдання
Фронтальне опитування
- Сформулюйте основні положення МКТ.
- Що є найнаочнішим експериментальний підтвердженням існування молекул?
- У чому відмінність дифузії та броунівського руху?
- Наведіть приклади фактів існування дифузії в природі, діяльності людини.
ІІІ Повідомлення теми, мети й завдань уроку; мотивація навчальної діяльності
Запитання до класу: Чи є важливими знаннями про масу та розміри мікрочастинок? Чому? Де їх можна застосувати? (Останнім часом у біомедицині, фармацевтиці, електроніці, оптоелектроніці, хімічній і керамічній промисловостях досліджуються наночастинки зі щораз меншими розмірами і з різноманітним складом матеріалів. Дуже важливими характеристиками для кінцевого споживача є розмір частинки і розподіл розмірів частинок цих матеріалів, оскільки вони впливають на властивості, такі, як площа поверхні, густина матеріалу, в'язкість, текучість, швидкість реакції та хімічна активність, міцність кераміки.)
Основні одиниці вимірювання фізичних величин міжнародної системи одиниць (СІ) є метр (м), кілограм (кг), секунда (с), ампер (А), кельвін (К), кандела (кд). Хоча для однієї одиниці – моль – скороченого запису немає.
Яке відношення має ця одиниця до молекулярної фізики, ми сьогодні й дізнаємося.
Учитель повідомляє тему уроку і пропонує учням ознайомитися з планом її вивчення, записаним на дошці. Потім просить учнів самостійно сформулювати мету уроку і необхідності вносить корективи у їхні відповіді.
План вивчення теми
- Відносна молекулярна маса.
- Кількість речовини.
- Стала Авогадро.
- Молярна маса.
- Обчислення маси молекули та кількості молекул в об`ємі речовини.
ІV Вивчення нового матеріалу, його сприймання й осмислення
1. Відносна молекулярна маса
Маси окремих молекул дуже дрібні. Наприклад, маса однієї молекули води становить близько 3·10−26 кг. Молекули інших речовин мають маси такого ж порядку. Оскільки маси молекул дуже дрібні, у розрахунках зручно використовувати не абсолютні значення мас, а відносні. За міжнародною угодою, маси всіх атомів і молекул порівнюють з 1/12 маси атома Карбону. Головна причина такого вибору полягає в тому, що Карбон входить до складу великої кількості різних хімічних сполук.
Однак у більшості розрахунків (у тому числі розв’язуючи задачі) можна прийняти, що 1 атомна оодиниця маси дорівнює масі атома Гідрогену.
Масу молекули, виражену в атомних одиницях маси, називають відносною молекулярною масою. Відносна молекулярна маса позначається Mr.
Відносна молекулярна маса Mr дорівнює відношенню маси молекули m0 певної речовини до 1/12 маси атома Карбону m0C:
![]()
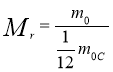
Аналогічно відносній молекулярній масі визначається й відносна атомна маса як маса атома, виражена в атомних одиницях маси.
Значення відносної атомної маси для певної речовини можна знайти за допомогою таблиці Менделєєва, округливши наведене в ній значення до цілого.
Один з учнів робить «Амедео Авогадро», «Дмитро Іванович Менделєєв» решта доповнюють виступ фактами, про які не було згадано.
Дмитро Іванович Менделєєв — автор фундаментальних досліджень з хімії, фізики, метрології, метеорології, економіки, автор основних праць з повітроплавання, сільського господарства, хімічної технології, народної освіти та інших робіт, тісно пов'язаних з потребами розвитку продуктивних сил Російської імперії.
Періодичний закон
Працюючи над працею «Основи хімії», Дмитро Іванович Менделєєв відкрив у лютому 1869 року один з фундаментальних законів природи — періодичний закон хімічних елементів.
6 березня 1869 знамениту доповідь Менделєєва «Співвідношення властивостей з атомною масою елементів» прочитав М. А. Меншуткін на засіданні Російського хімічного товариства.
Розвиваючи в 1869–1871 роках ідеї періодичності, Дмитро Іванович Менделєєв увів поняття про місце елемента в періодичній системі як сукупності його властивостей у співставленні з властивостями інших елементів. На цій основі, зокрема, спираючись на результати вивчення послідовності зміни склоутворювальних оксидів, виправив значення атомних мас 9 елементів (берилію, індію, урану та ін.) Передбачив у 1870 році існування, обчислив атомні маси й описав властивості трьох ще не відкритих тоді елементів — «екаалюмінію» (відкритий в 1875 році і названий галієм), «екабору» (відкритий в 1879 році і названий скандієм) і «екасіліцію» (відкритий в 1885 році і названий германієм). Потім пророкував існування ще восьми елементів, у тому числі «двітеллура» — полонію (відкритий у 1898 році), «екайоду»— астату (відкритий у 1942–1943 роках), «екамарганцю» — технецію (відкритий у 1937 році), «двімарганцю» — ренію (відкритий у 1925 році), «екацезію» — франція (відкритий у 1939 році).
Дослідження газів
Ця тема в наукової діяльності Д. І. Менделєєва пов'язана, перш за все, з пошуком вченим фізичних причин періодичності. Оскільки властивості елементів перебували в періодичній залежності від атомних ваг, маси, дослідник шукав можливість пролити світло на цю проблему, з'ясовуючи причини сил тяжіння і за допомогою вивчення властивостей їхнього передавального середовища.
Концепція «світового ефіру» мала в XIX столітті великий вплив на можливе рішення даної проблеми. Передбачалося, що «ефір», що заповнює міжпланетний простір, є середовищем, що передає світло, тепло і гравітацію. Дослідження сильно розріджених газів представлялося можливим засобом доведення існування названої субстанції, коли властивості «звичайної» речовини вже не здатні були б приховувати властивості «ефіру».
Одна з гіпотез Д. І. Менделєєва зводилася до того, що специфічним станом газів повітря при великому розрідженні і міг виявитися «ефір» або якийсь газ з дуже малою вагою. Дмитро Менделєєв написав на відбитку з «Основ хімії», на періодичній системі1871 року: «Легше всіх ефір, в мільйони разів», а в робочому зошиті 1874 року вчений висловлює ще більш ясно хід думки: «При нульовому тиску у повітря є деяка щільність, це і є ефір!». Проте серед його публікацій цього часу таких певних міркувань не висловлено.
У контексті припущень, пов'язаних з поведінкою сильно розрідженого газу (інертного — «найлегшого хімічного елемента») в космічному просторі, Д. І. Менделєєв спирається на відомості, отримані астрономом А. А. Бєлопольським: «Інспектор Головної Палати мір і ваг, обов'язково забезпечив мене наступними результатами новітніх досліджень, у тому числі і Бєлопольського». А далі він прямо посилається на ці дані у своїх висновках. При всій гіпотетичній спрямованості вихідних передумов цих досліджень, основним і найважливішим результатом в області фізики, отриманим завдяки ним Дмитром Менделєєвим, було виведення рівняння стану ідеального газу, що містить універсальну газову сталу. Також дуже важливим, але трохи передчасним, було запропоноване Д. І. Менделєєвим введення термодинамічної шкали температур.
Вченим також було обрано правильний напрямок для опису властивостей реальних газів. Віріальні розкладання, використані ним, відповідають першим наближенням у відомих зараз рівняннях для реальних газів.
Щоб визначити відносну молекулярну масу речовини, потрібно знати її хімічну формулу й відносні атомні маси атомів, що входять до складу молекули цієї речовини.
Наприклад, відносна молекулярна маса води дорівнює 18, тому що відповідно до хімічної формули води (H2O) молекула води складається з двох атомів Гідрогену (з відносною атомною масою 1) і одного атома Оксигену (з відносною атомною масою 16).
2. Кількість речовини
Кількість речовини найбільш природно було б вимірювати числом молекул або атомів у тілі. Але число молекул у будь-якому макроскопічному тілі настільки велике, що в розрахунках використовують не абсолютне число молекул, а відносне.
Фізичну величину, що визначає число молекул у певному тілі, називають кількістю речовини.
Як одиницю вимірювання кількості речовини вибрали таку кількість молекул, щоб їхня загальна маса, виражена в грамах, чисельно дорівнювала відносній молекулярній масі.
Оскільки маси окремих молекул відрізняються одна від одної, то однакові кількості різних речовин мають різну масу. Наприклад, 1025 молекул водню і 1025 молекул кисню вважаються однаковою кількістю речовини, хоча вони мають різні маси (33,45 г і 531,45 г відповідно). Отже, маса не є мірою кількості речовини.
Одиницею кількості речовини є моль.
Один моль — це кількість речовини, що містить стільки ж молекул, скільки атомів Карбону міститься у 12 г вуглецю.
Кількість речовини в зразку, виражена в моль, позначається ν.
Для більшості розрахунків (у тому числі для розв’язання задач) можна прийняти, що один моль містить стільки ж молекул, скільки атомів Гідрогену міститься в 1 г водню.
3. Стала Авогадро
Число N молекул, що містяться в тілі, пропорційне кількості речовини ν, що міститься в цьому тілі: N~ν. Коефіцієнт пропорційності називають сталою Авогадро й позначають NA.
Кількість молекул в одному моль називається сталою Авогадро:
NA = 6,02·10-23 моль-1.
Фізичний зміст сталої Авогадро: число Авогадро показує, що в одному молі будь-якої речовини міститься 6,02·1023 молекул.
Також Авогадро встановив закон, який назвали на його честь.
Закон Авогадро: у рівних об`ємах різних газів за однакових умов завжди міститься однакова кількість молекул.
Учні продовжують робити доповідь про вчених.
Амеде́о Авоґа́дро — італійський вчений, фізик, хімік. За освітою юрист, закінчив юридичний факультет Туринського університету. З 1800 самостійно вивчав математику, фізику і хімію. У 1809-1819 викладав фізику у ліцеї м. Верчеллі. З 1820 Авоґадро професор фізики в Туринському університеті. Став першим хіміком який ввів постійну одиницю.
Досліджував різні фізичні і хімічні явища. Заклав основи молекулярної теорії (1811), обґрунтувавши думку, що атоми можуть сполучатися в молекули, дослідами Гей-Люссака та основними положеннями атомістики Дж. Дальтона. Авоґадро встановив важливий фізичний закон — закон Авогадро, на підставі якого визначають атомну і молекулярну масу. Ім'ям Авоґадро названа універсальна стала — число Авогадро, число молекул в одному молі ідеального газу (NA = 6.02214129×1023 моль−1). Розробив метод визначення молекулярної маси, завдяки чому, використавши експериментальні дані інших дослідників, уперше правильно вирахував атомні маси кисню, вуглецю, азоту, хлору та ін. елементів. Встановив точний кількісний склад багатьох речовин — води, кисню, аміаку та багатьох оксидів. Також вивчав кристалічну будову твердих тіл і узагальнив відомості про склад речовини. Його праці сприяли подальшому розвитку Атомно-Молекулярної теорії.
Маса одного моль води, що містить NA молекул, дорівнює 18 г, а маса однієї молекули води дорівнює 18 а.о.м. Отже, стала Авогадро є перекладним множником між грамом і атомною одиницею маси: в одному грамі міститься NA атомних одиниць маси.
Оскільки стала Авогадро чисельно дорівнює числу молекул в одному моль, то
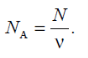
4. Молярна маса
Масу одного моль речовини називають молярною масою.
Маса m тіла пропорційна кількості речовини ν, що міститься в цьому тілі. Тому відношення m/М характеризує речовину, з якої складається це тіло: чим «важчі» молекули речовини, тим більше це відношення.
Відношення маси речовини m до кількості речовини ν називається молярною масою і позначається М :
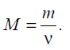
Якщо прийняти в цій формулі ν = 1 отримаємо, що молярна маса речовини чисельно дорівнює масі одного моль цієї речовини.
Одиницею вимірювання молярної маси в системі СІ є кг/моль, оскільки маса вимірюється в кілограмах, а кількість речовини — у моль; М = Мr ·10-3.
Якщо молярна маса M і кількість речовини ν відомі, можна обчислити масу речовини:
![]()
- Обчислення маси молекули та кількості молекул в об`ємі речовини.
Інколи для розв`язуваня задач молекулярної фізики необхідно вміти обчислювати масу молекули та кількість молекул, яка міститься в речовині.
Визначити масу речовини можна в такий спосіб:
- Молярну масу речовини розділити на число молекул в одному молі речовини, тобто на число Авогадро:
![]()
- Масу всієї речовини розділити на число молекул в ній:
![]()
- Густину речовини розділити на концентраціюмолекул, тобто на їх число в одиниці об`єму:
![]()
Число молекул у певному об`ємі речовини можна знайи також у декілька сособів. Розглянемо три з них.
- Число молекул у речвині даної маси або даного об`єму дороівнює добутку числа молекул в одному молі, тобто добутку числа Авогадро на число молей в речовині:
N=NAν
- Число молекул дорівнює відношенню маси речовини до маси однієї молекул:
![]()
- Число молекул дорівнює добутку числа молекул в одиниці об`єму речовини, тобто їх концентрація на їхній об`єм:
N=nV
V Застосування набутих знань
Розв`язуваня задач
- Визначте за системою хімічних елементів Менделєєва відносну атомну масу Літію, Магнію, Міді, Індію (в а.о.м.).
Розв`язування
Ar(Li) = 7 а.о.м.
Ar(Mg) = 24 а.о.м.
Ar(Cu) = 64 а.о.м.
Ar(In) = 115 а.о.м.
- Визначте відносну молекулярну масу молекули води ( в а.о.м. і кг).
Розв`язування
Mr(H2O) = 2* Ar(H)+ Ar(O)
Mr(H2O) = 2*1+16 = 18 а.о.м.
1 а.о.м. = 1,66*10-27 кг.
Mr(H2O) = 18*1,66*10-27 = 30*10-27 кг.
- Визначте відносну молекулярну масу молекули цекру С12Н22О11.
Розв`язування
Mr(С12Н22О11) = 12* Ar(С) + 22*Ar(Н) + 11*(О)
Mr(С12Н22О11) = 12*12+22*1+11*16 = 342 а.о.м.
1 а.о.м. = 1,66*10-27 кг.
М = Mr*10-3, М = 342*10-3 = 0,342 г/моль.
Задача для самостійного розв`язування
Обчисліть кількість речовини алюміній сульфату, якщо його маса становить 85,5 г.
n=m/M
- Обчислимо значення молярної маси солі
Mr (Al) = 27 а.о.м.
Mr (S) = 32 а.о.м.
Mr (O) = 16 а.о.м.
M (Al2(SO4)3) = 27*2+3(32+16*4) = 342 (г/моль)
2. Розрахуємо значення кількості речовини солі:
n (Al2(SO4)3) = m (Al2(SO4)3) / M (Al2(SO4)3) = 85,5 г / 342 г/моль = 0,25 моль.
Відповідь: n = 0,25 моль.
VІ Пібиття підсумків уроку та повідомлення домашнього завдання
Закінчіть речення так, щоб отримати правильне твердження
- Відношення маси молекули до 1/12 маси атома Карбону – це...(відносна молекулярна маса).
- Кількість речовини, яка містить стільки д атомів і молекул, скільки їх міститься в 12 г Карбону, називається...(молеам).
- Фізичний зміст молярної маси: молярна маса – це маса одного моля ... (речовини).
- Фізичний зміст сталої Авогадро: число Авогадро показує, що в даному молі будь-якої речовини міститься... (6,02*10-23 молекул)
Домашнє завдання
§40, Відповісти на запитання
Вправа 26 №1

про публікацію авторської розробки
Додати розробку
