Метан як представник насичених вуглеводнів
Тема: Вуглеводні. Метан як представник насичених вуглеводнів.
Мета: познайомити учнів з найпростішим представником органічних речовин – метаном; розглянути будову молекули метану, його молекулярну, структурну і електронну формулу; розкрити поняття «гібридизація електронних орбіталей», з’ясувати який тип гібридизації мають атом Карбону в молекулі метану; поглибити знання про фізичні властивості метану та про поширення метану в природі.
Обладнання: мультимедійна презентація до уроку, кулестержнева модель молекули метану, таблиця «Типи гібридизації», роздатковий матеріал, кубик.
Тип уроку: урок розвитку компетентностей.
Хід уроку
І. Організаційний етап:
Привітання, створення в учнів позитивного емоційного настрою: Інтерактивний прийом «Я вітаю» - учитель вимовляє: «Я вітаю тих, хто…», додаючи фрази «…вже прокинувся; випив кави; не снідав; у доброму гуморі; хоче спілкуватися» тощо. Після кожної фрази учні, які вважають, що фраза стосується їх, підводяться. Учитель та інші учні їм аплодують.
ІІ. Актуалізація опорних знань.
Перевірка домашнього завдання.
Гра з кубиком «Так чи ні»
(Вчитель по черзі кидає кубик учням. Учень, піймавши кубик, дає відповідь «так» чи «ні», коментує, в разі необхідності дає вірну відповідь.
1.Органічна хімія – це хімія сполук Карбону (так).
2. Карбон в органічних сполуках завжди чотиривалентний (так).
3.На зовнішньому енергетичному рівні атома Карбону міститься 6 електронів (ні).
4. В основному стані в атомі Карбону 4 неспарені електрони (ні).
5. В збудженому стані в атомі Карбону 2 неспарені електрони (ні).
6. Атоми Карбону здатні утворювати як йонні, так і ковалентні сильно полярні зв’язки (ні).
7. Атоми Карбону здатні утворювати між собою міцні ковалентні зв’язки і з’єднуватися в довгі ланцюжки або цикли (так).
8. Основні положення теорії хімічної будови органічних речовин сформулював Д.І. Менделєєв (ні).
9. Хімічна будова - це послідовність з’єднання атомів відповідно до їхньої валентності в молекулі (так).
10. Властивості речовин залежать тільки від того, атоми яких елементів і в якій кількості утворюють молекулу (ні).
11. Структурні формули – це такі формули, в яких символи хімічних елементів сполучаються рисочками, кількість яких дорівнює валентності елемента в сполуці (так).
12. Ізомери – це речовини,що мають однаковий склад, але різну будову (так).
13. Ізомери – це речовини, що мають однакові властивості (ні).
14. Структурні формули бувають розгорнуті та скорочені (так).
15. До складу вуглеводнів входять С, Н, О та іноді інші елементи (ні).
ІІІ. Мотивація навчальної діяльності
Ми почали знайомство з органічними речовинами. На сьогоднішньому уроці пропоную вам познайомитися з найпростішою органічною речовиною. Цю речовину в побуті називають болотним газом або руддниковим газом. 98% цієї речовини входить до складу природного газу. Молекулярна формула цієї речовини – СН4, а хімічна назва – метан.
Мета уроку: розглянути метан як найпростішу органічну речовину. Познайомитися з будовою молекули метану, типом гібридизації електронних орбіталей атома Карбону. Навчитися писати молекулярну, структурну, електронну формули молекули. Описати фізичні властивості метану та поглибити знання про поширення метану в природі.
План уроку:
1. Поняття про вуглеводні.
2. Будова молекули метану.
3. Фізичні властивості метану.
4. Поширення метану в природі.
ІV. Вивчення нового матеріалу
1. Поняття про вуглеводні.
Вуглеводні — це органічні сполуки, що складаються з двох елементів — Карбону і Гідрогену. У їхніх молекулах карбоновий скелет зв'язаний тільки з атомами Гідрогену. Загальну формулу вуглеводнів можна подати так: СxНy . До вуглеводнів належать гази метан СН4 та ацетилен С2Н2, рідини октан С8Н18 та бензен С6Н6, а також тверді речовини, наприклад парафін, що є сумішшю вуглеводнів. Решту органічних сполук можна розглядати як похідні відповідних вуглеводнів. Наприклад, оцтова кислота СН3 - СООН — це похідне етану СН3 - СН3, оскільки обидві сполуки мають однаковий карбоновий скелет С-С. Тому іноді органічній хімії дають таке визначення: органічна хімія — це хімія вуглеводнів та їхніх похідних.
Кількість різних вуглеводнів дуже велика. їх класифікація заснована на кратності зв'язків між атомами Карбону і наявності циклічних фрагментів у молекулах, що демонструє відповідна схема.
|
|
Вуглеводні СxНy |
|
||
|
|
||||
|
|
|
|
||
|
|
||||
|
Алкани СnН2n+2 (усі зв'язки одинарні) |
Циклоалкани СnН2n (усі зв'язки одинарні, але кар-боновий лан-цюг утворює цикл) |
Алкени СnН2n
(містять один подвійний зв'язок) |
Алкіни СnН2n-2
(містять один потрійний зв'язок) |
Арени СnН2n-6
(містять ароматичний зв'язок) |
2. Будова молекули метану.
- Найпростішими органічними речовинами є насичені вуглеводні (алкани)., які складаються лише з двох атомів Карбону і Гідрогену. Загальна формула алканів CnH2n+2. Найпершим представником є метан.Молекулярна формула метану: СН4. Тобто до складу молекули входить 1 атом Карбону і 4 атома Гідрогену.
Напишіть структурну формулу метану:
Н
| Вчитель демонструє кулестержневу модель метану.
Н―С ―Н
|
Н
- Яку будову має атом Карбону у збудженому стані?
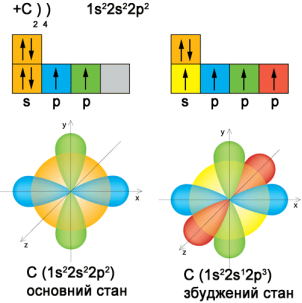
Рис. 1. Електронна будова Карбону
На зовнішньому шарі знаходиться 4 електрона: 1S – електрон та 3 Р – електрона. S електрони рухаються по кулеподібній орбіталі, а Р – електрони – по гантелеподібній орбіталі.
![]()
![]()
![]()
S – орбіталь та 3 Р- орбіталі
Отже валентність Карбону ІV. Дійсно атом Карбону в молекулі метану утворює 4 ковалентні полярні зв’зки з атомами Гідрогену. На моделі видно, що всі 4 зв’язки рівноцінні. Виникає питання: яким чином 1S-електрон і 3 Р-електрони утворюють рівноцінні зв’язки атомами Гідрогену?
Справа в тому, що електрони зовнішнього енергетичного рівня атома Карбону гібридизуються.
Гібридизація – вирівнювання різних орбіталей одного атома за формою та енергією.
Оскільки гібридизується 1S і 3Р електронні орбіталі, тому говорять, що в атом Карбону перебуває у стані SР3 – гібридизації. Утворюється 4 гібридні орбіталі.
![]()
![]()
![]() 1S + 3 Р → 4
1S + 3 Р → 4
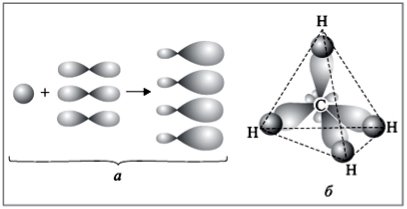
Рис. 2. Утворення sp3 гібридизації
- Як розташовуються ці орбіталі в просторі?
Оскільки електрони мають негативний заряд, то орбіталі відштовхуються. Найдалі один від одного вони стають тоді, коли кут між осями гібридних орбіталей становить 109°28'
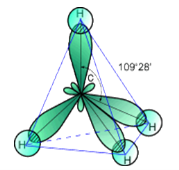
Рис. 3. Просторовий вигляд молекули метану
- Як утворюється молекула метану?
4 атома Гідрогену мають по 1 електрону. Це S електрони з кулястою хмарою. Електронні хмари Карбону перекриваються з електронними хмарами Гідрогену. Утворюються ковалентні полярні зв’язки. Молекула має форму тетраедра. (демонстрація молекули)
СН4 молекулярна формула метану
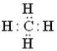 електронна формула метану
електронна формула метану
Н
|
Н―С ―Н структурна формула метану
|
Н
Структурна формула відображає послідовність з’єднання атомів у молекулі, але не відображає їх розміщення в просторі (це площинні схеми молекул)
Реальну будову (розміщення атомів у тривимірному просторі) передають кулестержневі або маштабні моделі молекули.
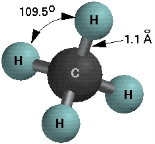
Рис. 4. Кулестрежнева будова метану
3. Фізичні властивості метану.
Робота з підручником
- Газ
- Безбарвний
- Без запаху
- Легший за повітря (Мr(СН4) = 16, Мr(пов) = 29)
- Майже не розчиняється у воді, але розчиняється в органічних розчинниках.
- tпл = -182,5°С, tкип = -161,5°С
4. Поширення метану в природі.
Бесіда
- Метан входить до складу природного газу (98%), є важливим компонентом попутного нафтового газу.
- Чимало метану в складі копального газу міститься у кам'яно-вугільних шахтах , тому його називають рудниковим газом. Вибухи суміші метану з киснем повітря (1:10) часто спричиняють масову загибель шахтарів.
Цікаво! У 19 столітті в сольовій копальні «Камера Спалена», що в горі Величка (Польща), були робітники, яких називали «грішниками, що каються». Вони надягали мокрий одяг з каптурами і повзали шахтами. Тримаючи в руці довгі ціпки, на кінці яких жевріли смолоскипи. У такий спосіб вони випалювали метан під стелею, не дозволяючи його концентрації сягнути критичної межі.
- Чимало метану утворюється внаслідок анаеробного бродіння рослинних решток у болотах (тому його називають болотний газ), річковому мулі, під час перетравлювання їжі великою рогатою худобою. Біогаз – продукт переробки фекалій і сміття – також переважно складається з метану.
Цікаво! Болотний газ хімічними методами вперше дослідив у 1776р. італійський природодослідник Алессандро Вольта і встановив його відмінність від водню. Також це природне джерело метану вивчали Бертолле, Дальтон, Берцеліус тощо. Болотний газ у неглибокій замуленій водоймі збирали в такий спосіб. Товстостінну склянку або пляшку занурювали у воду, аби вона заповнилася рідиною, потім повертали її догори дном, вставляли лійку і збирали метан, розпушуючи дно за допомогою ціпка. Коли в склянці збирався газ, її закорковували під водою й після цього виймали на поверхню.
- Трапляється метан і у Всесвіті. Його виявлено в атмосфері планет Юпітер, Сатурн, Уран і Нептун. Величезні озера рідкого метану є на поверхні Титана, найбільшого з природних супутників Сатурна.
- Величезні обсяги метану надходять в атмосферу з рисових полів, боліт, тваринних ферм тощо. Науковці стверджують, що це не лише сприяє глобальному потеплінню, а й виснажує озоновий шар планети.
Проблемне питання:
Чи справді метан немає запаху? Адже напевно кожен чув запах газу в квартирі чи біля машин ,які рухаються на газу.
Що потрібно робити , якщо відчули запах газу?
V. Узагальнення й систематизація знань.
1. Вправа «Дай відповідь»
- Органічні речовини, що складаються тільки з двох хімічних елементів.
- Всі зв'язки між атомами в молекулі метану однакові завдяки... електронних хмар (назив. відм.).
- Газ метан за частим його знаходженням у цьому місці в народі називають...
- Хімічна формула цієї речовини СН4.
- Електрони, які знаходяться на орбіталі по одному.
- Основний елемент органічних сполук.
- Один з рядів вуглеводнів, що мають загальну формулу С„Н2п+2.
- Елемент, що разом з Карбоном входить до складу молекул вуглеводнів.
Відповіді: 1. Вуглеводні. 2. Гібридизація. 3. Болотний. 4. Метан.
5. Неспарені. 6. Карбон. 7. Насичені. 8. Гідроген.
2. Розв’яжи задачі:
- Обчислити відносну густину метану за повітрям.
![]() Дано: М (СН4) 16
Дано: М (СН4) 16
![]()
![]() СН4 DповСН4 = = = = 0,55
СН4 DповСН4 = = = = 0,55
![]() М пов 29
М пов 29
DповСН4
- Обчислити масу 5л метану.
![]() Дано: m V m V
Дано: m V m V
![]()
![]()
![]()
![]() V (СН4) = 5 л υ = ; υ = ; =
V (СН4) = 5 л υ = ; υ = ; =
![]() M Vm M Vm
M Vm M Vm
m (СН4) - ?
M ∙ V
![]() m =
m =
Vm
16 ∙ 5
![]() m (CH4) = = 3, 57 г
m (CH4) = = 3, 57 г
22,4
3. Обчислити масові частки Карбону і Гідрогену в молекулі метану.
![]() Дано: Аr (C) 12
Дано: Аr (C) 12
![]()
![]() СН4 W(C) = = = 0,75 або 75%
СН4 W(C) = = = 0,75 або 75%
![]() Mr (CH4) 16
Mr (CH4) 16
W(C) – ?
W (H) - ?
W (H) = 100% - 75% = 25%
VІ. Підсумок уроку.
Розповідь вчителя.
Сьогодні на уроці ми з вами ознайомилися з одним із представників насичених вуглеводнів, детально розглянули його будову, фізичні властивості, поширення у природі і як потрібно нам поводитись, коли ми відчули запах газу.
VІІ. Виставлення оцінок та їх мотивація.
VІІІ. Домашнє завдання:
1. Опрацювати § ____, ст.
2. Виконати завдання № , ст.
3. Творче завдання: Написати повідомлення про застосування метану та його похідних.
-
Дякую!
-


про публікацію авторської розробки
Додати розробку
