|
9 клас
Тема уроку.
Класифікація хімічних реакцій за різними ознаками
Мета уроку: узагальнити й систематизувати знання учнів про хімічні реакції; розвивати вміння й навички визначення типів хімічних реакцій за рівняннями хімічних реакцій; формувати знання учнів про хімічні рівняння на прикладі класифікації рівнянь реакції за тепловим ефектом, наявністю каталізатора, зміною ступенів окиснення атомів у процесі хімічної реакції,напрямом хімічної реакції; розвивати навички складання рівнянь хімічних реакцій.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: розповідь учителя, фронтальна робота, презентація.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, слайди презентації.
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань.
Мотивація навчальної діяльності.
За два роки знайомства з хімією ми вивчили величезну кількість речовин, познайомилися з їх фізичними і хімічними властивостями, навчилися писати рівняння хімічних реакцій. Пригадайте, що таке хімічна реакція та хімічне рівняння.
Фронтальна бесіда
• Що таке хімічна реакція? Що таке рівняння хімічної реакції?
• Що показує рівняння хімічної реакції? (речовини, які вступають в хімічну реакцію і речовин, що утворюються внаслідок реакції)
Відомо дуже багато хімічних реакцій. Всі вони індивідуальні. Але хімічні реакції мають ряд спільних ознак, що дає змогу об’єднати їх у кілька типів. Які типи реакцій ви знаєте з курсу хімії 8 кл? (розкладу, сполучення, заміщення, обміну).
Завдання 1. Допишіть рівняння хімічних реакцій і вкажіть тип реакції. (На дошці написані рівняння, які учні по черзі повинні закінчити.)
FeO + H2 = KOH + H3PO4 =
CaCO3 = Al + CuSO4 =
AlCl3 + NaOH = KClO3 =
Zn + H2SO4 = P2O5 + H2O =
Завдання 2. Запишіть рівняння хімічної реакції горіння метану CH4.
IІІ. Вивчення нового матеріалу
Реакція горіння метану супроводжується виділенням тепла і світла. Для інших реакцій, навпаки, необхідно додаткове тепло ззовні.
Тепло, що виділяється або поглинається в результаті реакції, називається тепловим ефектом хімічної реакції ΔQ.
Тепловий ефект хімічної реакції пов’язаний з теплотою утворення речовин:
ΔQ = -ΔH
і вимірюється в джоулях Дж або кілоджоулях кДж.
За тепловим ефектом хімічні реакції поділяються на такі типи:
Екзотермічні — реакції, що протікають з виділенням тепла. Наприклад:
CH4 + 2О2 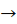 CО2 + 2Н2О; ΔН<0 CО2 + 2Н2О; ΔН<0
Ендотермічні — реакції, які протікають з поглинанням тепла. Наприклад:
N2 + О2 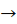 2NО; ΔН>0 2NО; ΔН>0
Завдання 3. Розставте коефіцієнти в рівнянні реакції та визначте тип реакції за тепловим ефектом, за складом і кількістю реагентів і продуктів реакції:
H2O2 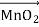 H2O + O2 ; ΔН>0 H2O + O2 ; ΔН>0
Н2 + О2 = Н2О ; ΔН<0
CuO + H2SO4 = CuSO4 + H2O ; ΔН>0
С + О2 = СО2 ; ΔН<0
NH3 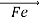 N2 + H2 ;ΔН>0 N2 + H2 ;ΔН>0
NaOH + HCl = NaCl + H2O ; ΔН>0
Завдання 4. З реакції в завданні 3 виберіть реакції, що протікають зі зміною ступеня окиснення.
Отже, за зміною ступеня окиснення реакції поділяють на:
Окисно-відновні – реакції, в яких спостерігається зміна ступеня окиснення елементів:
Са + О2 = СаО
Йонного обміну – реакції, які відбуваються без зміни ступеня окиснення елементів:
NaOH + HCl = NaCl + H2O
Завдання 5. Укажіть серед реакцій завдання 3 ті, що протікають у присутності каталізатора. Які речовини називаються каталізаторами?
Реакції поділяють на:
Каталітичні – в присутності каталізатора: H2O2 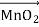 H2O + O2 H2O + O2
Некаталітичні – без каталізатора: С + О2 = СО2.
І, нарешті, остання класифікація- за напрямом процесу:
Необоротні – реакції, що проходять до кінця до повної витрати одного з реагентів (реакції, що відбуваються з виділенням газу, утворенням осаду чи утворенням малодисоційованої речовини):
CаO + H2SO4 = CаSO4 + H2O
Оборотні – реакції, що відбуваються одночасно в двох взаємно протилежних напрямах:
N2 + 3H2 = 2NH3
ІV. Підбиття підсумків уроку
Завдання 5. Складіть рівняння реакцій за схемою, укажіть тип хімічної реакції (за варіантами, зі взаємоперевіркою й обговоренням результатів):
а) кальцій 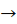 кальцій оксид кальцій оксид 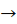 кальцій гідроксид кальцій гідроксид 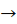 кальцій карбонат; кальцій карбонат;
б) карбон  карбон(IV) оксид карбон(IV) оксид  калій карбонат калій карбонат  калій сульфат; калій сульфат;
в) водень  гідроген хлорид гідроген хлорид  барій хлорид барій хлорид  барій сульфат. барій сульфат.
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
|

