Методична розробка уроку "Алюміній ,будова,властивості застосування"застосування
ДЕРЖАВНИЙ НАВЧАЛЬНИЙ ЗАКЛАД
“ХУДОЖНЄ ПРОФЕСІЙНО-ТЕХНІЧНЕ УЧИЛИЩЕ ІМ.Й.П.СТАНЬКА
АЛЮМІНІЙ, ВЛАСТИВОСТІ ТА ЗАСТОСУВАННЯ

Викладач хімії : Марія Формусяк
Тема: Алюміній,фізичні і хімічні властивості ,застосування.
Мета:
Освітня:
розширити і поглибити знання учнів про метали на прикладі Алюмінію - представника головної підгрупи ІІІ групи; розглянути загальну характеристику металу; поширення в природі; фізичні,хімічні властивості та застосування алюмінію; уміти складати хімічні реакції, що характеризують хімічні властивості алюмінію ;
Розвивальна:
розвивати творчу активність, логічне мислення, вміння думати,аналізувати;
розвивати пізнавальну цікавість до навчання, використовуючи знання про значення металів та їх сполук у практичній діяльності людини;
розвивати вміння встановлювати причинно- наслідкові зв'язки та застосовувати здобуті знання і навички в різних життєвих ситуаціях ;
формувати професійну компетентність учнів ,увагу та швидкість мислення ; культуру мовлення;;
Виховна :
виховувати інтерес до предмета,наполегливість, кмітливість формувати життєві компетенції, сприяти вихованню особистості.
Тип уроку : урок засвоєння нових знань
Дидактичне забезпечення уроку: періодична система хімічних елементів, таблиця розчинності кислот, основ, солей; презентація уроку.
Матеріально-технічне забезпечення уроку:мультимедійний проектор,ноутбук, мультимедійна презентація
Міжпредметні зв'язки :
а) з фізикою (електропровідність алюмінію )
б )хімія і мистецтво ( застосування сполук алюмінію , які входять до складу різноманітних фарб )
в) з виробництвом меблів (алюмінієва фурнітура, ніжки опори для столів, ручки, різноманітні профілі)
г) з медициною (виготовлення ліків, до складу яких входить алюміній )
д) з екологією ( використані баночки з під напоїв ( пива , енергетиків) збирати на переробку)
е)з географією (виробництво алюмінію -Миколаївський глиноземний завод,Запорізький алюмінієвий комбінат; боксити поширені на Закарпатті, в Приазов'ї ,Китай, Угорщина,Франція,США,Індія ,Туреччина і інші)
Очікувані результати:
Учні повинні знати:
охарактеризувати Алюміній як просту речовину , його фізичні властивості та хімічні властивості як представника металів ;
практичне застосування алюмінію в різних сферах життя та у живописі, мистецтві, меблевому виробництві;
Учні повинні вміти:
складати рівняння хімічних реакцій,що характеризують хімічні властивості Алюмінію;
встановлювати причинно-наслідкові зв'язки між будовою та властивостями речовин
використовувати набуті знання у різних життєвих ситуаціях
Учні повинні розуміти:
практичне застосування алюмінію людиною в житті та знаходження його сполук у природі.
Методи проведення уроку:
за джерелом знань: словесний, візуальний, уявно-практичний
за характером пізнавальної діяльності: пояснювально-ілюстративний
Додаткова інформація:
- повідомлення про історію відкриття алюмінію;
- цікаві факти про алюміній
Форми і методи роботи : фронтальне опитування , метод ”Продовж речення”, Learning Apps “Створи відповідність”,візуальний хімічний експеримент,виконання тестових завдань, метод “Анкета-рефлексія”
СТРУКТУРА УРОКУ
1.Організаційний момент (2,5 хв)
2.Актуалізація опорних знань та вмінь (5 хв)
3. Мотивація навчальної діяльності (1 хв)
4,Оголошення теми та мети уроку (0,5 хв)
5.Вивчення нового матеріалу:властивості і застосування алюмінію (30 хв)
6.Закріплення знань та вмінь -тести ( 5 хв)
7.Підведення підсумків (0,5 хв)
8.Домашнє завдання (0,5 хв)

ДЕВІЗ :
Просто знати - це не все .
Знання потрібно вміти використовувати. Й .Гете.
ХІД УРОКУ
І. Організаційний момент
ІІ. Актуалізація опорних знань (фронтальне опитування)
Слайд
а)Метод “Продовж речення”
- Яких елементів більше: металічних чи неметалічних? Де розташовані в період. системі метали
- Який метал найпоширеніший у земній корі?
- Які метали найкраще проводять електричний струм.
- Найтугоплавкіший метал… Плавляться в долоні..
- Найлегший… найпластичніший метал….
- Найтвердіший метал… Метал яким можна писати...
7. Метал у рідкому стані…Метали хірургів
б) Learning Apps “Створи відповідність”
Покликання на вправу :
https://learningapps.org/view21020607
ІІІ. Мотивація навчальної діяльності і повідомлення теми уроку
Ми продовжуємо вивчати тематичний блок «Метали» і сьогодні познайомимося з металом, що займає в ПС проміжне місце між металами і неметалами. Цікавий і навіть унікальний за своїми властивостями.
Р.Декарт сказав : “Щоб удосконалити розум , треба більше
розмірковувати ніж заучувати”
Тож давайте спробуємо разом поміркувати,прослухавши загадку
Загадка: Займає перше місце в природі за поширенням і друге місце після заліза за обсягом виробництва. 1/5 частина глини складається з цього металу. Його ще називають «крилатим металом».
Блискучий, білий і твердий,
У сплавах він завжди легкий.
Він у своїй клітинці
У Менделєєва таблиці.
Усюди він навколо нас,
Та і кується просто клас.
У складі глини і рубінів,
Метал корисний…
(Алюміній)
Повідомлення теми уроку 
Тема: Алюміній,фізичні та хімічні властивості ,застосування.
ІV. Вивчення нового матеріалу
- Історична довідка (повідомлення учня, розповідь вчителя).
Існує легенда, що понад 2 тис. років тому до римського імператора Тиберія прийшов ювелір із металевою обідньою тарілкою, що не розбивалася, виготовленою нібито з глини. Тарілка була дуже світлою й блищала як срібло, але набагато легша. За всіма ознаками вона мала бути алюмінієвою. При цьому ювелір стверджував, що тільки він і боги знають, як одержати цей метал з глини. Тиберій, побоюючись, що метал із легкодоступної глини може знецінити золото та срібло, наказав, про всяк випадок, відрубати людині голову. Очевидно, легенда досить сумнівна, тому що самородний алюміній у природі не зустрічається через свою високу активність, і за часів Римської імперії не могло бути технічних засобів, які б дозволили видобувати алюміній з глинозему.


Поширення Алюмінію в природі.
Найважливіші природні сполуки Алюмінію: боксити: Al2O3*nH2O
Каолін: Al2O3*nSiO2
Нефелін: Na2O* Al2O3*2 SiO2
Кріоліт: Na3AlF6
Корунд: Al2O3


Електронна будова атома Алюмінію (опорна схема характеристики хімічного елементу за положенням в ПС).
Al 1S22S22P63S23P1
+13
2 8 3

Алюміній – сріблясто-білий метал, легкоплавкий (температура плавлення – 6600С), легкий (густина – 2,7 г/см3), пластичний, має високу електропровідність і теплопровідність, утворює з іншими металами легкі і міцні сплави. Алюміній на повітрі миттєво взаємодіє з киснем і вкривається дуже тонкою, але надзвичайно міцною оксидною плівкою, яка захищає його від руйнування.
Хімічні властивості Алюмінію:

a) Взаємодія з простими речовинами:
з киснем: 4Al + 3O2 = 2Al2O3
З галогенами:
а)взаємодія з бромом 2Al + 3Br2 = 2AlBr3

б)взаємодія з йодом: 2Al + 3l2 = 2All3
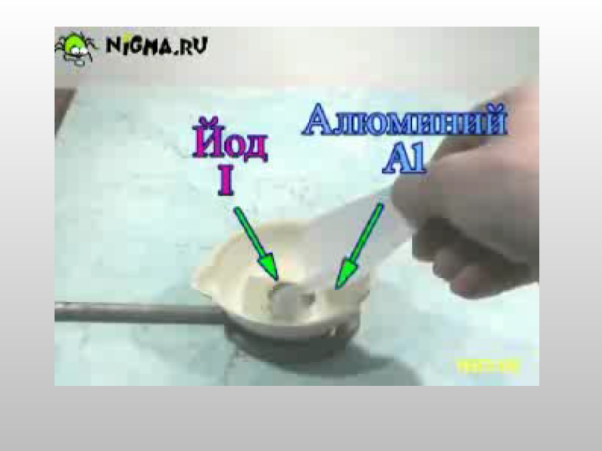
● З іншими неметалами: 2Al + 3S = Al2S3
2Al + N2 = 2AlN
4Al + 3C = Al4C3
б) Взаємодія зі складними речовинами:
● З водою після зняття оксидної плівки: 2Al + 6H2O = 2Al(OH)3 + 3H2
● З розведеними кислотами (крім нітратної) 2Al + 6HCl = 2AlCl3 + 3H2
● З розчинами лугів: 2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
● З оксидами металів (алюмотермія) 2Al + Cr2O3 = Al2O3 + 2Cr
Сполуки алюмінію:
● Al2O3 – оксид алюмінію, білий тугоплавкий порошок, нерозчинний у воді. Утворює мінерал корунд. Його коштовні різновиди – червоний рубін і синій сапфір. Оксид Al2O3 є амфотерним.
● Al(OH)3 – гідроксид алюмінію, білий, нерозчинний у воді, типовий амфотерний гідроксид.
Застосування Алюмінію та його сплавів:

● В електротехніці;
● 
● 
● В автомобілебудуванні, літакобудування, суднобудуванні, космічній техніці;
● 
● Для одержання металів у вільному стані;
● В будівництві;
● В побуті
● Для виготовлення фольги;
● В деревообробці
● у меблевому виробництві
● для виробництва фарб
V. Узагальнення і систематизація знань
а)Закінчити схему реакції: Al → Al2O3 → AlCl3 → Al(OH)3
https://naurok.com.ua/test/join?gamecode=2312901&authuser=0
VI.Рефлексія
Анкета-рефлексія
VII. Підсумок
Алюміній
За обсягами виробництва поступається лише залізу;
⅕ частина глини складається з цього металу.
Має плівку захисну
На основі його сплавів
Деталі роблять в літаку,
Для тролейбусів, вагонів,
Для автобусів, машин,
Для пароплавів і паромів
Він під номером один.
З металу посуд виробляють
Та упаковку харчову.
І фарбу “срібну” кожен має
У господарстві на дому.
VII. Домашнє завдання § 26, ст. 131, впр. 4, 5 (М.М.Савчин Хімія 11 клас)
Література
1.М.М. Савчин Хімія. Підручник для 11 класу для закладів загальної середньої освіти. Рівень стандарту - К.: в-во «Грамота» , 2019.
2.П.П. Попель, Л.С. Крикля Хімія. Підручник для 10 класу загальноосвітніх навчальних закладів. Рівень стандарту – К.: в-во «Академія», 2010. – 130 с.
3.О.Г. Ярошенко Хімія. Підручник для 10 класу загальноосвітніх навчальних закладів. Рівень стандарту – К.: в-во «Грамота» , 2010. – 214 с.
https://www.youtube.com/watch?v=G6fe2YcumNc
https://uk.wikipedia.org/wiki/%D0%90%D0%BB%D1%8E%D0%BC%D1%96%D0%BD%D1%96%D0%B9
http://metalelit.com.ua/ua/alyuminiy-ukr.html


про публікацію авторської розробки
Додати розробку
