Методична розробка уроку: «І закон термодинаміки»
Методична розробка уроку з предмета: «Фізика»
Розділ програми: «Основи термодинаміки»
Тема уроку: «І закон термодинаміки»
Мета уроку: встановити зв'язок між зміною внутрішньої енергії системи, роботою і кількістю теплоти, що передана системі,
пояснити його фізичну сутність та значення для опису процесів молекулярної фізики;
показати, як застосувати перший закон термодинаміки для ізопроцесів;
ввести поняття «адіабатний процес»;
розвивати логічне мислення учнів; продовжити формувати навички розв'язування задач з теми;
виховувати свідомого ставлення до набуття нових знань.
Методична мета уроку: використання інформаційно-комунікаційних технологій як засобу підвищення якості знань учнів.
Обладнання: комп’ютер, проектор, екран, мультимедійна презентація, «Бібліотека електронних наочностей», комп’ютерна програма «Фізика 10 клас» (ІІ частина), опорні конспекти на партах.
Тип уроку: комбінований урок.
Хід уроку
І. Організаційний момент:
- вітання;
- перевірка присутності учнів;
- оголошення теми та основних завдань уроку.
ІІ. Перевірка домашнього завдання:
- перевірка розв’язування задачі;
- демонстрація самостійно підготовлених дослідів;
- бесіда по питанням вивченої теми (взаємоперевірка).
ІІІ. Актуалізація опорних знань та вмінь:
- визначте, які із наступних тверджень вірні, а які хибні;
- наведіть власні приклади зміни внутрішньої енергії.
ІV. Вивчення нового навчального матеріалу:
- Перший закон термодинаміки.
- Застосування першого закону термодинаміки до ізопроцесів.
- Адіабатний процес.
- Застосування першого закону термодинаміки до адіабатного процесу.
- Демонстрації з комп’ютерної програми «Фізика 10 клас» (ІІ частина):
- І закон термодинаміки (навчальний відеофільм 11.1).
- Демонстрації з «Бібліотеки електронних наочностей»:
- нагрівання газу в циліндрі, робота газу по підняттю поршня в циліндрі (п. 1.2.2);
- адіабатне стискання та розширення (п. 1.2.5).
V. Закріплення вивченого матеріалу:
- питання учням;
- розв’язування розрахункових задач.
VІ. Рефлексія:
- вправа «Мікрофон».
VІІ. Підсумки уроку. Оцінювання.
VІІІ. Домашнє завдання:
- Вивчити теоретичний матеріал по конспекту; § 55 (Фізика-10. Є.В. Коршак, О.І. Ляшенко, В.Ф. Савченко. 2010);
- Додаткове завдання: підготувати проект на одну із запропонованих тем:
- «Двигун внутрішнього згоряння. Парова і газова турбіна. Реактивний двигун. Холодильна машина»;
- «Способи підвищення ККД теплових двигунів. Роль теплових двигунів у народному господарстві»;
- «Проблеми парникового ефекту та руйнування озонового шару атмосфери»;
- «Вплив продуктів функціонування теплових двигунів на біологічні системи. Екологічно чисті види палива для теплових двигунів».
- Знайдіть інформацію про історію створення вічних двигунів.
Структура та зміст уроку
І. Організаційний момент
- Рапорт командира групи, вітання.
- Перевірка присутності учнів (в рапорті називаються прізвища відсутніх); оголошення теми; розкриття загальної мети та плану проведення уроку, основних форм роботи учнів на уроці.
Викладач: «Яку тему ми вивчили на попередньому уроці? («Робота в термодинаміці»). Тема сьогоднішнього уроку: «І закон термодинаміки». Записали тему в зошити.
Слайд № 1

ІІ. Перевірка домашнього завдання
Викладач: «Дома ви повинні були розв’язати задачу. Хто прокоментує її розв’язок?» Один з учнів коментує, а на екрані поступово з’являються основні прокоментовані етапи (формули, обчислення) розв’язування задачі.
 Умова задачі: Яку роботу виконує вуглекислий газ масою 200 г під час ізобарного нагрівання на 88 К?
Умова задачі: Яку роботу виконує вуглекислий газ масою 200 г під час ізобарного нагрівання на 88 К?
![]() Розв’язання:
Розв’язання:
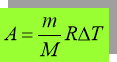
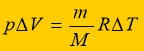
![]()
![]()
![]()
Слайд № 2

Викладач: «Вам будо додаткове завдання: підготувати декілька дослідів, які ілюструють зміну внутрішньої енергії газу внаслідок роботи газом або над газом». Якщо учні підготували досліди, то демонструють їх.
Бесіда по питанням вивченої теми (взаємоперевірка).
Один учень обирає когось із групи і задає йому питання. «Обраний» учень повинен відповісти на поставлене питання. Якщо відповіді немає, або вона не повна, то відповідає на поставлене питання бажаючий учень, або ж учень, який задавав питання.
Можливі питання:
- визначення внутрішньої енергії;
- як визначають роботу газу і роботу зовнішніх сил над газом;
- що називається кількістю теплоти;
- визначення термодинамічної рівноваги;
- що називається теплопередачею.
ІІІ. Актуалізація опорних знань та вмінь
- Визначте, які із наступних тверджень вірні, а які хибні:
- коли сірник внесли у полум'я свічки, то внутрішня енергія збільшилась внаслідок механічної роботи; (хибна)
- коли сірник запалили об коробок, то внутрішня енергія збільшилась внаслідок теплопередачі; (хибна)
- коли пилка нагрілась після розпилювання дров, то внутрішня енергія збільшилась внаслідок механічної роботи; (вірна)
- коли штучний супутник нагрівся під час входження в атмосферу Землі, то внутрішня енергія збільшилась внаслідок теплопередачі; (хибна)
- коли склянку з водою кімнатної температури поставили в холодильник, то внутрішня енергія зменшилась внаслідок теплопередачі; (вірна)
- коли дах будинку нагрівся під прямими променями Сонця, то внутрішня енергія збільшилась внаслідок теплопередачі. (вірна)
- Наведіть власні приклади зміни внутрішньої енергії.
(деформація дроту, удари молотка по дроту, падіння метеорита, нагрівання газу в колбі, нагрівання води у чайнику, ложка в гарячій воді, нагрівання предметів від Сонця, системи опалення, та ін..)
ІV. Вивчення нового матеріалу
На кожному уроці на партах учнів знаходяться опорні конспекти, в яких є всі визначення і формули з поясненнями, тому учні мають можливість записати навчальний матеріал з теми, як з екрану під час демонстрації презентації, так і з опорного конспекту.
Закон збереження і перетворення енергії в природі: енергія в природі не виникає з нічого і не зникає безслідно; вона лише переходить з однієї форми в іншу.
Цей фундаментальний закон природи в термодинаміці сформульовано у такій формі: перехід термодинамічної системи з одного стану в інший характеризується зміною її внутрішньої енергії, що дорівнює сумі роботи зовнішніх сил і кількості теплоти, що надана системі:
∆U = А + Q .
Це і є перший закон термодинаміки. Але на практиці перший закон термодинаміки записують в іншому вигляді, тому що основний інтерес представляє не робота зовнішніх сил, що скоєна над газом, а робота, що скоєна газом над зовнішніми тілами. Крім того величиною, що шукають буває кількість теплоти. Якщо газ сам виконує роботу внаслідок теплопередачі, то перший закон термодинаміки має вигляд: кількість теплоти, що передано системі, йде на зміну внутрішньої енергії та виконання роботи системою над зовнішніми тілами:
Q = ∆U + A
Слайд № 3

Застосування першого закону термодинаміки до ізопроцесів.
При ізохорному процесі об’єм газу не змінюється і тому робота газу дорівнює нулю. Отже, ![]() .
.
Якщо газ нагрівається, то Q 0 і ![]() 0; його внутрішня енергія збільшиться. При охолодженні газу Q 0 і
0; його внутрішня енергія збільшиться. При охолодженні газу Q 0 і ![]() 0; його внутрішня енергія зменшиться.
0; його внутрішня енергія зменшиться.
При ізотермічному процесі (![]() ) внутрішня енергія ідеального газу не змінюється. Згідно з формулою
) внутрішня енергія ідеального газу не змінюється. Згідно з формулою ![]() , уся передана газу кількість теплоти витрачається на виконання газом роботи:
, уся передана газу кількість теплоти витрачається на виконання газом роботи: ![]() .
.
Якщо газ дістає теплоту (Q 0), то він виконує додатну роботу (![]() 0). Якщо газ віддає теплоту навколишньому середовищу (термостату), то Q 0 і
0). Якщо газ віддає теплоту навколишньому середовищу (термостату), то Q 0 і ![]() 0. А робота зовнішніх сил над газом в останньому випадку додатна.
0. А робота зовнішніх сил над газом в останньому випадку додатна.
При ізобарному процесі, згідно з формулою ![]() , кількість теплоти, яка передається газу, витрачається на зміну його внутрішньої енергії і виконання роботи при сталому тиску.
, кількість теплоти, яка передається газу, витрачається на зміну його внутрішньої енергії і виконання роботи при сталому тиску.
Адіабатний процес – процес у теплоізольованій системі (система, яка не обмінюється теплотою з навколишніми тілами).
Слайд № 4

При адіабатному процесі Q = 0 і згідно з формулою ![]() внутрішня енергія змінюється лише за рахунок виконання роботи:
внутрішня енергія змінюється лише за рахунок виконання роботи: ![]() .
.
У випадку стиснення газу (над системою виконується додатна робота), внутрішня енергія його збільшується. Це свідчить про підвищення температури газу. Навпаки, розширюючись, сам газ виконує додатну роботу (![]() 0) його внутрішня енергія зменшується – газ охолоджується.
0) його внутрішня енергія зменшується – газ охолоджується.
Якщо на дно циліндра покласти змочений ефіром клаптик вати і швидко опустити поршень униз, то пара ефіру загориться. (Демонстрація відео досліду, при наявності технічних можливостей, демонстрація досліду «наживо»).
- Демонстрації з комп’ютерної програми «Фізика 10 клас» (ІІ частина):
- І закон термодинаміки (навчальний відеофільм 11.1, тривалість 2 хв. 12 сек.).
- Демонстрації з «Бібліотеки електронних наочностей»:
- нагрівання газу в циліндрі, робота газу по підняттю поршня в циліндрі (п. 1.2.2);
- адіабатне стискання та розширення (п. 1.2.5).
Для здійснення адіабатного процесу, треба щоб він відбувся досить швидко без помітного теплообміну.
Нагрівання повітря від швидкого стискання застосовується у двигунах Дизеля. У цих двигунах немає системи запалювання горючої суміші, яка є у звичайних карбюраторних двигунах внутрішнього згорання. У циліндр засмоктується не пальна суміш, а атмосферне повітря. Під кінець такту стиску в циліндр за допомогою спеціальної форсунки впорскується рідке пальне. На цей момент температура повітря така висока, що пальне загоряється. Двигуни Дизеля мають більший ККД, ніж карбюраторні, але вони складніші у виготовленні й експлуатації.
Охолодження газу під час адіабатного процесу відбувається у величезних масштабах в атмосфері Землі. Нагріте повітря піднімається вгору і розширюється, оскільки атмосферний тиск зменшується з висотою. Це розширення супроводжується значним охолодженням. Внаслідок цього пара конденсується й утворюються хмари.
V. Закріплення вивченого матеріалу
Питання учням:
- який знак може мати кожна із величин, що входять до першого закону термодинаміки? Наведіть приклади, що підтверджують вашу відповідь.
Відповідь: величини, що входять до першого закону термодинаміки можуть мати знаки „+” та „–” .Наприклад, Q>0, якщо система отримує енергію шляхом теплообміну; Q<0, якщо система віддає енергію таким же шляхом. Знак роботи А залежить від знаку ∆\/.
- чому можна сказати, що система має запас внутрішньої енергії, але не можна сказати, що вона має запас кількості теплоти чи роботи?
Відповідь: тому що у різних випадках однакову кількість внутрішньої енергії можна змінити різними способами.
Розрахункові задачі
Задача 1. На скільки змінилась внутрішня енергія газу, який виконав роботу 50 кДж, коли отримав кількість теплоти 85 кДж?

![]()
![]() Дано: Розв'язання:
Дано: Розв'язання:
А = 50·103 Дж В цьому випадку запишемо формулу
Q = 85·103 Дж І закону термодинаміки так ∆U = 85·103 - 50·103 =
_____________ Q = ∆U + A = 35·103 (Дж) = 35 кДж
∆U - ? ∆U = Q – А
[ U ] = Дж – Дж = Дж
Відповідь: збільшиться на 35 кДж.
Задача 2. Одноатомному газу, кількістю речовини 2 моля, передано кількість теплоти 1,2 кДж. При цьому газ виконав роботу 600 Дж. На скільки змінилась температура газу?
![]()
 Дано: Розв'язання:
Дано: Розв'язання:
![]() = 2 моль І закон термодинаміки для цього випадку має вигляд
= 2 моль І закон термодинаміки для цього випадку має вигляд
Q = 1,2·103 Дж Q = ∆U + A
А = 600 Дж Зміна внутрішньої енергії одноатомного газу
_______________ ∆U = 3mR∆T/2M
∆Т - ? Кількість речовини визначимо
![]() =m/М = ∆U=3
=m/М = ∆U=3![]() R∆T/2
R∆T/2
Рівняння І закону термодинаміки стане
Q = (3![]() R∆T/2) + А 3
R∆T/2) + А 3![]() R∆T/2 = Q – А
R∆T/2 = Q – А
∆Т = 2(Q – А)/3![]() R
R
[∆Т] = Дж·моль·К/моль·Дж = К
∆Т = 2(1200 – 600) /3·2·8,31= 24 (К)
Відповідь: збільшилась на 24 К.
 Задача 3. Для приготування ванни місткістю 200 л змішали холодну воду 10 °С з гарячою при 60 °С. Які об’єми тієї і іншої води треба взяти, щоб температура встановилась 40 °С?
Задача 3. Для приготування ванни місткістю 200 л змішали холодну воду 10 °С з гарячою при 60 °С. Які об’єми тієї і іншої води треба взяти, щоб температура встановилась 40 °С?
![]() Дано: Розв'язання:
Дано: Розв'язання:
![]()
![]() V = 200 л Q1 + Q2 = 0; -2m1 + 3m2 = 0;
V = 200 л Q1 + Q2 = 0; -2m1 + 3m2 = 0;
= 103 кг/м3 Q1 = cm1(T3 – T1); 2m1 + 2m2 = 400;
m = 200 кг Q2 = cm2(T3 – T2); Додомо рівняння системи:
Т1 = 333 К cm1(T3 – T1) + cm2(T3 – T2) = 0; | :с 5m2 = 400 ![]() m2 = 80 (кг);
m2 = 80 (кг);
Т2 = 283 К m1(T3 – T1) + m2(T3 – T2) = 0; m1 + m2 = 200 ![]()
Т3 = 313 К m1(-20К) + m2(30К) = 0; ![]() m1 = 200 - m2 = 120 (кг).
m1 = 200 - m2 = 120 (кг).
![]() ___________ -2m1 + 3m2 = 0; Оскільки в 1 літрі 1 кг води
___________ -2m1 + 3m2 = 0; Оскільки в 1 літрі 1 кг води
V1 - ? m1 + m2 = 200; | · 2 ( = 103 кг/м3), то отримаємо
V2 - ? V1 = 120 л; V2 = 80 л.
Відповідь: 120 л; 80 л.
VІ. Рефлексія
Інтерактивна вправа «Мікрофон»
Питання:
- які питання викликали у вас найбільші труднощі?
-
розв’язання якої задачі для вас залишилось незрозумілим?
- на скільки оцінюєте свою активність під час проведеного уроку, наскільки він для вас був цікавим?
VІІ. Підсумки уроку. Оцінювання
- загальні висновки по роботі групи та досягненні мети уроку;
- винести подяку учням за активну участь у проведенні уроку;
- оцінити відповіді учнів;
- про практичне застосування вивченого на сьогоднішньому уроці більш детально ми поговоримо протягом двох наступних уроків.
VІІІ. Домашнє завдання
- Вивчити теоретичний матеріал по конспекту; § 55 (Фізика-10. Є.В. Коршак, О.І. Ляшенко, В.Ф. Савченко. 2010);
- Додаткове завдання: підготувати проект на одну із запропонованих тем:
- «Двигун внутрішнього згоряння. Парова і газова турбіна. Реактивний двигун. Холодильна машина»;
- «Способи підвищення ККД теплових двигунів. Роль теплових двигунів у народному господарстві»;
- «Проблеми парникового ефекту та руйнування озонового шару атмосфери»;
- «Вплив продуктів функціонування теплових двигунів на біологічні системи. Екологічно чисті види палива для теплових двигунів».
- Знайдіть інформацію про історію створення вічних двигунів.
Слайд № 5


про публікацію авторської розробки
Додати розробку
