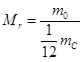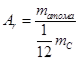Методична розробка уроку "Маса та розмір молекули. Кількість речовини. Кількість молекул.""
Тема: Основні положення молекулярно-кінетичної теорії будови речовини. Броунівський рух. Дифузія
1)навчальна мета: розширити уявлення учнів про внутрішню будову речовини, сприяти засвоєнню учнями основних положень МКТ та їх дослідному обґрунтуванню; розглянути властивості агрегатних станів речовини з точки зору МКТ,
2)розвивальна мета: розширити уявлення учнів про оточуючий світ, продовжити формування поняття матерії, за допомогою дослідів, які експериментально підтверджують справедливість МКТ довести факт існування найменших частинок речовини; розвивати вміння систематизувати відомі фізичні факти, спостережливість, уміння встановлювати причинні зв'язки; звернути увагу, що в природі постійно діє діалектичний закон перетворення кількісних змін в якісні та навпаки.
3)виховна мета: формувати в учнів самостійну, творчу активність, ініціативу як стійкі якості особистості;
Формування компетентностей:
Предметні: сформувати уявлення про будову речовини, познайомити з поняттям молекула, кількість речовини, показати яким чином можна знайти кількість молекул в речовині, пояснити агрегатний стан речовини на основі основних положень МКТ;
КЛЮЧОВІ КОМПЕТЕНТНОСТІ
Спілкування державною: формувати уміння ставити запитання і розпізнавати проблему; міркувати, робити висновки на основі інформації, поданої в різних формах (у текстовій формі, відео інформації, таблицях, діаграмах ); розуміти, пояснювати і перетворювати тексти задач (усно і письмово), вміло висловлюватися рідною мовою; доречно та коректне вживати в мовленні термінологію з окремих предметів, чітко, лаконічно та зрозуміло формулювати думку, аргументувати, доводити правильність тверджень;
Математична компетентність: продовжити формувати навички розв’язувати задачі, зокрема практичного змісту; будувати і досліджувати найпростіші математичні моделі реальних об'єктів, процесів і явищ, інтерпретувати та оцінювати результати; використовувати математичні методи у життєвих ситуаціях.
Основні компетентності у природничих науках і технологіях: розпізнавати проблеми, що виникають у довкіллі; будувати та досліджувати природні явища і процеси;
Уміння вчитися впродовж життя: усвідомлення власних освітніх потреб та цінності нових знань і вмінь; зацікавленість у пізнанні світу; розуміння важливості вчитися впродовж життя; прагнення до вдосконалення результатів своєї діяльності.
Екологічна грамотність і здорове життя: продовжити формування усвідомлення учнями взаємозв’язку кожного окремого предмета та екології на основі різних даних; ощадне та бережливе відношення до природніх ресурсів, чистоти довкілля та дотримання санітарних норм побуту;
Очікувані результати: учні оперують поняттями і термінами молекулярно-кінетичної будови речовини, обґрунтовуюсь основні положення дослідами, які підтверджують ці положення; пояснюють причини броунівського руху та прогнозують зміни, які відбуватимуться при броунівському русі при зміні зовнішніх макропараметрів (температури, в’язкості речовини тощо)
Тип уроку: урок формування компетентностей
Основні терміни і поняття: молекула, речовина, кількість речовини, молярна маса, моль, агрегатний стан.
Міжпредметні зв’язки: хімія, біологія, екологія.
Обладнання: відео-презентація
Форма провудення: відео урок
Хід уроку:
І. Орієнтація, мотивація діяльності.
Вітаю Вас, шановні учні! Я, Данильченко Наталя Вікторівна, викладач фізики ХПЛЗтаП сьогодні пропоную вам віртуально зазирнути всередину макроскопічного тіла та з’ясувати від чого залежить його властивості? .
Кожного дня ми стикаємося з різними речовинами та предметами, використовуємо їх у своїй життєдіяльності. При цьому ми змінюємо і кількість і якість речовини, мало хто замислюємося над тим, що при цьому відбувається: магія, фокус або фізичні процеси та явища. Наприклад готуємо та споживаємо їжу додаючи до неї різні продукти та приправи змінюючи її смак, сприймаємо різні запахи, змінюємо колір та форму предметів і таких прикладів можливо привести безліч. Чому одна речовина може існувати в різних агрегатних станах? Наприклад всім відома вода: водяна пара, рідина та лід. Від чого це залежить та про що це свідчить? На всі ці питання дамо відповіді при вивчені молекулярної фізики.
ІІ. Цілепокладання.
- Повідомлення теми, мети, завдань уроку.
Сьогодні ми з’ясуємо, які основні положення МКТ, та дослідно їх обґрунтуємо, дамо визначення найменшої частини речовини та знайдемо спосіб для обчислення кількості речовини та кількості молекул.
- Мотивація навчальної діяльності.
Ви не раз чули такі вислів « Я те, що я їм, п’ю, дихаю» та не раз використовували прислів’я « Ложка дьогтю зіпсує бочку меду»
На при кінці уроку розглянемо ці фрази на основі молекулярної фізики та розкриємо їх суть в прямому значенні.
ІІІ. Цілереалізація
- Актуалізація й корекція опорних знань.
Основи сучасних уявлень про будову речовини були закладені в ті далекі часи, коли людина лише робила спробу зрозуміти суть речей, що оточували її.
Такі невіддільні від матерії поняття, як рух, дискретність були вже предметом дискусій старогрецьких натурфілософів. Поняття «атом» (неподільний) запровадив Демокрит (V ст. до н. е.). Нині уявлення про перервну, молекулярну будову речовини стало стрункою теорією, перевіреною безліччю експериментів.
Властивості тіл визначаються насамперед їхньою внутрішньою будовою, властивостями частинок, з яких вони складаються, силами, які діють між частинками та ін. Тому питання про будову речовини є одним з основних у фізиці та інших науках про природу.
Досягнення молекулярної фізики широко використовують в інших науках про природу. З її успіхами, зокрема, нерозривно пов'язаний розвиток хімії і біології. В процесі розвитку в молекулярній фізиці виділилися самостійні розділи, наприклад: фізична хімія, фізична кінетика, молекулярна біологія, фізика твердого тіла та ін.
Основні поняття молекулярної фізики використовують у деяких спеціальних галузях науки, зокрема, у фізиці металів, полімерів і плазми, кристалофізиці, фізико-хімічній механікі.
Молекулярна фізика є науковою основою сучасного матеріалознавства, вакуумної технології, порошкової металургії, холодильної техніки та ін.
2. Сприйняття й первинне усвідомлення навчального матеріалу, . осмислення зв'язків і співвідношень в об'єктах вивчення.
Молекулярна фізика – наука про молекулярну будову, властивості, тепловий рух речовин у різних аґреґатних станах і їх взаємні переходи.
Речовина може перебувати в трьох агрегатних станах: твердому, рідкому і газоподібному. Молекулярно-кінетична теорія зародилася в ХІХ-му столітті з метою пояснити будову і властивості речовини на основі уявлень про те, що речовина складається з найдрібніших частинок — молекул, які безперервно рухаються й взаємодіють одна з одною. Особливих успіхів ця теорія досягла під час пояснення властивостей газів.
Молекулярно-кінетичною теорією називають вчення про будову і властивості речовини на основі уявлень про існування атомів і молекул як найменших частинок хімічних речовин.
- Основні положення молекулярно-кінетичної теорії та її підтвердження на основі дослідів
В основі МКТ лежать три основні положення:
1) всі речовини утворені з найдрібніших частинок — молекул, які самі складаються з атомів.
Молекули й атоми являють собою електрично нейтральні частинки. За певних умов молекули й
атоми можуть набувати додаткового електричного заряду та перетворюватися на позитивні або
негативні іони;
2) атоми й молекули перебувають у безперервному хаотичному русі;
3) частинки взаємодіють одна з одною силами, що мають електричну природу.
Порівняння газів, рідин і твердих тіл
Більшість оточуючих нас тіл знаходяться в одному з трьох агрегатних станах речовини — твердому, рідкому й газоподібному паливі. У 20-му столітті, коли почали досліджувати мікроскопічну будову тіл, було виявлено структуру цих станів речовини. Молекулярно-кінетична теорія дає можливість зрозуміти, чому речовина може перебувати в газоподібному, рідкому й твердому станах.
Властивості газів визначаються в основному рухом молекул, оскільки взаємодією молекул можна знехтувати. У зв’язку з тим, що молекули в усіх газах рухаються практично однаково, властивості різних газів подібні.
Молекули в газах розташовані не впритул — в середньому на відстанях, які набагато перевищують розміри самих молекул. Наприклад, у повітрі відстань між молекулами приблизно в 10 разів більша за розміри молекул. Гази легко стискаються, при цьому зменшується середня відстань між молекулами.
Молекули з величезними швидкостями — сотні метрів за секунду — рухаються в просторі. Стикаючись, вони відштовхуються одна від одної в різні боки, подібно до більярдних куль. Слабкі сили тяжіння молекул газу не здатні утримати їх одна біля одної. Численні удари молекул об стінки посудини створюють тиск газу.
Молекули рідини розташовані майже впритул одна до одної, тому молекула рідини веде себе інакше, не як молекула газу. Затиснута, як у клітці, іншими молекулами, вона здійснює «біг на місці» (коливається близько положення рівноваги, стикаючись з сусідніми молекулами). Лише час від часу вона здійснює «стрибок», прориваючись крізь «прути клітки», але відразу ж потрапляє в нову «клітку», утворену новими сусідами. Час осілого життя молекули води, тобто час коливання близько одного певного положення рівноваги за кімнатної температури, так само в середньому 10-11 с. А час одного коливання значно менший (10-12 - 10-13 с). З підвищенням температури час осілого життя молекул зменшується.
Молекули рідини знаходяться безпосередньо одна біля одної. Під час спроби змінити об’єм рідини починається деформація самих молекул. Для цього потрібні дуже великі сили. Цим і пояснюється мале стискання рідин.
Як відомо, рідина може витікати, тобто не зберігає свою форму. Пояснити це можна так. Якщо рідина не тече, то «стрибки» молекул з одного осілого положення в інше відбуваються з однаковою частотою за всіма напрямами. Зовнішня сила помітно не змінює число стрибків молекул за секунду. Але переміщення молекул з одного осілого положення в інше відбуваються переважно в напрямі дії зовнішньої сили. Ось чому рідина тече й приймає форму посудини.
Атоми або молекули твердих тіл коливаються близько певних положень рівноваги. Іноді молекули змінюють положення рівноваги, але відбувається це рідко. Ось чому тверді тіла зберігають не тільки об’єм, але й форму.
Якщо з’єднати центри положень рівноваги атомів твердого тіла, то вийде правильна просторова сітка, яка називається кристалічною.
Внутрішній порядок у розташуванні атомів кристалів впливає на формування правильних зовнішніх геометричних форм.
Висновок: агрегатний стан речовини залежить від відстані між молекулами, від їх руху та взаємодії
Найяскравішим експериментальним підтвердженням уявлень про молекулярно-кінетичну теорію (безладний рух атомів і молекул) є броунівський рух. Це тепловий рух найдрібніших мікроскопічних частинок, зважених у рідині або газі. Воно було відкрите англійським ботаніком Р. Броуном у 1827 р. Броунівські частинки рухаються під впливом безладних ударів молекул. Через хаотичний тепловий рух молекул ці удари ніколи не врівноважують одна одну. У результаті швидкість броунівської частинки безладно змінюється за модулем і напрямом, а її траєкторія утворює складну зигзагоподібну криву.
Теорія броунівського руху була створена А. Ейнштейном у 1905 р. Експериментально теорія Ейнштейна була підтверджена в дослідах французького фізика Ж. Перрена, проведених у 1908-1911 pp
Постійний хаотичний рух молекул речовини проявляється тв іншому явищі, яке легко спостерігати— дифузії.
Дифузією називається явище проникнення двох або кількох дотичних речовин одна в одну.
Дифузія призводить до утворення однорідної суміші, незалежно від густини компонентів.
Дифузія й броунівський рух — споріднені явища. Взаємопроникнення дотичних речовин одна в одну й безладний рух найдрібніших частинок, зважених у рідині або газі, відбуваються внаслідок хаотичного теплового руху молекул.
Досліди (розчин чаю, кави о холодній та гарячій воді)
Висновки: швидкість хаотичного руху молекул залежить від температури.
Явище дифузії має велике значення для життя людини. В роботі дихальної системи та живлення клітин лежить явище дифузії. Шляхом дифузії через стінки альвеол і кровоносних капілярів до нашого організму потрапляє кисень та відводиться вуглекислий газ. Механізм транспорту речовин до клітини та з неї теж грунтуєтся на явищі дифузії.
Узагальнення й систематизація знань, застосування їх у різних ситуаціях,.наближених до життєвих.
Пояснимо прислів’я « Ложка дьогтю зіпсує бочку меду» . Речовина дьоготь та мед складається з молекул які неперервно та хаотично рухаються. В наслідок явища дифузії через певний час речовини змішаються.
Що до вислову « Я те, що я їм, п’ю, дихаю», до організму людини потрапляють всі речовини які є в їжі, воді та повітрі. І саме зараз неможливо не говорити про екологічні проблеми які є на Землі та зокрема в Україні, це забруднення води, почви, повітря. Досягнення науково- технічного прогресу для людства має дві сторони. З одного боку це розвиток цивілізації, покращення умов життя людини( трансторт, різноманітні новітні хімічні спо
Переконатися в існуванні молекул і оцінити їх розмір можна досить просто. Помістимо маленьку крапельку олії на поверхню води. Масляна пляма буде розтікатися по поверхні води, але площа масляної плівки не може перевищувати певного значення.
Можна припустити, що максимальна площа плівки відповідає масляному шару товщиною в одну молекулу. Наприклад, крапелька оливкової олії об’ємом 1 мм3 розтікається площею не більшою 1 м2. Звідси випливає, що розмір молекули олії порядку 10-9 м.
Використовуючи презентацію до уроку , які демонструють розмір атома у порівнянні з тілами макросвіту.
Молекула менша за яблуко у стільки разів, у.скільки разів яблуко менше за Землю.
Якщо уявити, що олія створює на поверхні води плівку завтовшки в одну молекулу, то така плівка буде тонша за людську волосину приблизно в 40 000 разів.
У 1 см2 повітря стільки молекул, що, взявши таку саму кількість піщинок, можна було б засипати територію великого підприємства.
Якщо взяти таку кількість цеглин, скільки молекул міститься в 1 см3 повітря, то цегла б щільно вкрила поверхню Землі шаром заввишки 120 м (висота 40-поверхового будинку).
У краплі води діаметром 0,1 мм приблизно 1016 молекул, що майже в мільйон разів більше, ніж людей, які мешкають на Землі.
Відповідно надзвичайно малі і маси атомів і молекул, тому для розв'язання задач молекулярної фізики замість власне мас атомів і молекул використовують їхні відносні величини, порівнюючи масу атома або молекули із ![]() маси атома Карбону. Таке порівняння було прийнято в 1961 році за пропозицією Д. Дальтона. Подібний вибір обумовлено тим, що Карбон входить до складу багатьох хімічних сполук. А множник
маси атома Карбону. Таке порівняння було прийнято в 1961 році за пропозицією Д. Дальтона. Подібний вибір обумовлено тим, що Карбон входить до складу багатьох хімічних сполук. А множник ![]() введено для того, щоб відносні атомні маси наближалися до цілих чисел.
введено для того, щоб відносні атомні маси наближалися до цілих чисел.
|
Відносна молекулярна маса Мr |
— це відношення маси молекули до |
де |
|
Відносна атомна маса Аr |
— це відношення маси атома до |
де |
|
Атомна одиниця маси (а. о. м.) |
Через малу масу молекул і атомів їхні маси часто вимірюють не в одиницях СІ — кілограмах, а в атомних одиницях маси (а. о. м.) — маси |
|
Кількість речовини
У минулому столітті італійський вчений Авогадро виявив дивний факт: якщо два різних гази знаходяться в посудинах з однаковим об'ємом, однаковою температурою й тиском, то в кожній посудині знаходиться одне і те ж число молекул. Зауважте, маси газів при цьому можуть відрізнятися дуже сильно: наприклад, якщо в одній посудині водень, а в іншому — кисень, маса кисню в 16 разів більше за масу водню. Це означає, що деякі, причому досить важливі, властивості тіла визначаються числом молекул у цьому тілі: число молекул виявляється навіть більш істотним, ніж маса.
Фізична величина, яка визначає число молекул у даному тілі, називається кількістю речовини й позначається літерою ν.
Одиницею кількості речовини є моль:
один моль — це кількість речовини, яка містить стільки ж молекул, скільки атомів вуглецю міститься в 12 г вуглецю.
Для більшості розрахунків (у тому числі під час вирішення завдань) можна прийняти, що один моль містить стільки ж молекул, скільки атомів водню міститься в 1 г водню.
Молярна маса М дорівнює відношенню маси речовини т до кількості молей ![]() у ній:
у ній:
![]()
де ![]() — кількість речовини.
— кількість речовини.
Фізичний зміст молярної маси: молярна маса — це маса одного моля речовини.
Одиниця молярної маси в СІ — кілограм на моль (кг/моль), ![]()
Молярний об’єм (об'єм одного моля речовини) ![]() можна знайти, розділивши молярну масу речовини
можна знайти, розділивши молярну масу речовини ![]() на її густину
на її густину ![]() :
:
![]()
Стала Авогадро, її фізичний зміст
Італійський фізик і хімік Амадео Авогадро в XIX ст. визначив кількість молекул в одному молі речовини. Цю кількість назвали сталою Авогадро NA:
![]()
Фізичний зміст сталої Авогадро: число Авогадро показує, що в одному молі будь-якої речовини міститься ![]() молекул.
молекул.
Також Авогадро встановив закон, який назвали законом Авогадро.
Закон Авогадро: у рівних об'ємах різних газів за однакових умов завжди міститься однакова кількість молекул.
Обчислення маси молекули та кількості молекул в об'ємі речовини
Інколи для розв'язування задач молекулярної фізики необхідно вміти обчислювати масу молекули та кількість молекул, яка міститься в речовині.
Визначити масу молекули ![]() можна у такий спосіб.
можна у такий спосіб.
![]()
Число молекул N у деякому об'ємі речовини можна знайти також у декілька способів.
![]()
Можна сказати, що ΝΑ — це «місток» між макросвітом (світом оточуючих нас тіл) і мікросвітом (світом атомів і молекул). Якщо дане тіло містить ν молей речовини, то число молекул N у цьому тілі визначається виразом:
![]() .
.
Відношення числа молекул N до об'єму V, займаному цими молекулами, називається концентрацією молекул і позначається n:
![]() .
.
Концентрація молекул вимірюється в 1/м3.
ЗАКРІПЛЕННЯ ВИВЧЕНОГО
- Рефлексія.
- Домашнє завдання
|
Основні положення МКТ |
Дослідне обґрунтування, |
Конкретні приклади або пояснення результатів дослідів, явищ або визначення |
Що підтверджують досліди, явища |
|
|
Всі речовини дискретні, складаються з молекул (атомів) між якими проміжки |
Подільність речовини, наявність межі дрібнення речовини |
Залишки крейди на шкільній дошці, розчинення акварельної фарби (солі, цукру) у воді, зменшення концентрації розчину при доливанні води |
Підтверджують наявність у будь-якої речовини найменших частинок |
|
|
Фотографії внутрішньої будови, отримані за допомогою електронного мікроскопу |
|
|||
|
Утворення мономолекулярних плівок (гас, олія) на поверхні рідини |
Товщина такої плівки приблизно така ж як і розмір молекули гасу, олії |
|||
|
Молекули (атоми) перебувають у безперервному хаотичному русі |
Дифузія (розповсюдження запахів, розчинність речовини у рідині) |
Взаємне проникнення молекул речовин, які взаємодіють між собою, у міжмолекулярні проміжки іншої. |
|
|
|
Осмос |
Одностороння дифузія крізь пористу перегородку |
|
||
|
Броунівський рух |
Рух частинок, завислих в рідині або газі |
Рух частинок пояснюється нескомпенсованим ударом молекул рідини (газу) з різних боків, |
||
|
Внутрішнє тертя в рідинах і газах |
|
|
||
|
Між молекулами (атомами) діють сили притягання й відштовхування |
Збереження форми та об’єму твердого тіла; |
склеювання деталей, нанесення захисних плівок на вироби |
Підтвердження сил взаємодії між частинками речовини |
|
|
Виникнення сил пружності, в’язкості рідини, сухого тертя |
|
|
||


про публікацію авторської розробки
Додати розробку