Методична розробка відкритого заняття
Самбірський фаховий медичний коледж
Циклова комісія загальноосвітніх дисциплін
Електричний струм в електролітах. Закони Фарадея. Застосування електролізу (електрофорез, гальванізація)
Методична розробка
теоретичного заняття з дисципліни «Фізика»
для студентів спеціальності «Фармація»
(мультимедійна презентація)
Самбір
2019
Самбірський фаховий медичний коледж
Циклова комісія загальноосвітніх дисциплін
Електричний струм в електролітах. Закони Фарадея. Застосування електролізу (електрофорез, гальванізація)
Методична розробка відкритого
теоретичного заняття з фізики
для студентів І-их курсів
спеціальності «Фармація»
Підготувала:
викладач фізики Ковальчук С.П.
Обговорено і схвалено на засіданні циклової комісії загальноосвітніх дисциплін
Протокол № _6_ від 09 лютого 2012р.
Самбір
2019
І. Науково-методичне обгрунтування теми
Навчальний матеріал заняття передбачає з’ясування умов проходження електричного струму в рідинах. Вивчення законів електролізу та застосування електролізу на практиці, зокрема у фармації, оскільки розвиток і удосконалення фізико-фармакологічних методів лікування викликані перш за все практичною необхідністю.
1. Фізичні фактори, являються активними фізико-хімічними подразниками, не тільки самі чинять на організм лікувальну дію, але і підготовляють його до дії ліків. крім цього, при фізико-фармакологічних методах лікування забезпечують позитивні зміни фізичних властивостей і фармакологічної активності ліків, продовження часу їх дії, створення високої концентрації в патологічному вогнищі.
2. Достоїнство і перевага фізико-фармакологічних методів по порівнянню з традиційними фармакотерапевтичними значною мірою можуть проявлятись лише при правильному виборі ліків, обліку індивідуальної реактивності організму і особливостей протікання захворювання, своєчасної корекції дозування, чіткому дотриманні техніки і методики проведення процедур, правильному комбінуванні з іншими лікувальними заходами.
ІІ. НАВЧАЛЬНА МЕТА:
Знати:
- визначення сили струму; формульне визначення;
- знати умови проходження струму в різних середовищах, провідність рідин і розчинів, ознайомити студентів з провідністю електролітів, вивести закон Фарадея. Забезпечити засвоєння і закріплення нового матеріалу, розширити знання студентів, продовжити формування поняття «електролізу», формування поняття єдності теорії і практики. Забезпечити повторення і закріплення матеріалу.
Вміти:
- записувати окисно-відновні реакції;
- розв'язувати ситуаційні задачі та проблемні задачі щодо даної теми.
Виховна мета:
- виховання професійної спрямованості;
- виховувати любов до обраної професії, відповідальність за невиконання посадових обов'язків та інструкцій;
- виховувати у студентів відповідальне ставлення до навчання;
- виховувати почуття відчуття відповідальності за свої дії та обов'язку;
- правове виховання.
РОЗВИВАЮЧА МЕТА:
- розвивати пізнавальну активність студентів та їх логічне мислення;
- розвивати у студентів гуманне ставлення до людей.
- виділити головне у великому обсязі інформації за допомогою опорного конспекту. Зіставляти поняття процесу електролізу з фізичної та хімічної точки зору. Розвивати пізнавальний інтерес.
ІІІ. МІЖДИСЦИПЛІНАРНА ІНТЕГРАЦІЯ
|
Дисципліна |
Знати |
Вміти |
|
І. Попередні дисципліни: Хімія
Математика
|
|
Вміти записувати рівняння реакцій.
Виводити робочі формули
|
|
ІІ. Наступні дисципліни: Фізіотерапія
Біофізика
|
Основи проведення електрофорезу, значення прикладеної напруги, та максимального можливе значення сили струму Закони Фарадея
|
Готувати хворого до проведення процедури
Записувати закони Фарадея |
|
ІІІ. Внутрішньо-дисдиплінарна інтеграція: Електродинаміка
|
Умови існування струму. Визначення та відмінності між постійним та змінним струмом. |
Складати електричне поле. Розрізняти прилади постійного та змінного струму. |
ІV. ОБЛАДНАННЯ ТА ТЕХНІЧНІ ЗАСОБИ НАВЧАННЯ:
Таблиці:
Слайди (демонстрація навчального матеріалу з використанням
мультимедійного проектора).
Відеофрагменти навчальних фільмів.
Вид заняття: теоретичне заняття (мультимедійна презентація з використанням навчальних фільмів).
Місце проведення: лабораторія фізики
Тривалість: 80 хв.
V. ОРГАНІЗАЦІЙНА СТРУКТУРА ЗАНЯТТЯ
|
№ п/п |
Основні етапи і навчально-цільові питання |
Форми і методи контролю |
Засоби навчання |
Час |
|
|
І. |
Підготовчий етап:
|
α І – α ІІІ
α ІІІ
α ІІ
α І α ІІ α І – α ІІ
|
тести;
проблемна задача усне опитування; фронтальне опитування; рецензування відповідей.
Фронтальна постановка проблемних запитань |
Картки навчальних досягнень
Роздатковий матеріал
Слайди (демонстрація з використанням мультимедійного обладнання)
|
25хв 5 хв.
20хв 5 хв.
5 хв.
5 хв.
5 хв.
5 хв.
|
|
ІІ. |
Основний етап:
Тема: “Електричний струм в електролітах. Закони Фарадея. Застосування електролізу (електрофорез, гальванізація)”. План1. Електролітична дисоціація. 2. Закони Фарадея. 3. Застосування електролізу на практиці. 4. Застосування електролізу в медицині |
α-І - α-ІІІ
α-ІІ- α-ІІІ
α-І- α-ІІ
α-ІІ
α-ІІІ
α-ІІІ
|
Фронтально усно (інформація студента)
Фронтально усно
Фронтально усно
Фронтально усно (запитання кожному студенту)
запитання проблемного характеру
(інформація студента) |
Слайди (демонстрація з використанням мультимедійного обладнання)
Слайди (демонстрація з використанням мультимедійного обладнання)
Слайди (демонстрація з використанням мультимедійного обладнання)
Слайди (демонстрація з використанням мультимедійного обладнання)
Слайди (демонстрація з використанням мультимедійного обладнання)
Інформаційне повідомлення |
40хв
|
|
ІІІ. |
Заключний етап:
Програмне забезпечення
7. Домашнє завдання. |
α-ІІ α-ІІІ α-ІІІ
|
Усний, ситуаційна задача Інтерактив-ний експеримент Оцінка і рецензуван-ня відповідей студентів |
Слайди (демонстрація з використанням мультимедійного обладнання)
Л.С.Жданов Г.Л.Жданов Фізика для середніх спеціальних навчальних закладів – Київ: «Вища школа», 1985, §__ ст.— ____ А.Ф.Шевченко Основи медичної і біологічної фізики: підручник. –– Київ: Медицина, 2008, § 76-80, ст. — 242-251
|
15хв
10хв
3 хв
2 хв |
VІ. ЛІТЕРАТУРА ДЛЯ ПІДГОТОВКИ:
а) Основна:
- Л.С.Жданов, Г.Л.Жданов Фізика для середніх спеціальних навчальних закладів – Київ: «Вища школа», 1985, § ___ ст.—
б) Додаткова:
- Шевченко А.Ф. Основи медичної і біологічної фізики: підручник. –– Київ: Медицина, 2008, § § 76-80. ст. 242-251.
Матеріали підготовчого етапу
Контроль знань
«Електричний струм»
І варіант
1. Виберіть правильну відповідь.
1.1. Що являє собою електричний струм у металах?
А) Рух вільних електронів; Б) Впорядкований рух вільних електронів;
В) рух вільних іонів; Г) Впорядкований рух вільних іонів.
1.2. Що прийнято за одиницю вимірювання напруги?
А) Кулон; Б) Вольт; В) Ампер; Г) Ньютон.
1.3. За якою формулою можна визначити силу струму?
А) I = A/q; Б) I= q/t; В) I = q/v; Г) I = U/t.
1.4. Якщо довжину провідника зменшити, то опір його…
А) збільшиться; Б) зменшиться; В) не зміниться; Г) правильної відповіді немає.
1.5. Потужність струму визначається за формулою…
А) Р = U/R; Б) P = UI; В) P = IUt; Г) P = IR.
1.6. Два мідних проводи мають однаковий поперечний переріз. Опір першого більший. Який з проводів довший?
А) Перший; Б) Другий; В) Однаковий; Г) правильної відповіді немає.
2. Розв’яжіть задачі.
2.1. Визначте напругу на автомобільній лампочці, якщо під час проходження крізь неї 100Кл електрики було виконано роботу 1,2кДж.
2.2. Визначте опір провідника, в якому сила струму дорівнює 30А при напрузі 60В.
2.3. Обчисліть потужність електричного струму, якщо ним за 10хв виконано роботу 15000Дж.
2.4. Опір першого резистора 1Ом, другого – 2Ом, третього – 1 Ом. Сила струму в третьому резисторі 2А. Яка напруга між точками А та В?

ІІ варіант
1. Виберіть правильну відповідь.
1.1. Яка частинка має найменший електричний заряд?
А) Молекула; Б) Атом; В) Електрон; Г) Нейтрон.
1.2. Що прийнято за одиницю вимірювання сили струму?
А) Кулон; Б) Вольт; В) Ампер; Г) Ньютон.
1.3. За якою формулою можна визначити напругу?
А) U = A/q; Б) U= q/t; В) U = q/v; Г) U = It.
1.4. Якщо поперечний переріз провідника збільшити, то опір його…
А) збільшиться; Б) зменшиться; В) не зміниться;
Г) правильної відповіді немає.
1.5. Робота струму визначається за формулою…
А) А = U/R; Б) А = UI; В) А = IUt; Г) А = IR.
1.6. Розміри мідного і стального провідників однакові. Опір якого провідника більший?
А) Стального; Б) Мідного; В) Однаковий;
Г) правильної відповіді немає.
2. Розв’яжіть задачі.
2.1. Під час проходження 5Кл електрики провідником виконується робота 550Дж. Визначити напругу на кінцях провідника.
2.2. Визначте напругу на кінцях резистора опором 20Ом, якщо сила струму в ньому 0,4А.
2.3. Напруга на кінцях провідника 5В. Визначте, яку роботу виконує в цьому провіднику електричний струм силою 0,2А протягом 5хв.
2.4. Опір першого резистора 2Ом, другого – 2Ом, третього – 3 Ом. Напруга між точками А та В дорівнює 20В. Яка сила струму в третьому резисторі?

І. Мотивація теми
Мотивація навчальної діяльності студентів
З електропровідністю розчинів солей у воді пов'язано дуже багато чого в нашому житті. З першого удару серця («живе» електрику в тілі людини, на 80% складається з води) до автомобілів на вулиці, плеєрів і мобільних телефонів (невід'ємною частиною цих пристроїв є «батарейки»- електрохімічні батареї та різні акумулятори - від свинцево-кислотних в автомобілях до літій-полімерних в найдорожчих мобільних телефонах). В величезних, киплячих і паруючих отруйними парами чанах з розплавленого при величезній температурі бокситу електролізом отримують алюміній -. "крилатий" метал для літаків і банок для "фанти" Все навколо -. від хромованої решітки радіатора іномарки до посрібленою сережки у вусі коли-небудь стикалися з розчином або розплавом солей, а отже, з електричним струмом в рідинах. Не даремно це явище вивчає ціла наука - .. електрохімія, але нас зараз більше цікавлять фізичні основи цього явища.
Викладач фізики: (На дошці написана тема уроку, схеми, малюнки механізму розчинення кристала хлориду натрію) (Викладач пояснює тему студентам)
Тема нашого сьогоднішнього заняття «Електричний струм в рідинах».
Тому метою сьогоднішньої лекції є:
Знати:
- визначення сили струму; формульне визначення;
- знати умови проходження струму в різних середовищах, провідність рідин і розчинів, ознайомити студентів з провідністю електролітів, вивести закон Фарадея. Забезпечити засвоєння і закріплення нового матеріалу, розширити знання студентів, продовжити формування поняття «електролізу», формування поняття єдності теорії і практики. Забезпечити повторення і закріплення матеріалу.
Вміти:
- записувати окисно-відновні реакції;
- розв'язувати ситуаційні задачі та проблемні задачі щодо даної теми.
Матеріали основного етапу
План
1. Електролітична дисоціація.
2. Закони Фарадея.
3. Застосування електролізу на практиці.
4. Застосування електролізу в медицині
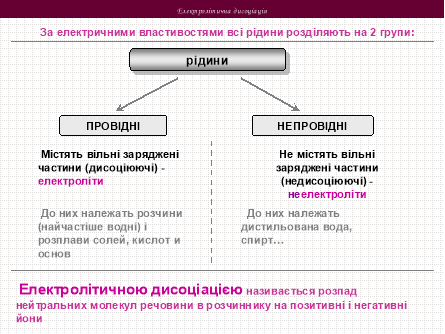
1. Електролітична дисоціація
Викладач
З провідністю електричного струму в розчинах ви вже трохи знайомі з курсу хімії, і тому зараз ми повторимо цей матеріал.
Ми з вами згадаємо теорію електролітичної дисоціації і спробуємо провести єдину лінію в цьому процесі з точки зору хімії і фізики. Для цього проведемо лабораторний дослід: (викладач показує дослід, і на всі поставлені питання відповідають студенти).
Візьмемо три склянки:
1) Кристалічна сіль хлориду натрію
2) Дистильована вода
3) Розчин хлориду натрію
Опустимо електроди в кожен стакан, що ми спостерігаємо?
1) лампочка - не засвітилася
2) лампочка - не засвітилася
3) лампочка - засвітилася
Чому?
Поясніть з точки зору фізики за схемами.
Викладач
Давайте розглянемо з вами схеми трьох дослідів. Чому в перших двох випадках лампочка не засвітилася, а в третьому випадку - засвітилася?
руйнується з утворенням гідратованих іонів. Вони і є провідниками струму. Розпад електроліту на йони при розчиненні у воді називається ЕЛД.
Викладач
Отже, ми з'ясували, як з'явилися йони.
Утворені йони беруть участь в хаотичному тепловому русі. Якщо йони різних знаків зближуються на досить близьку відстань, то вони можуть утворити молекулу.
Процес «рекомбінації» –– це зворотний процес «дисоціації».
Дисоціація визначається ступенем дисоціації, відношенням числа продисоційованих молекул на йони до загальної кількості молекул. Якщо кількість продисоційованих молекул за одиницю часу дорівнює кількості рекомбінованих за цей же проміжок часу, то наступає динамічна рівновага.

 Розглянемо дві схеми:
Розглянемо дві схеми:
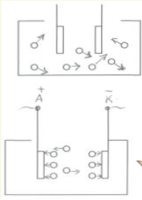

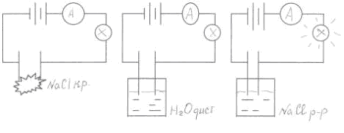
Зробимо висновок:
Дистильована вода і кристалічна сіль є діелектриками, а розчин хлориду натрію –– провідник. Звідки взялися носії зарядів? З цим питанням нам допоможе розібратися хімія.
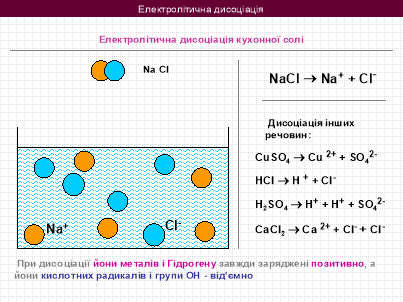
Викладач фізики
Окисно-відновний процес, що протікає на електродах при пропущенні електричного струму через розчин або розплав називається - електролізом. Що ж таке електроліз з точки зору хімії і як протікають процеси на електродах, ви розглянете з викладачем хімії.
Викладач:
Розглянемо електроліз розплаву хлориду міді і розчину нітрату міді (до дошки викликається два студенти, які записують схеми електролізу і складають рівняння реакцій, що протікають на електродах, а потім пояснюють.)
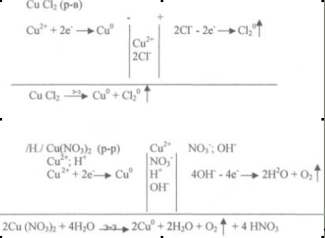
2. Закони Фарадея
Викладач:
Розглянувши теорію дисоціації і електролізу з хімічної точки зору, ми можемо використовувати дані процеси для розрахунків маси речовини.

Розглянемо закон електролізу. Знаючи механізм електропровідності електролітів, можна визначити масу виділився речовини при електролізі:
m = mi ˣ N = mi ˣ Q/qi → m = k ˣ Q = k ˣ I ˣ t
N = Q/qi; Q = I ˣ t; k = mi/qi
mi = const; qi = const/
Маса речовини, що виділяється на електроді, прямо пропорційна загальному заряду, який пройшов через електроліт.
Закон Фарадея 1832 рік.
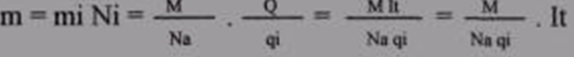
k = M/NA ˣ qi; k = const; m = k ˣ I ˣ t

Використовуючи закон Фарадея, можна визначити заряд електрона.
Застосування електролізу: (заздалегідь дати кільком до студентів повідомлення щодо застосування електролізу)
3. Застосування електролізу на практиці
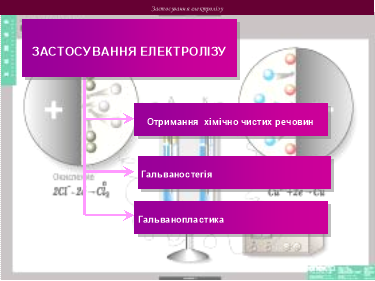
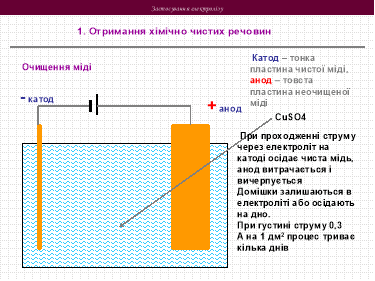
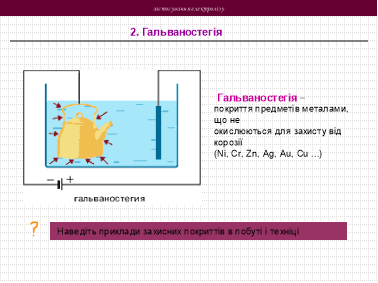


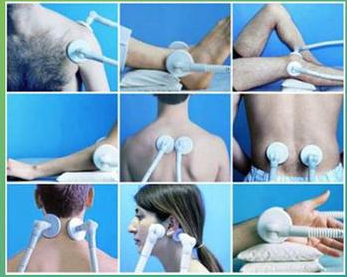
Застосування електролізу в медицині
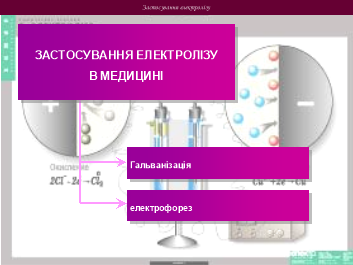
За своїми електричними властивостями м’які тканини людського організму –– внутрішні органи, мозок , нервово-м’язові тканини та біологічні рідини – належать до групи провідників. Усередині їх є велика кількість йонів натрію, калію, кальцію та інших хімічних елементів. Нещодавно виявили, що, крім йонів, у м’яких тканинах є незначна кількість (порівняно з йонами) є вільних електронів та електрично заряджених білкових молекул –– „живих” йонів. Речовина кісток (без надкісниці), суха шкіра жирові та сполучні тканини є діелектриками: у них відсутні вільні носії електричного заряду.
 При накладанні електронів на дві оголені ділянки тіла у тканинах, які знаходяться між електродами, виникає електричне поле. Йони та електрони, що містяться в них, приходять в упорядкований рух, і в тканинах виникає електричний струм. Електричні заряди переміщуються в основному в тих тканинах, які мають найменший питомий опір – у середині крові, лімфи та нервово-м’язових тканин. При цьому шляхи, якими переміщуються заряди, досить складні є часто віддалені від тих ділянок, де накладені електроди.
При накладанні електронів на дві оголені ділянки тіла у тканинах, які знаходяться між електродами, виникає електричне поле. Йони та електрони, що містяться в них, приходять в упорядкований рух, і в тканинах виникає електричний струм. Електричні заряди переміщуються в основному в тих тканинах, які мають найменший питомий опір – у середині крові, лімфи та нервово-м’язових тканин. При цьому шляхи, якими переміщуються заряди, досить складні є часто віддалені від тих ділянок, де накладені електроди.
Первинна дія постійного електричного струму на тканини організму зумовлюється рухом йонів усередині їх. Унаслідок упорядкованого руху йонів змінюється концентрація одно- й двовалентних йонів та їх співвідношення. Для нормального функціонування окремих тканин вирішальну роль відіграє співвідношення між концентраціями n1/n2 одновалентних йонів K і Na та двовалентних йонів Са і Mg.
Якщо n1/n2 >1, тобто концентрація одновалентних йонів більша від концентрації двовалентних, то інтенсивність фізіологічних процесів у клітинах зростає. І навпаки, якщо n1/n2 <1, тобто концентрація двовалентних йонів перевищує концентрацію одновалентних, то інтенсивність обмінних процесів між клітинами й зовнішнім середовищем – лімфою – істотно зменшується.
Зміна концентрації йонів та їхнє співвідношення призводить до розширення кровоносних та лімфатичних судин, внаслідок чого збільшується швидкість течії крові і лімфи. Під електродами виникає гіперемія шкіри, активізується кровообіг і течія лімфи, чим і зумовлюється лікувальна дія електричного струму.
Крім того, безпосередньо під електродами накладеними на тіло (здебільшого під катодом), відбувається поляризація дипольних молекул білків, амінокислот та полі пептидів. Ці процеси зумовлюють відчуття легкого поколювання й печіння. При підвищенні сили струму з’являється біль.
Фізіологічна дія електричного струму залежить від густини струму й часу його проходження. При накладанні на тіло хворого двох електродів з різною площею гіперемія шкіри завжди виражена значно більше під тим електродом, площа якого менша. Сила струму, що проходить через обидва електроди, однакова, але густина струму (j=I/S) різна: вона більша там, де площа електрода S менша.
Якщо сила струму перевищує 50мА, то такий струм стає небезпечним для життя людини: виникає електротравма. Вона зумовлюється тепловою дією струму. У тканинах організму, відповідно до закону Джоуля-Ленца, виділяється велика кількість тепла, що спричиняє глибокі опіки, руйнування та омертвіння тканин. Ступінь ураження при електротравмі залежить від сили струму, яка визначається напругою електричного поля та електричним опором тіла людини. Найтяжчі ураження виникають від електричного струму напругою 300В і більше. Крім глибоких опіків при електротравмі виникають тяжкі порушення ЦНС та органів дихання, які супроводжуються судорогами та непритомністю, а в тяжких випадках виникає шок. У цьому разі смерть може бути блискавичною.
При проходженні постійного струму у тканинах організму під час гальванізації змінюється загальна концентрація йонів і співвідношення між одновалентними і двовалентними йонами на тій ділянці тіла, де накладені електроди. Це спричинює активізацію обмінних процесів у тканинах організму, чим і зумовлюється терапевтична дія постійного струму під час гальванізації.
Одночасно з цим на електродах виникає явище електролізу: йони натрію, калію, магнію, кальцію, дійшовши до електродів, нейтралізуються і осідають на них. Продукти електролізу накопичуються під електродами на поверхні шкіри й збільшують її електричний опір. Відповідно до закону Джоуля-Ленца, найбільше тепла виділяється на тих ділянках кола, де електричний опір найбільший. Ось чому під металевими електродами, що накладені без гідрофільних прокладок, неминуче виникають тяжкі опіки. Прокладка, змочена фізіологічним розчином або дистильованою водою, поглинає продукти електролізу й таким чином усуває можливість виникнення опіків.
Одним з різновидів гальванізації є електрофорез (іонофорез) –– електролітичне введення лікарських речовин в організм хворого крізь шкіру або слизові оболонки. У цьому випадку гідрофільні прокладки змочуються розчином ліків. Унаслідок електролітичної дисоціації лікарська речовина розпадається на йони. Під дією електричного поля, що існує між електродами, йони приходять в упорядкований рух і долаючи електричний опір епідермісу шкіри, проникають усередину тканин організму. Завдяки ємнісним властивостям тканин під шкірою утворюється скупчення(депо) йонів лікарської речовини, які досить повільно активізують обмінні процеси в тканинах організму.
За допомогою електрофорезу в організм уводяться як позитивні (натрій, кальцій,кодеїн) так і негативні (бром, йод, кофеїн).
Сила струму під час гальванізації й електрофорезу коливається в межах 2-50мА залежно від характеру захворювання й індивідуальних особливостей хворого.
Явище електролізу застосовується не лише для лікування хворих, а й для встановлення діагнозу хвороби. За його допомогою розділяють білкові фракції сироватки крові при лабораторно-клінічних дослідженнях.
Електрофорез – метод, при якому постійним струмом через шкіру або слизові оболонки в організм вводять лікарські речовини.
Електрофорез лікарських речовин в лікувальну практику увійшов як емпіричний метод. Внаслідок цього майже до кінця ХІХ століття речовини, що вводилися наносились на позитивний полюс, так як вважали, що вони переносяться в шкіру у виді молекул за рахунок катафорезу, тобто переміщення рідини від анода до катода при проходженні постійного струму. Лише через 1000 років після першої спроби (В. Россі, 1802) використання постійного струму для введення ліків в організм почалась наукова розробка теоретичних основ методу.
Введення лікарських речовин в організм з допомогою електрофорезу базується в принципі на тих закономірностях, що і проходження постійного струму через розчини електролітів.
Розвиток наукових основ електрофорезу нерозривно зв’язано з теорією електролітичні дисоціації (йонною теорією).
Розвиток наукових основ електрофорезу нерозривно зв’язано з теорією електролітичні дисоціації розробленою в 1887 р. Сванне Арреніцьяме. Основні методи цієї теорії полягають в наступному:
- Молекули електролітів при розчиненні у воді в більшій або меншій мірі розпадаються на позитивні і від’ємні йони.
Сума позитивних зарядів рівна сумі від’ємних зарядів йонів, в наслідок цього весь розчин в цілому залишається електрично нейтральний. Розлад електролітів під дією розчинника на йони дістав назву електролітичної дисоціації.
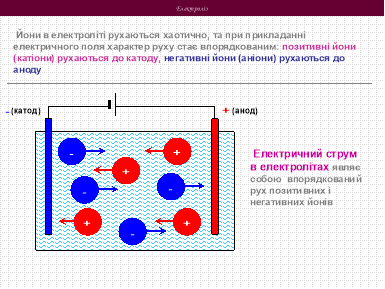
- При пропусканні через розчин електричного струму йони починають направлено переміщуватись: позитивно заряджені йони направляються до від’ємно зарядженого електроду (катоду), а від’ємні йони – до позитивного електроду (аноду). Йони, які переміщуються до катода, називаються катіонами, а рухаючи до анода – аніонами.
Досягнувши електродів, йони можуть розрядитись і перетворитись в нейтральні атоми або групи атомів. Останні можуть підпорядкуватись наступним змінам і вступати в хімічні реакції.
- Йони, відмінних від нейтральних атомів або нейтральних атомів або молекул наявністю електричного струму, володіють великою хімічною активністю.
Теорія електролітичної дисоціації не тільки допомогла розробці фізико-хімічних основ введення лікарських речовин з допомогою постійного струму, але і внесла необхідні корективи в техніку електрофорезу з лікарськими речовинами. Стало ясно, що вводити в організм методом електрофорезу можна ліки, які належать до електролітів і розпадаються в розчинах на йони. При цьому важливу роль відіграє правильне розміщення медикаменту на електродах: розчином потрібно змочувати прокладку електрода, маючи однойменний з відданим медикаментозним йоном заряд; тільки таке розміщення медикаментозного розчину забезпечить поступовий рух речовини і проникнення його в тіло, яке під час процедури включається в ланцюг струму. Важливо також, що йони речовин володіють більшою активністю, чим їх молекулярні аналоги. Це (позволяє) дозволяє очікувати проявлення деяких особливостей фармакодинаміки ліків при електрофорезі порівняно з ін’єкційними методами їх введення.
Особливо важливим в теорії Арреніуса являється утвердження, що розпад речовин на йони проходять не під впливом струму, як думали раніше, а внаслідок його взаємодії з розчинником. Найкращим іонізуючим розчинником являється вода, що визначає перевагу її використання при приготовленні робочих розчинів для медикаментозного електрофорезу.
Хімічні процеси, які проходять при пропусканні електричного струму через розчин електроліту, називається електролізом. Одним із проявів електролізу являється олужнення катодних розчинів і накопичення на аноді йонів вуглецю, обумовлюючи кислу реакцію. При електротерапії електроліз – явно небажаний процес, якого слід уникати.
При електрофорезі через шкіру шляхи проникнення ліків в організм визначаються, з одної сторони, топографією розподілу силових ліній струму, а з другої фізико-хімічними параметрами шкірних пар.
Через шкіру, як відомо, струм проходить не суцільним потоком, а головним чином через протоки шкірних залоз. Із них найкращим провідником Являється вивідні протоки потових залоз. Невелика частина струму проходить через жирові залози і міжклітинні щілини епідермісу. Вказане утворення, очевидно, і можуть служити шляхами проникнення ліків не тільки при електрофорезі, але і при аплікаціях лікарських речовин. На відміну від аплікацій введення речовини з допомогою струму супроводжується і міжклітинним транспортом.
Основними шляхами проникнення йонів в організм при електрофорезі являється вивідні протоки потових і жирових залоз. Кількість введеної в організм речовини збільшувалась паралельно росту числа активних залоз в шкірі. Найбільша ймовірність проникливості шкіри залежить від числа потових залоз. Це дає можливість зробити висновок, що основним місцем введення ліків при електрофорезі служать вивідні протоки потових залоз. При медикаментозному електрофорезі речовини, що вводяться проникають на невелику глибину. Найбільшого розповсюдження дістала точка зору, що лікарські речовини за рахунок електронного руху під час процедури можуть досягати підшкірно жирового шару. Є відомості і про більш глибоким проникненням речовин під впливом постійного струму. Так, згідно дослідам М.А. Борсукова (1971), сульфаніламіди і антибіотики не тільки доходять до підшкірної клітковини, але і виявляються в м’язах і глибше. При цьому концентрація лікарських речовин в підшкірній клітковині нерідко навіть нижча, чим глибше розміщених м’язах. При повторних процедурах електрофорезу концентрація речовини, що вводиться в глибоких шарах шкіри збільшується більше, ніж в поверхових.
З шкіри і підшкірно-жирової клітковини поступивши під час процедури ліки поступово дифундують в лімфатичні і кровоносні судини, розносячись до всіх органів ліки. При необхідності глибину проникнення ліків можна підвищити, попередньо діючи ультразвуком, індуктотермією і мікрохвилями.
Лікарські речовини можуть находитися в шкірі від 1-2 днів (гепарин, антибіотики, новокаїн та ін.) до 15-20 днів (адреналін, цинк). Із шкірного депо лікарські речовини постійно і неперервно поступають в тканини. Утворення шкірного депо – одна із відмінних особливостей медикаментозного електрофорезу, який пролонгує дію лікарських речовин.
Другою особливістю методу являється те, що з його допомогою можна в необхідних частинах тіла (в області патологічного процесу) створювати високу концентрацію лікарства, не насичуючи ним організму.
З допомогою електрофорезу в шкірі і в тканинах можна створити концентрацію речовин, значно перевищуючи її при внутрішньому введенні тої ж дози препарату.
На відміну від фармакотерапевтичних методів з допомогою електрофорезу лікарських речовин можуть бути підведені до патологічного вогнища, в районі якого порушена мікроциркуляція.
Важливою особливістю методу медикаментозного електрофорезу являється те, що ліки введені таким чином значно рідше викликають негативні реакції, ніж перорального і парентерального введення.
По-перше, введення невеликих доз лікарських речовин і більше повільним поступленням їх в крові внутрішні органи, що природно, гальмується проявлення загальної дії препарату.
По-друге, електрофорезом в організм лікарські речовини вводяться в найбільш чистім вигляді (йоннім), дякуючи цьому, виключається побічна дія домішок.
По-третє, постійний струм, благополучно діє на реактивні властивості і імунобіологічну активність організму, зменшуючи побічну дію ліків.
Слід вказати і на безболісність методу електрофорезу, дякуючи якому він користується популярністю у хворих, особливо у дітей.
Медикаментозних електрофорез – особливий електрофармакологічний метод, в основі якого лежить комплексна дія на організм постійного струму і введених з його допомогою ліків.
Терапевтичний ефект медикаментозного електрофорезу залежить від правильності техніки і методики його використання.
Для електрофорезу використовується велика кількість ліків. Які відносяться до класів хімічних з’єднань і фармтерапевтичних груп. Для електрофорезу можна використовувати ті лікарські речовини, які при розчиненні дисоціюють на йони. Так, йони всіх металів мають позитивний заряд, тому при електрофорезі повинні вводитися з анода. Позитивний заряд несуть в розчині також алкалоїди, місцево анестезуючі речовини. Багато антибіотиків, сульфаніламіди.
Йони всіх неметалів (йод, хлор, бром та ін.) при дисоціації в розчині мають негативний заряд і в організм повинні вводитись з катоду. Негативний заряд мають в розчині також кислотні залишки.
Для електрофорезу в медичній практиці використовуються численні лікарські речовини, різного походження, фізико-хімічними властивостями і фармакологічною активністю.
Для електрофорезу природних препаратів використовують нафту, мумійо, нашивну грязь і препарати з неї, а також мінеральні води.
Матеріали заключного етапу
Для закріплення теми проведемо лабораторний досвід:
Завдання для учня:
Провести електроліз розчину сульфату міді, визначити масу міді, що виділилася на катоді, за проміжок часу 15 хв. Завдання: розрахувати масу використовуючи формули, розрахувати заряд електрона міді, що виділилася на катоді.

Мета: спостерігати явище електролізу; визначити умови його перебігу; дослідити основні закономірності явища; перевірити справедливість закону Фарадея для електролізу.
Обладнання: джерело струму, амперметр, реостат, вимикач, лампочка на підставці, скляна посудина з розчином мідного купоросу (або з іншим електролітом); мідні або вугільні електроди, з'єднувальні провідники, секундомір, терези, набір важків, серветка.
Правила техніки безпеки
Під час виконання роботи акуратно розташуйте прилади на столі, звільнивши його від зайвих речей. Обережно працюйте з амперметром і реостатом. Пам'ятайте, як їх підключають у коло електричного струму. Не торкайтеся руками оголених кінців провідників. Замикайте коло тільки після перевірки його вчителем. Не намагайтеся скуштувати розчин на смак: він небезпечний для здоров'я!
Хід роботи
- Виберіть один із двох електродів і позначте його, наприклад, шматочком пластиліну. Це буде ваш катод.
- За допомогою терезів визначте його масу якомога точніше.
- Зберіть коло за схемою (див. рисунок), послідовно з'єднавши всі прилади між собою. Пам'ятайте, що катод треба з'єднувати з негативним полюсом джерела струму!
- Замкніть коло та одночасно ввімкніть секундомір.
- Спостерігайте процес електролізу протягом 20 хвилин; при цьому слідкуйте за показаннями амперметра та регулюйте силу струму за допомогою реостата так, щоб її значення було постійним впродовж усього досліду.
- По закінченні процесу вимкніть струм і вийміть катод із розчину, одночасно вимкніть секундомір і запишіть його показання до таблиці.
- Обережно покладіть катод на серветку і дайте трохи підсохнути.
- Спостерігайте появу на катоді шару міді, який має червоний відтінок.
- За допомогою терезів визначте масу катода після електролізу.
- Знайдіть у підручнику або довіднику табличне значення електрохімічного еквіваленту міді (або іншого металу, сіль якого входить до складу електроліту).
- Запишіть отримані дані у таблицю.
- Визначте масу міді за законом Фарадея для електролізу.
- Порівняйте значення маси, отримані за результатами обчислень та результатами досліду.
- Зробіть висновки щодо закономірностей перебігу процесу електролізу та справедливості закону Фарадея для обчислення маси речовини, яка виділилася на катоді.
- Запишіть висновки.
|
Маса катода |
m=m2-m1, кг |
І, А |
t, с |
k, кг/Кл |
|
|
До електролізу m1, кг |
Після електролізу m2, кг |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|


Викладач (Підводить підсумки заняття)
Я сподіваюся, що, використовуючи знання хімії, ми змогли ширше і глибше зрозуміти процес провідності струму в рідинах.
Рішення задач (усно):
1) Чому не можна доторкатися до неізольованим електричним проводам голими руками?
(Волога на руках завжди містить розчин різних солей і є електролітом тому створює хороший контакт між проводами і шкірою).
2) Чому для гальванічного покриття виробу частіше використовують нікель і хром?
(Велика хімічна стійкість, механічна міцність і після полірування дають красивий блиск).
3) Чому дроти освітлювальної мережі обов'язково мають гумову оболонку, а дроти, призначені для сирих приміщень крім того, ще просмолені зовні?
(Так як волога на дротах являє електроліт і є провідником, а це може привести до короткого замикання та пожежі).
Пропоную роботу в парах:
Студенти роблять самостійно таблицю: «Подібності і відмінності в електропровідності металів і рідин»
(Один студент описує метали, інший - рідини)
Виставлення і коментування оцінок студентів.
Рефлексія.
Поверніться до мети уроку і дайте відповідь на питання:
• Чи досягли ми цілей, поставлених на початку своєї роботи?
• Що сподобалося на уроці?
• Що не сподобалося і ви хотіли б змінити?
• Яким ви уявляєте свою участь на уроці?
(Додаток Презентація «Електричний струм у рідинах")
Повідомлення домашнього завдання
Література:
- Л.С.Жданов, Г.Л.Жданов Фізика для середніх спеціальних
навчальних закладів – Київ: «Вища школа», 1985, § 19.
- Вивчити § 19, повторити § 16, § 17;
- Завдання обов'язкові: Впр.12 № 2, № 3 (ст 87);
- Завдання за бажанням: підготувати тести по темі: «Електричний струм у різних середовищах».
- А.Ф.Шевченко Основи медичної і біологічної фізики: підручник. –– Київ: Медицина, 2008, § 76-80, ст. — 242-251.


про публікацію авторської розробки
Додати розробку
