МЕТОДИЧНА РОЗРОБКА відкритого заняття на тему: «Основи молекулярно – кінетичної теорії газів»
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ВІДОКРЕМЛЕНИЙ СТРУКТУРНИЙ ПІДРОЗДІЛ НАЦІОНАЛЬНОГО
АВІАЦІЙНОГО УНІВЕРСИТЕТУ СЛОВ’ЯНСЬКИЙ КОЛЕДЖ НАЦІОНАЛЬНОГО АВІАЦІЙНОГО УНІВЕРСИТЕТУ
МЕТОДИЧНА РОЗРОБКА відкритого заняття на тему:
«Основи молекулярно – кінетичної теорії газів»
з дисципліни «Фізика»
(загальноосвітня підготовка)
2015
Методична розробка з дисципліни «Фізика». Підготувала Балабаєва О.О. - викладач Відокремленого структурного підрозділу Національного авіаційного університету Слов’янського коледжу Національного авіаційного університету – 2015.
Викладено методику проведення лекції з елементами бесіди та використанням ТЗН, спрямованої на набуття теоретичних знань з теми «Основи молекулярнокінетичної теорії газів»
Для викладачів фізики вищих навчальних закладів І-ІІ рівнів акредитації, які здійснюють підготовку молодших спеціалістів на основі базової загальної середньої освіти
Рецензенти:
1. О.І. Чайченко - голова циклової комісії фундаментальних дисциплін Відокремленого структурного підрозділу Національного авіаційного університету Слов’янського коледжу Національного авіаційного університету, спеціаліст вищої категорії.
2. О.В. Котляров – голова циклової методичної комісії природничо-математичних дисциплін, викладач фізики Слов’янського хіміко-механічного технікуму, спеціаліст вищої категорії.
Розглянуто та схвалено на засіданні циклової комісії фундаментальних дисциплін (протокол № 2 від 17 вересня 2015 р.)
ЗМІСТ
С.
Передмова 4
1. План заняття 5 2. Хід заняття 6
3. План лекції 7
3.1 Основні положення молекулярно-кінетичної теорії та їх дослідне
обґрунтування. 7
3.2 Маса і розміри молекул. 11
3.3 Ідеальний газ. 12
3.4 Основне рівняння молекулярно-кінетичної теорії газів. 12
4. Закріплення знань студентів. 14
Висновки 16
Додатки.
17
Передмова
Фізика - одна з фундаментальних природничих наук, знання якої необхідне для плідної творчої діяльності сучасного фахівця будь-якої спеціальності. Вивчення фізики в курсі загальноосвітніх дисциплін має на меті дві основні задачі:
1. Загальнонаукова й розвиваюча, що полягає у формуванні правильного світогляду курсанта й студента коледжу й у розвитку у нього наукового матеріалістичного мислення.
2. Конкретно-практична, щоб одержані знання студент міг застосовувати при експлуатації, обслуговуванні чи ремонті комп’ютерної техніки й автоматизованого обладнання, при використанні нових технологій, при розробці методів підвищення надійності й працездатності сучасної техніки.
Методична розробка відкритого заняття з дисципліни «Фізика» присвячена темі «Основи молекулярно-кінетичної теорії газів» та пропонує варіант викладення матеріалу у формі лекції з елементами бесіди та використанням ТЗН. Вивчення теми забезпечує формування наукового світогляду, розвиває в студентів здібність до аналізу, виховує позитивну мотивації до вивчення фізики, сприяє формуванню ініціативності, впевненості у своїх силах.
Зазначена тема є складовою при вивченні розділу «Молекулярна фізика і термодинаміка». На її вивчення відведено загалом 5 годин, з яких 1 година - самостійне вивчення. Задачі, які вирішуються при розгляді теми:
1.Опанування засобами й методами розв'язання конкретних завдань з поняттям «молекулярна-кінетична теорія», яке дуже поширено у фахових дисциплінах.
2.Створення й теоретичне обґрунтування фізичних методів дослідження об'єктів.
3.Ознайомлення з експериментальною методологією відтворення результату досліду та його пояснення, формування навичок проведення експерименту та аналізу отриманих результатів.
Молекулярно-кінетична теорія є однією з фундаментальних наукових теорій, що затверджує найдавнішу наукову ідею - ідею про дискретність речовини. Вона служить основою для пояснення багатьох фізичних, хімічних, біологічних явищ, а без неї не може обійтися жодна з природничих наук. Таким чином, вивчаючи вказану тему, викладач має реалізувати такі цілі:
Навчальна: З метою формування наукового світогляду підкреслити реальність та об’єктивність існування основних положень МКТ, вказуючи на експериментальні факти, які доводять ці положення. Закріпити у студентів знання з молекулярнокінетичної теорії, уміння давати визначення основних фізичних величин які характеризують молекулярну структуру речовини, конкретизувати положення про існування, розміри та кількість молекул. Сформувати поняття ідеального газу та основного рівняння МКТ газів. Навчити студентів висувати гіпотези та робити висновки.
Виховна: Через проблемний метод навчання розкрити науковий шлях пізнання через доказ гіпотези, сприяти переходу знань у переконання. За допомогою експерименту прищепити навики працьовитості, дбайливого ставлення до приладів, до природи; естетичні якості.
Розвиваюча: На прикладі явища дифузії та броунівського руху продовжити розвиток умінь спостерігати, порівнювати явища, що вивчаються, виявляти причинно-наслідкові зв'язки, робити відповідні висновки, розвивати логічне мислення, діалектико – матеріалістичний світогляд.
ПЛАН ЗАНЯТТЯ
Тема заняття: Основи молекулярно-кінетичної теорії газів.
Мета заняття:
Методична – удосконалення методики проведення лекції з елементами бесіди та використанням ТЗН, демонстрації дослідів і слайдів.
Навчальна – з метою формування наукового світогляду підкреслити реальність та об’єктивність існування основних положень МКТ, вказуючи на експериментальні факти, які доводять ці положення. Закріпити у студентів знання з молекулярнокінетичної теорії, уміння давати визначення основних фізичних величин які характеризують молекулярну структуру речовини, конкретизувати положення про існування, розміри та кількість молекул. Сформувати поняття ідеального газу та основного рівняння МКТ газів. Навчити студентів висувати гіпотези та робити висновки.
Виховна – через проблемний метод навчання розкрити науковий шлях пізнання через доказ гіпотези, сприяти переходу знань у переконання. За допомогою експерименту прищепити навики працьовитості, дбайливого ставлення до приладів, до природи; естетичні якості.
Розвиваюча – на прикладі явища дифузії та броунівського руху продовжити розвиток умінь спостерігати, порівнювати явища, що вивчаються, виявляти причинно-наслідкові зв'язки, робити відповідні висновки, розвивати логічне мислення, діалектико – матеріалістичний світогляд.
Вид заняття: лекція
Форма проведення заняття: викладення нового матеріалу з елементами бесіди та використанням ТЗН, демонстрації дослідів і слайдів. Міжпредметні зв'язку:
Забезпечуючі – математика, хімія.
Методичне забезпечення: опорні конспекти, слайди.
Обладнання: скляний посуд, горох, манна крупа, мікроскоп, металеві циліндри, штатив, вантаж.
Література:
Обов'язкова:
1. Гончаренко С.У. Фізика: Пробний навчальний посібник для шкіл ІІІ ступеня, гімназії і класів гуманітарного профілю. 10 кл.- К.: Освіта, 1995, с. 5-42.
2. Зачек І.В. Курс фізики – Львів: Видавництво Бескид Біт. 2002, с. 27-35. 3. Бушок Г.Ф., Левандовський В.В., Півень Г.Ф. Курс фізики – К: Либідь. 2001, с. 32-41.
Додаткова:
1. Кудрявцев П.С. История физики. 2 том -М.: Просвещение, 1956
2. Пушкарьов М.А., Чорний Є.П. Книга для читання з фізики. Частина ІІ. –Київ: Видавництво «Радянська школа», 1959
Технічні засоби навчання: мультимедійний проектор.
ХІД ЗАНЯТТЯ:
1. Організаційний момент 1 хв.
Вітання студентів. Викладач приймає рапорт чергового студента, перевіряє наявність студентів на занятті, заповнює класний журнал.
2. Ознайомлення студентів з темою та навчальними цілями заняття 1 хв. Тема заняття: Основи молекулярно-кінетичної теорії газів. (див. додаток Б слайд 1)
Мета заняття: з метою формування наукового світогляду підкреслити реальність та об’єктивність існування основних положень МКТ, вказуючи на експериментальні факти, які доводять ці положення. Закріпити у студентів знання з молекулярно-кінетичної теорії, уміння давати визначення основних фізичних величин які характеризують молекулярну структуру речовини, конкретизувати положення про існування, розміри та кількість молекул. Сформувати поняття ідеального газу та основного рівняння МКТ газів. Навчити студентів висувати гіпотези та робити висновки.
3. Мотивація навчання 2 хв.
Досягненнями молекулярної фізики широко користуються інші науки – хімія, біологія тощо. Наприклад, завдяки процесу дифузії молекули кисню проникають крізь мембрани пухирців легенів у кровоносні судини, і так само виходять із крові молекули вуглекислого газу, які потім видихаються. Дифузні процеси відіграють важливу роль в обміні речовин між організмом і середовищем, між його різними частинами, в живленні й диханні живих істот. Якщо хоч на мить зупиниться тепловий рух частинок, усе живе задихнеться в найчистішому повітрі, загине від голоду за наявності найсмачнішої їжі. Кожна людина повинна розуміти сутність основних положень молекулярно-кінетичної теорії речовини.
Основні уявлення молекулярної фізики використовуються у таких спеціальних галузях науки, як фізика металів, полімерів і плазми, кристалофізика, фізико-хімічна механіка. Саме молекулярна фізика вказує шляхи на створення матеріалів із заданими властивостями.
4. Актуалізація опорних знань 8 хв.
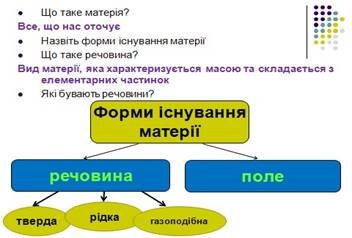
4.1. Студенти заповнюють структурно-логічну схему, відповідаючи на запитання викладача. (див. додаток Б слайд 2)
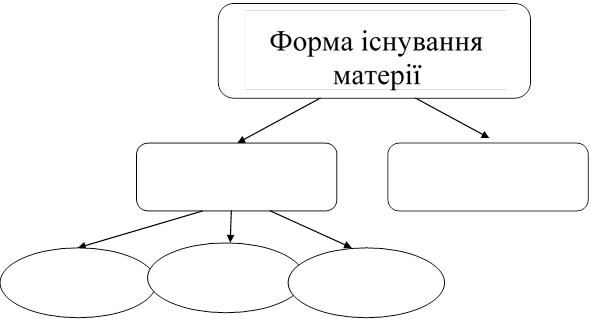
1. Що таке матерія?
Правильна відповідь: Матерія – це усе те, що реально існує поза нашою свідомістю і що може сприйматися нашими органами чуття безпосередньо чи за допомогою приладів.
2. Назвіть форми існування матерії. Правильна відповідь: поле і речовина.
3. Що таке речовина?
Правильна відповідь: Речовина — вид матерії, яка характеризується масою та складається з елементарних частинок.
4. Які бувають речовини?
Правильна відповідь: тверді, рідкі та газоподібні.
4.2. Письмове опитування. Встановити відповідність між властивостями речовин та їх агрегатних станів. (див. додаток Б слайд 3)
![]() 1. Молекули рухаються з величезними швидкостями. А.
Тверді тіла 2. Тіла зберігають форму і об'єм.
1. Молекули рухаються з величезними швидкостями. А.
Тверді тіла 2. Тіла зберігають форму і об'єм.
3. Атоми коливаються біля положення рівноваги. Б. Рідини 4. Відстань між молекулами перевищує розмір молекул.
5. Молекули коливаються, періодично перескакуючи на нове місце. В. Гази 6. Тіла зберігають форму, але не зберігають об'єм.
Правильні відповіді
|
1 |
2 |
3 |
4 |
5 |
6 |
|
В |
А |
А |
В |
Б |
Б |
5. Коментар відповідей студентів 2 хв.
Викладач визначає рівень засвоєння студентами матеріалу попередніх лекцій і відзначає студентів, які брали активну участь у відповідях і які допустили характерні неточності, дає рекомендації по відвідуванню консультацій тим, хто показав недостатні знання.
6. Викладання та вивчення нового матеріалу 30 хв.
План лекції
(див. додаток Б слайд 4)
6.1. Основні положення молекулярно-кінетичної теорії та їх дослідне обґрунтування.
6.2. Маса і розміри молекул.
6.3. Ідеальний газ.
6.4. Основне рівняння молекулярно-кінетичної теорії газів.
Хід викладання та вивчення програмних питань лекції 6.1. Основні положення молекулярно-кінетичної теорії.
Заняття хочеться почати словами угорського вченого, лауреата Нобелівської премії Дьорда де Хевеши: «Мислячий розум не відчуває себе щасливим, поки йому не вдасться зв'язати воєдино розрізнені факти, їм спостережувані». (див. додаток Б слайд 5)
Зв'язати воєдино розрізнені факти, пояснити їх, одержати нові, знайти їм застосування, - ось мета будь-якої наукової теорії, в тому числі і молекулярно – кінетичної теорії, яка є однією з фундаментальних наукових теорій, що затверджує найдавнішу наукову ідею - ідею про дискретність речовини. Вона служить основою для пояснення багатьох фізичних, хімічних, біологічних явищ, а без неї не може обійтися жодна з природничих наук.
Одного разу журналісти поставили Річарду Фейману, Нобелівському лауреату і самому екстравагантному фізику, незвичайне питання: якби в результаті світової катастрофи всі накопичені наукові знання виявилися б знищені і до прийдешніх поколінь перейшла б тільки одна фраза, то яке твердження принесло б найбільшу користь. Фейман назвав атомну гіпотезу: всі тіла складаються з атомів, які знаходяться в безперервному русі, притягуються і відштовхуються один від одного. Така відповідь була викликана непростою долею атомної теорії. Слово «атом» було внесено у фізику давньогрецьким ученим Демокритом дві з половиною тисячі років тому і тільки сотню років тому вчені остаточно прийняли цю гіпотезу на віру. (див. додаток Б слайд 6)
Питання для активізації розумової діяльності: Як ви думаєте, чому так сталося?
Правильна відповідь: Тому що ці частки дуже малі, побачити їх можна тільки за допомогою електронного мікроскопа.
Десятки фізиків добували все нові і нові знання про атоми, а сотні інших вчених продовжували вважати їх зручною вигадкою. (див. додаток Б слайд 7)Так англієць Джон Дальтон ввів поняття хімічного елемента (1804), австрієць Джозеф Лошмідт розрахував масу атомів (1865), італієць Амедео Авогадро порахував кількість частинок, німець Отто Штерн зумів виміряти їх швидкість (1920), а російський хімік Менделєєв об'єднав всі атоми в Періодичну систему. Ну а першим ученим, який заявив: «Тепер я знаю, як влаштований атом!» став англієць Резерфорд .
Молекулярна фізика — це розділ фізики, який розглядає властивості тіл як сумарний результат руху та взаємодії величезної кількості молекул, з яких складаються ці тіла. Основою молекулярної фізики є молекулярно-кінетична теорія будови речовини (МКТ). (див. додаток Б слайд 8)
Мета молекулярно-кінетичної теорії — пояснення властивостей макроскопічних тіл і теплових процесів на основі уявлень про те, що всі тіла складаються з окремих частинок, які хаотично рухаються.
Параметри газу, пов’язані з індивідуальними характеристиками молекул, які його складають, називаються мікроскопічними параметрами (маси молекул, їх швидкості, концентрація).
Параметри, що характеризують стан макроскопічних тіл без урахування їхньої молекулярної будови, називаються макроскопічними параметрами
(об’єм, тиск, температура).
Основна задача МКТ – встановити зв’язок між мікроскопічними і макроскопічними параметрами речовини.
Наприклад, знаючи маси молекул, їхні середні швидкості та концентрацію, знайти об’єм, тиск і температуру даної маси газу, а також виразити тиск газу через його об’єм і температуру.
За допомогою структурно – логічної схеми сформулюємо основні положення МКТ речовини (див. додаток Б слайд 9).
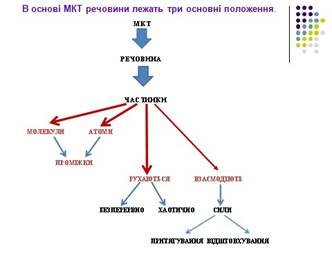
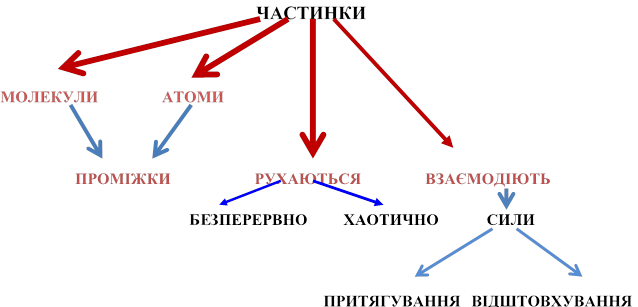
В основі МКТ речовини лежать три основні положення.
1. Будь-яка речовина складається з найдрібніших частинок — молекул чи атомів.
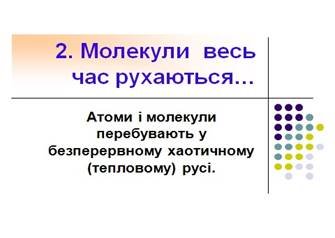
2. Атоми і молекули перебувають у безперервному хаотичному (тепловому) русі.
3. Між молекулами (атомами) існують сили взаємодії, які залежать від відстані між ними і можуть бути силами притягання і відштовхування.
МКТ

Дослідно обґрунтуємо кожне положення.
1 положення. (див. додаток Б слайд 10)
Молекули настільки малі, що розрізнити їх неозброєним оком і навіть у звичайний мікроскоп неможливо. Лише у 1974 р. за допомогою електронного мікроскопа були одержані фотографії окремих атомів і молекул, що, безумовно, стало найпереконливішим доказом їх існування. (див. додаток Б слайд 11)
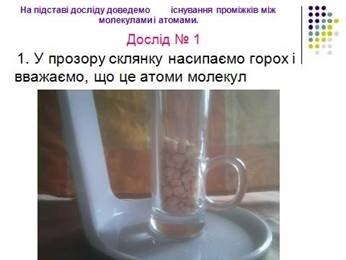
На підставі досліду доведемо існування проміжків між молекулами і атомами.
Дослід 1. У прозору склянку насипаємо горох і вважаємо, що це атоми молекул. Щоб довести існування проміжків між молекулами і атомами досипаємо у ту ж склянку невелику кількість манної крупи. Крупа заповнює існуючі проміжки між горошинами, тим самим наочно демонструє наявність проміжків
між атомами і молекулами. (див. додаток Б слайд 12-14)
2 положення. (див. додаток Б слайд 15-16)
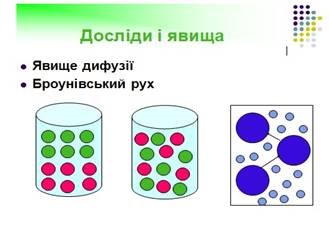
До найпереконливіших дослідів належать насамперед явища дифузії і броунівського руху.
Дифузією називають явище, при якому речовини самі по собі змішуються одна з одною. Найпростіший приклад дифузії в газах — це швидке поширення запахів навіть у спокійному повітрі: аромат парфумів уже через кілька хвилин відчувається в усій кімнаті. (див. додаток Б слайд 17)
У рідинах дифузія відбувається значно повільніше.
Дослід 2. Наллємо у скляний циліндр до половини його висоти концентрованого розчину мідного купоросу, а потім обережно доллємо чистої води. На початку досліду видно чітку межу поділу між розчином мідного купоросу і водою. З часом вона стає розпливчастою; блакитне забарвлення піднімається вгору, і через кілька днів обидві рідини повністю перемішуються, утворюючи однорідний розчин світло-блакитного кольору.
Питання для активізації розумової діяльності: Від чого залежить швидкість дифузії?
Правильна відповідь: Швидкість дифузії невелика і залежить від температури рідини. Оскільки дифузія виникає внаслідок теплового руху молекул, то прискорення цього явища з підвищенням температури свідчить про зростання швидкості частинок.
Питання для активізації розумової діяльності: Чи виникає дифузія в твердих тілах?
Правильна відповідь: Дифундують і молекули твердих тіл, але за звичайних температур дуже повільно. Було проведено такий дослід. На золоту пластинку ставили свинцевий циліндр із ретельно очищеною від оксидів основою і залишали їх у такому положенні за кімнатної температури (20°С) на кілька років. Виявилося, що за 4 роки свинцевий циліндр «спаявся» із золотою пластинкою, а хімічний аналіз показав, що невелика кількість золота проникла в свинець (а свинець — у золото) на глибину близько 5 мм.
Одним з найпереконливіших доказів існування молекул і їх хаотичного теплового руху є броунівський рух, названий так на честь англійського ботаніка Р. Броуна. Почалася ця історія в 1827 році. Англійський ботанік Броун, спостерігаючи в мікроскоп частинки пилка, завислі у воді, помітив, що ці частинки перебувають у "вічному танці". Причину так званого “броунівського руху” зрозуміли тільки через 50 років після цього відкриття. (див. додаток Б слайд 18)
Питання для активізації розумової діяльності: Як пояснити броунівський рух?
Правильна відповідь: Оскільки молекули води весь час перебувають у хаотичному русі, завислі у воді частинки речовини зазнають поштовхів молекул з усіх боків. Але випадково в даний момент може виникнути тимчасова перевага ударів з якогось одного боку, тоді частинка переміщається у протилежний бік. Таким чином, броунівський рух є «відображенням» руху молекул рідини.
Досліди показують, що інтенсивність броунівського руху тим більша, чим вища температура рідини, що свідчить про безпосередній зв'язок теплового руху молекул з рухом броунівських частинок.
Броунівський рух має не лише принципове значення для підтвердження МКТ, а й суто практичне. Зокрема, внаслідок броунівського руху обмежується точність вимірювальних приладів, оскільки стрілки приладів чи дзеркала, розміри яких невеликі, зазнають нескомпенсованих ударів молекул повітря, що вносить похибки у вимірювання.
Викладач демонструє відеоролик «Броунівський рух» і коментує його.
3 положення. (див. додаток Б слайд 19-20)
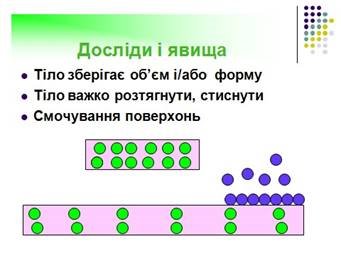
Між частинками, з яких складається тіло, існують сили притягання і сили відштовхування. Якби молекули не притягалися одна до одної. Не було б ні рідин, ні твердих тіл – вони просто розсипалися б на окремі молекули. З іншого боку, якби молекули тільки притягалися, вони “злипалися” б у надзвичайно щільні згустки, а молекули газів під час ударів об стінки посудин “прилипали” б до них. Взаємодія молекул має електричну природу. Хоча молекули, загалом, електрично нейтральні, розподіл позитивних і негативних електричних зарядів у них такий, що на великих відстанях (у порівнянні з розмірами самих молекул) молекули притягуються, а на малих відстанях – відштовхуються. Сили притягання і сили відштовхування діють одночасно. Інакше тіла не могли б зберігати своєї форми: частинки, що їх утворюють, розліталися б у різні боки або злипалися.
Дослід 3. (див. додаток Б слайд 21) Відомо що всі тіла складаються з окремих частинок між якими існують проміжки. Частинки ці знаходяться в безперервному коливальному русі. Закріплюємо ніж для зачистки торців свинцевих циліндрів в штативі. Зачистимо торець першого циліндра, притискаючи його і злегка обертаємо. Проробимо ті ж самі операції з другим циліндром. Торці повинні бути рівними і чистими. Торкатися поверхонь пальцями не можна, вони повинні бути знежиреними. Підвісимо один циліндр до горизонтального стрижня штатива, до гачка другого циліндра підвісимо гирю масою 1 кг. Вага гирі виявляється менше ніж сила тяжіння або сили злипання між двома циліндрами. Таким чином сила притягання між молекулами або атомами свинцю досить велика. 6.2. Маса і розміри молекул
Які розміри молекул?(див. додаток Б слайд 22)
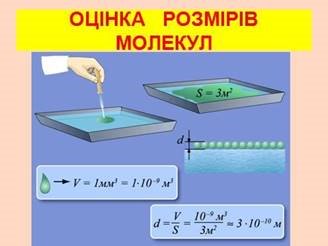
Виміряти розміри молекул лінійкою так само неможливо, як неможливо визначити масу молекули за допомогою терезів. Приблизну оцінку розмірів молекул можна дістати з досліду, вперше проведеного німецьким фізиком В. Рентгеном і англійським фізиком Д. Релеєм. (див. додаток Б слайд 23-24)
Якщо пустити краплю олії (її об'єм відомий) на поверхню чистої води, то вона розпливається, утворюючи тонку плівку, яка складається з одного шару молекул. Тому граничну товщину такої плівки можна прийняти за діаметр молекули. Вимірявши площу утвореної плівки, визначимо її товщину (тобто діаметр молекули). Наприклад, результат одного з дослідів такий: об'єм краплі олії 1 мм3 = 10-9 м3, площа поверхні плівки 3 м2, отже, товщина плівки
10-9 м3 10
d ![]() 2
310 м.
2
310 м.
3м
Сучасні методи вимірювання дають змогу визначати розміри молекул і атомів. Ці розміри приблизно однакові для молекул кожної речовини.
Проте молекули деяких органічних речовин, які складаються з тисяч атомів, мають розміри, що значно перевищують розміри двох- і трьохатомних молекул.
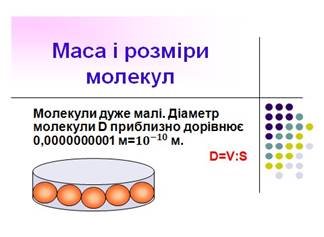
Маси молекул дуже малі, тому зручно використовувати в підрахунках не абсолютні значення мас, а відносні. З 1961 року введена шкала, де маси всіх атомів порівнюють з 1/12 маси атома карбону.
Відносна молекулярна (або атомна) маса речовини Мr – це відношення маси молекули (або атома) даної речовини до 1/12 маси атома карбону.(див. додаток Б слайд 25-26)
Mr ![]() 1/12mm0 0c
1/12mm0 0c
Молярна маса - маса 1 моля речовини. М = Мr∙10-3 кг/моль.
Наприклад, М(Н2) = 2∙10-3 кг/моль, М(СО2) = 44∙10-3 кг/моль.
Кількість речовини ν – число молекул речовини в будь-якому тілі.
m N V
![]()
M NA VM
Nа=6 ·10 ²³ моль-1 - число Авогадро.
В Міжнародній системі одиниць кількість речовини виражають в молях.
Один моль – це кількість речовини, в якій міститься стільки ж атомів або молекул, скільки атомів міститься у карбону масою 0,012 кг.
Концентрація – це кількість молекул (або атомів) в одиниці об’єму.
N
n![]()
3 V
n1м
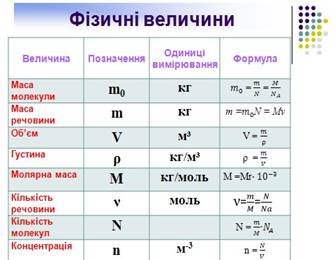
Студенти під керівництвом викладача заповнюють таблицю фізичних величин, необхідних для пояснення молекулярної будови речовини.
Таблиця 1 Фізичні величини (див. додаток Б слайд 27)
|
Величина |
Позначення |
Одиниці вимірювання |
Формула |
|
Маса молекули |
m0 |
кг |
m M
N NA |
|
Маса речовини |
m |
кг |
mm0NM |
|
Об’єм |
V |
м³ |
m V |
|
Густина |
ρ |
кг/м³ |
m V |
|
Молярна маса |
М |
кг/моль |
М = Мr∙10-3 |
|
Кількість речовини |
ν |
моль |
m N V
M NA VM |
|
Кількість молекул |
N |
|
m N |
|
Концентрація |
n |
м-3 |
N n V |
6.3. Ідеальний газ
Звичайно в основі побудови будь-якої теорії лежить метод моделей, який полягає в тому, що замість реального фізичного об’єкта або явища розглядають його спрощену модель. У МКТ газів використовується модель ідеального газу.
Газ, який складається з молекул, які не взаємодіють між собою, називається ідеальним газом. (див. додаток Б слайд 28)
З точки зору молекулярних уявлень, гази складаються з атомів або молекул, відстані між якими значно більші за їхні розміри. Внаслідок цього сили взаємодії між молекулами газів практично відсутні. Взаємодія між ними фактично відбувається лише під час короткочасних зіткнень.
Оскільки взаємодія молекул ідеального газу зводиться лише до короткочасних зіткнень і розміри молекул не впливають на тиск і температуру газу, ми можемо вважати, що ідеальний газ – набір не взаємодіючих матеріальних точок. Тобто ідеальний газ – це абстракція, введення якої зумовлене тим, що теоретично врахувати одночасний рух, взаємодію й розміри молекул газу вкрай складно. Реальні розрідженні гази поводяться подібно до ідеального газу.
6.4. Основне рівняння молекулярно-кінетичної теорії газів
(див. додаток Б слайд 29-32)
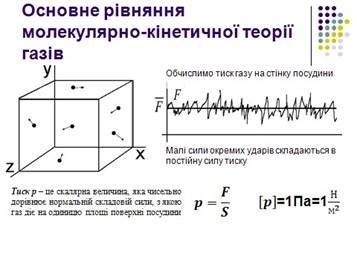
Використовуючи модель ідеального газу, обчислимо тиск газу на стінку посудини. У процесі взаємодії молекули зі стінкою судини між ними виникають сили, що підкоряються третьому закону Ньютона. В результаті проекція υх швидкості молекули, перпендикулярна стінці, змінює свій знак на протилежний, а проекція υу швидкості, паралельна стінці, залишається незмінною (рис. 1). Тому зміна імпульсу молекули дорівнюватиме
![]()
де m0 - маса молекули.
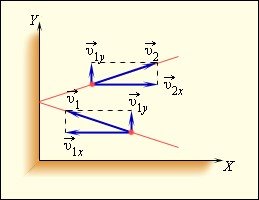
Рис. 1. Пружне зіткнення молекули зі стінкою
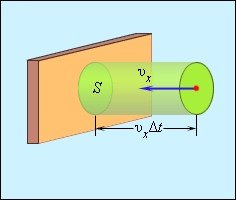 Виділимо на стінці деяку
площадку S (рис. 2). За час Δt з цим майданчиком зіткнуться всі молекули, що
мають проекцію швидкості υх, спрямовану в бік стінки, і знаходяться
в циліндрі з основою площі S і висотою υхΔt.
Виділимо на стінці деяку
площадку S (рис. 2). За час Δt з цим майданчиком зіткнуться всі молекули, що
мають проекцію швидкості υх, спрямовану в бік стінки, і знаходяться
в циліндрі з основою площі S і висотою υхΔt.
Нехай в одиниці об'єму посудини містяться n молекул, тоді число молекул в об'ємі циліндра дорівнює nSυхΔt. Але з цього числа лише половина рухається в бік стінки, а інша половина рухається в протилежному напрямку і зі стінкою не стикаються. Отже, число ударів молекул об
майданчик S за час Δt дорівнює
Рис.
2. Визначення числа зіткнень молекул з майданчиком S 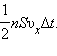 Оскільки кожна молекула
при зіткненні зі стінкою змінює свій імпульс на величину 2m0 υх,
то повна зміна імпульсу всіх молекул, що зіткнулися за час Δt з майданчиком S,
дорівнює
Оскільки кожна молекула
при зіткненні зі стінкою змінює свій імпульс на величину 2m0 υх,
то повна зміна імпульсу всіх молекул, що зіткнулися за час Δt з майданчиком S,
дорівнює
![]() .
.
За законами механіки ця зміна імпульсу всіх зіткнувшихся зі стінкою молекул відбувається під дією імпульсу сили FΔt, де F - деяка середня сила, що діє на молекули з боку стінки на майданчику S. Але за третім законом Ньютона така ж по модулю сила діє з боку молекул на майданчик S. Тому можна записати :
![]()
Розділивши обидві частини на SΔt , отримаємо :
![]()
де p - тиск газу на стінку посудини.
Так як всі напрямки для векторів швидкостей молекул рівноймовірні, середнє значення квадратів їх проекцій на координатні осі рівні між собою:
![]()
Остання рівність випливає з теореми Піфагора, квадрат швидкості молекули дорівнює сумі квадратів проекцій швидкості на координатні вісі:
![]()
v2 vx2 vy2 vz2
Формула для тиску газу на стінку посудини запишеться у вигляді
1 2
![]() p m0n
p m0n
3
Це рівняння встановлює зв'язок між тиском p ідеального газу, масою молекули m0, концентрацією молекул n і середнім значенням квадрата швидкості. Його називають основним рівнянням молекулярно - кінетичної теорії газів.
7. Закріплення знань студентів…………………………………………………10 хв
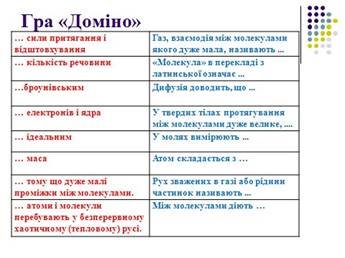
Гра «Доміно». Студенти працюючи в парах, повинні скласти правильне твердження(див. додаток Б слайд 33-34)
|
… сили притягання і відштовхування |
Газ, взаємодія між молекулами якого дуже мала, називають ... |
|
… кількість речовини |
«Молекула» в перекладі з латинської означає ... |
|
…броунівським |
Дифузія доводить, що ... |
|
… електронів і ядра |
У твердих тілах притягання між молекулами дуже велике, .... |
|
… ідеальним |
У молях вимірюють ... |
|
… маса |
Атом складається з … |
|
… тому що дуже малі проміжки між молекулами. |
Рух зважених в газі або рідини частинок називають ... |
|
… атоми і молекули перебувають у безперервному хаотичному (тепловому) русі. |
Між молекулами діють … |
Правильні відповіді:
Газ, взаємодія між молекулами якого дуже мала, називають ідеальним.
«Молекула» в перекладі з латинської означає маса.
Дифузія доводить, що атоми і молекули перебувають у безперервному хаотичному (тепловому) русі.
У твердих тілах притягання між молекулами дуже велике, тому що дуже малі проміжки між молекулами.
У молях вимірюють кількість речовини.
Атом складається з електронів і ядра.
Рух зважених в газі або рідини частинок називають броунівським. Між молекулами діють сили притягання і відштовхування.
8. Коментар роботи студентів 2 хв Викладач визначає рівень засвоєння студентами матеріалу лекції і відзначає прізвища студентів, які брали активну участь у відповідях і які допустили характерні неточності, дає рекомендації по відвідуванню консультацій тим, хто показав недостатнє засвоєння.
9. Підсумок заняття 2 хв
Викладач підводить загальний підсумок по проведеному заняттю. Відмічає в цілому роботу групи і прізвища активних та пасивних студентів. Уразі необхідності призначає консультації для окремих студентів.
Викладач вказує, що на наступному занятті буде продовження вивчення питань цієї теми.
10. Домашнє завдання (див. додаток Б слайд 35) - 2 хв
1. Вивчити теоретичний матеріал за підручником. Гончаренко С.У. Фізика: Пробний навчальний посібник для шкіл ІІІ ступеня, гімназії і класів гуманітарного профілю. 10 кл.- К.: Освіта, 1995, с. 5-42.
2. Виконати експериментальне завдання. Провести один із дослідів.
2.1 На дно двох склянок із водою (в одній склянці — холодна вода, в другій – гаряча) покласти по однаковому шматочку сухої фарби. Через кожні півгодини вимірювати рівень забарвленої води. Пояснити результати досліду.
2.2 Взяти два шматочки скла (можна два однакові дзеркальця), вимити, висушити й притиснути одне до одного. Легко чи важко їх роз’єднати? Те саме виконати з мокрим склом. Пояснити результати досліду.
3. Прочитати поему Лукреція Кара «О природе вещей» і відповісти на запитання: 1. Якими рядками підтверджуються положення МКТ? Підкреслити
2. Перерахувати фізичні явища, про які йде мова в поемі?
Висновки
В даній методичній розробці викладачем показана методика проведення лекції з елементами бесіди, демонстрацією дослідів та застосуванням ТЗН, в якій поєднуються теоретичні основи і практичні аспекти обраної теми для найкращого досягнення навчальної, виховної та розвиваючої мети заняття.
Активізація опорних знань і розумової діяльності студентів проводиться у вигляді заповнення структурно – логічної схеми по основним поняттям та письмовому опитуванню на встановлення відповідностей між властивостями речовин та їх агрегатних станів.
Викладання та вивчення нового матеріалу супроводжується історичними довідками з історії фізики, демонстрацією слайдів з основними означеннями та формулами, дослідів та відеороликів. Викладач спонукає студентів до бесіди постановкою питань, відповідаючи на які, можна вести самостійний аналіз наукових фактів і робити необхідні висновки, формувати поняття та їх властивості, що сприяє більш глибокому і свідомому розумінню та засвоєнню матеріалу.
Успіх проведення лекції залежить не тільки від майстерності викладача, а великою мірою і від готовності студентів сприймати новий матеріал, від їх емоційного настрою. Використання технічних засобів навчання, лабораторного обладнання, прикладів з повсякденності пожвавлює зацікавленість і викликає інтерес до лекції.
Закріплення та узагальнення навчального матеріалу лекції проводиться у формі парної гри «Доміно», суть якої знайти продовження речення, яке має фізичний зміст з матеріалу теми, що розглядалася на занятті, що дозволяє ще раз акцентувати увагу на основні питання лекції.
Можлива інша методика викладання цієї теми. Автор навів свої напрацювання.
Додаток А
Опорний конспект лекції
Тема заняття: Основи молекулярно-кінетичної теорії газів.
Хід заняття
Актуалізація опорних знань
Заповнити структурно-логічну схему, відповідаючи на запитання викладача.
План лекції
1. Основні положення молекулярно-кінетичної теорії та їх дослідне обґрунтування.
2. Маса і розміри молекул.
3. Ідеальний газ.
4. Основне рівняння молекулярно-кінетичної теорії газів.
1. Основні положення молекулярно-кінетичної теорії та їх дослідне обґрунтування.
Молекулярна фізика — це розділ фізики, який розглядає властивості тіл як сумарний результат руху та взаємодії величезної кількості молекул, з яких складаються ці тіла. Основою молекулярної фізики є молекулярно-кінетична теорія будови речовини (МКТ).
Мета молекулярно-кінетичної теорії — пояснення властивостей макроскопічних тіл і теплових процесів на основі уявлень про те, що всі тіла складаються з окремих частинок, які хаотично рухаються.
Основна задача МКТ – встановити зв’язок між мікроскопічними і макроскопічними параметрами речовини.
Основні положення МКТ речовини
1. Будь-яка речовина складається з найдрібніших частинок — молекул чи атомів.
2. Атоми і молекули перебувають у безперервному хаотичному (тепловому) русі.
3. Між молекулами (атомами) існують сили взаємодії, які залежать від відстані між ними і можуть бути силами притягання і відштовхування.
Дифузією називають явище, при якому речовини самі по собі змішуються одна з одною.
Броунівський рух — невпорядкований, хаотичний рух дрібних частинок речовини в розчинах. 2. Маса і розміри молекули
Таблиця. Фізичні величини
|
Величина |
Позначення |
Одиниці вимірювання |
Формула |
|
Маса молекули |
m0 |
кг |
|
|
Маса речовини |
m |
кг |
|
|
Об’єм |
V |
м³ |
|
|
Густина |
ρ |
кг/м³ |
|
|
Молярна маса |
М |
кг/моль |
|
|
Кількість речовини |
ν |
моль |
|
|
Кількість молекул |
N |
|
|
|
Концентрація |
n |
м-3 |
|
NA 6,021023моль1
3. Ідеальний газ.
Газ, який складається з молекул, які не взаємодіють між собою, називається ідеальним газом.
4. Основне рівняння молекулярно-кінетичної теорії газів
Виведення основного рівняння МКТ газів:
5. Домашнє завдання
1. Вивчити теоретичний матеріал за підручником. Гончаренко С.У. Фізика: Пробний навчальний посібник для шкіл ІІІ ступеня, гімназії і класів гуманітарного профілю. 10 кл.- К.: Освіта, 1995, с. 5-42.
2. Виконати експериментальне завдання. Провести один із дослідів
2.1 На дно двох склянок із водою (в одній склянці — холодна вода, в другій – гаряча) покласти по однаковому шматочку сухої фарби. Через кожні півгодини вимірювати рівень забарвленої води. Пояснити результати досліду.
2.2 Взяти два шматочки скла (можна два однакові дзеркальця), вимити, висушити й притиснути одне до одного. Легко чи важко їх роз’єднати? Те саме виконати з мокрим склом. Пояснити результати досліду.
3. Прочитати поему Лукреція Кара «О природе вещей» і відповісти на запитання 1. Якими рядками підтверджуються положення МКТ? Підкреслити 2. Перерахувати фізичні явища, про які йде мова в поемі?
Выслушай то, что скажу, и ты сам, несомненно, признаешь, Что существуют тела, которых мы видеть не можем.
Ветер, во-первых, морей неистово волны бичует,
Рушит громады судов и небесные тучи разносит,
Или же, мчась по полям, стремительным кружится вихрем,
Мощные валит стволы, неприступные горные выси,
Лес низвергая, трясет порывисто: так, налетая,
Ветер, беснуясь, ревет и проносится с рокотом грозным.
Стало быть, ветры - тела, но только незримые нами:
Далее, запахи мы обоняем различного рода,
Хоть и не видим совсем, как в ноздри они проникают. Также палящей жары или холода нам не приметить Зреньем своим никогда, да и звук увидать невозможно.
Но это-все обладает, однако, телесной природой, Если способно оно приводить наши чувства в движенье: Ведь осязать, как и быть осязаемым, тело лишь может. И, наконец, на морском берегу, разбивающем волны,
Платье сыреет всегда, а на солнце вися, оно сохнет; Видеть, однако, нельзя, как влага на нем оседает, Да и не видно того, как она исчезает от зноя.
Значит, дробится вода на такие мельчайшие части, Что недоступны они совершенно для нашего глаза. Так и кольцо изнутри, что долгое время на пальце
Носится, из году в год становится тоньше и тоньше;
Капля за каплей долбит, упадая, скалу; искривленный
Плуга железный сошник незаметно стирается в почве;
И мостовую дорог, мощенную камнями, видим
Стертой ногами толпы; и правые руки у статуй
Бронзовых возле ворот городских постепенно худеют От припадания к ним проходящего мимо народа.
Нам очевидно, что вещь от стиранья становится меньше, Но отделение тел, из нее каждый миг уходящих,
Нашим глазам усмотреть запретила природа ревниво.
Додаток Б
|
|
|
|
Слайд 1 |
Слайд 2 |
|
|
|
|
Слайд 3 |
Слайд 4 |
|
|
|
|
Слайд 5 |
Слайд 6 |
|
|
|
|
Слайд 7 |
Слайд 8 |
|
|
|
|
Слайд 9 |
Слайд 10 |
|
|
|
|
Слайд 11 |
Слайд 12 |
|
|
|
|
Слайд 13 |
Слайд 14 |
|
|
|
|
Слайд 15 |
Слайд 16 |
|
|
|
|
Слайд 17 |
Слайд 18 |
|
|
|
|
Слайд 19 |
Слайд 20 |
|
|
|
|
Слайд 21 |
Слайд 22 |
|
|
|
|
Слайд 23 |
Слайд 24 |
|
|
|
|
Слайд 25 |
Слайд 26 |
|
|
|
|
Слайд 27 |
Слайд 28 |
|
|
|
|
Слайд 29 |
Слайд 30 |
|
|
|
|
Слайд 31 |
Слайд 32 |
|
|
|
|
Слайд 33 |
Слайд 34 |
|
|
|
|
Слайд 35 |
Додаток В Бланк відповідей ПІБ студента_____________________________ група 1П(о)13
1. Молекули рухаються з величезними швидкостями. А. Тверді тіла 2. Тіла зберігають форму і об'єм.
![]() 3. Атоми
коливаються біля положення рівноваги. Б.
Рідини 4. Відстань між молекулами перевищує розмір молекул.
3. Атоми
коливаються біля положення рівноваги. Б.
Рідини 4. Відстань між молекулами перевищує розмір молекул.
5. Молекули коливаються, періодично перескакуючи на нове місце. В. Гази 6. Тіла зберігають форму, але не зберігають об'єм.
Правильні відповіді
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
|
|
|


про публікацію авторської розробки
Додати розробку