Міні підручник "Опорні схеми на уроках хімії"
1ё
ГОЛОВАЧАНСЬКИЙ КОМУНАЛЬНИЙ ЗАКЛАД ЗАГАЛЬНОЇ СЕРЕДНЬОЇ ОСВІТИ ТЕРЕШКІВСЬКОЇ СІЛЬСЬКОЇ РАДИ ПОЛТАВСЬКОГО РАЙОНУ ПОЛТАВСЬКОЇ ОБЛАСТІ

2021 р.
Автор:
Ісіченко Анна, учениця 11 класу Головачанського комунального закладу загальної середньої освіти Терешківської сільської ради Полтавського району Полтавської області хімії
Рецензент:
Кравченко Л.М., учитель хімії та біології вищої категорії, вчитель-методист Головачанського комунального закладу загальної середньої освіти Терешківської сільської ради Полтавського району Полтавської області
Посібник містить опорні схеми до уроків, які можуть бути використані як з метою закріплення рівня навчальних досягнень учнів 7 класу згідно з чинною програмою з хімії для загальноосвітніх навчальних закладів з відповідних тем, так і з метою самопідготовки учнів.
Схвалено на засіданні методичного об’єднання вчителів природничо – математичного циклу Головачанського КЗЗСО ( протокол №3 від 16.03.2021р.)
ЗМІСТ
Значення хімії ___________________________________________ 4
Історичні етапи розвитку хімічної науки ______________________5
Явища___________________________________________________6
Чисті речовини та суміші___________________________________8
Молекули та атоми________________________________________9
Хімічні елементи_________________________________________ 11
Багатоманітність речовин__________________________________ 12
Хімічні формули речовин__________________________________ 13
Відносна молекулярна маса, масова частка елемента____________14
Закон збереження маси речовини____________________________16
Хімічні реакції ___________________________________________17
Оксиген _________________________________________________18
Кисень – проста речовина___________________________________19
Добування та застосування кисню____________________________20
Хімічні властивості кисню__________________________________21
Вода_____________________________________________________23
Вода – розчинник _________________________________________ 25
Лабораторний посуд________________________________________






![]()

 ЛІКИ
ЛІКИ


![]()
![]()

![]()



ДОСЯГНЕННЯ УЧЕНИХ - ХІМІКІВ ВПРОВАДЖУЮТЬ У ПРОМИСЛОВІСТЬ, ТЕХНІКУ, МЕДИЦИНУ, ПОБУТ.
«ШИРОКО ПРОСТЯГАЄ ХІМІЯ РУКИ СВОЇ У СПРАВИ ЛЮДСЬКІ… КУДИ НЕ ПОГЛЯНЕМО, СКРІЗЬ ПОСТАЮТЬ ПЕРЕД ОЧИМА НАШИМИ УСПІХИ ЇЇ СТАРАННОСТІ»
МИХАЙЛО ВАСИЛЬОВИЧ ЛОМОНОСОВ
ІСТОРИЧНІ ЕТАПИ РОЗВИТКУ ХІМІЧНОЇ НАУКИ
|
I ТИСЯЧОЛІТТЯ ДО Н.Е. |
ПЕРІОД СПОГЛЯДАННЯ |
ГОРІННЯ – ОДНА ІЗ ПЕРШИХ ХІМІЧНИХ РЕАКЦІЙ, ЯКУ СПОСТЕРІГАЛА ЛЮДИНА |
|
ДО IV СТОЛІТТЯ Н.Е. |
ПЕРІОД РЕМІСНИЦЬКОЇ ХІМІЇ |
ПЕРЕРОБКА ГІРСЬКИХ ПОРІД ТА МІНЕРАЛІВ, ВИРОБНИЦТВО ЗНАРЯДЬ ПРАЦІ ТА ПРИКРАС,ВИПЛАВКА МЕТАЛІВ,ФАРБУВАННЯ ТКАНИН, ВИРОБНИЦТВО КЕРАМІКИ |
|
IV – XVI СТОЛІТТЯ |
АЛХІМІЧНИЙ ПЕРІОД |
ПОШУКИ «ФІЛОСОФСЬКОГО КАМЕНЮ», ВІДКРИТО БАГАТО НОВИХ РЕЧОВИН, ЗАПОЧАТКОВАНО ВИРОБНИЦТВО ЛІКІВ |
|
XVI – XVII СТОЛІТТЯ |
ПЕРІОД «ЯТРОХІМІЇ» |
СЛУЖІННЯ МЕДИЦИНІ,БОРОТЬБА З ХВОРОБАМИ ЗА ДОПОМОГОЮ ХІМІЧНИХ ЗАСОБІВ |
|
XVII – XVIII СТОЛІТТЯ |
ПЕРІОД ТЕОРІЇ ФЛОГІСТОНУ |
ТЕОРІЯ ДАЛА ПОЯСНЕННЯ БАГАТЬОМ ХІСІЧНИМ РЕАКЦІЯМ ТА ХІМІЧНИМ ПЕРЕТВОРЕННЯМ |
|
|
ПЕРІОД СТАНОВЛЕННЯ ТА РОЗВИТКУ АТОМНО – МОЛЕКУЛЯРНОГО ВЧЕННЯ |
ПОЧАТОК ФОРМУВАННЯ ХІМІЇ, ЯК НАУКИ:СФОРМОВАНО ОСНОВИ АТОМНО – МОЛЕКУЛЯРНОГО ВЧЕННЯ,ВІДКРИВАЮТЬСЯ НОВІ ХІМІЧНІ ЕЛЕМЕНТИ ТА РЕЧОВИНИ |
|
|
ПЕРІОД РОЗВИТКУ ХІМІЇ ВИСОКОМОЛЕКУЛЯРНИХ СПОЛУК |
БУРХЛИВИЙ РОЗВИТОК ОРГАНІЧНОГО СИНТЕЗУ, СТВОРЕННЯ НОВИХ ПОЛІМЕРНИХ МАТЕРІАЛІВ |
ЯВИЩА
![]() ЯВИЩА - ВСІ ТІ ЗМІНИ, ЩО ВІДБУВАЮТЬСЯ З ТІЛАМИ У ПРИРОДІ
ЯВИЩА - ВСІ ТІ ЗМІНИ, ЩО ВІДБУВАЮТЬСЯ З ТІЛАМИ У ПРИРОДІ
![]()
![]()
![]()

![]()
![]()
![]()

![]()
![]()



Політичні суспільні фізичні


Біологічні хімічні
ХІМІЯ-НАУКА ПРО РЕЧОВИНИ, ЯКА ВИВЧАЄ ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ РЕЧОВИНИ
Фізичні явища
- явища , при яких не утворюються інші речовини, а змінюються агрегатний стан, розміри та форма тіла.
НАПРИКЛАД: КИПІННЯ ВОДИ, ПЛАВЛЕННЯ МЕТАЛУ, ПОДРІБНЕННЯ СКЛА.
Хімічні явища
— явища, під час яких одні речовини перетворюються на інші.
НАПРИКЛАД: ГОРІННЯ ПРИРОДНОГО ГАЗУ,СКИСАННЯ МОЛОКА, ПЕРЕРОБКА НАФТИ
ХІМІЧНІ ЯВИЩА НАЗИВАЮТЬСЯ ХІМІЧНИМИ РЕАКЦІЯМИ.

 ОЗНАКИ ХІМІЧНИХ РЕАКЦІЙ:
ОЗНАКИ ХІМІЧНИХ РЕАКЦІЙ:
- Зміна забарвлення.
- Поява або зникнення запаху.
- Випадання або розчинення осаду.
-
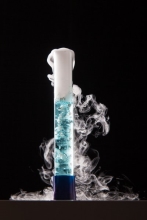 Виділення газу.
Виділення газу.
- Виділення або поглинання світла,тепла.
- Поява електричної енергії.

ЧИСТІ РЕЧОВИНИ. СУМІШІ
 У природі не існує абсолютно чистих речовин. Речовини існують переважно у вигляді сумішей.
У природі не існує абсолютно чистих речовин. Речовини існують переважно у вигляді сумішей.
Суміш – це поєднання кількох речовин.
![]() Морська вода чиста вода + сіль;
Морська вода чиста вода + сіль;
![]()
![]()
![]()
![]() Порох вуглець
Порох вуглець
![]()
 сірка
сірка
 селітра
селітра
![]()
![]()
![]()


![]()
![]()



 ЕМУЛЬСІЯ – НЕОДНОРІДНА СУМІШ, В ЯКІЙ ЧАСТИНКИ ОДНІЄЇ РІДИНИ РІВНОМІРНО РОЗПОДІЛЕНІ В ІНШІЙ РІДИНІ ( ОЛІЯ ТА ВОДА, МОЛОКО)
ЕМУЛЬСІЯ – НЕОДНОРІДНА СУМІШ, В ЯКІЙ ЧАСТИНКИ ОДНІЄЇ РІДИНИ РІВНОМІРНО РОЗПОДІЛЕНІ В ІНШІЙ РІДИНІ ( ОЛІЯ ТА ВОДА, МОЛОКО)
СУСПЕНЗІЯ – НЕОДНОРІДНА СУМІШ, В ЯКІЙ ЧАСТИНКИ ТВЕРДОЇ РЕЧОВИНИ РІВНОМІРНО РОЗПОДІЛЕНІ В РІДИНІ ( КРЕЙДА ТА ВОДА, ГЛИНА ТА ВОДА)
ОСНОВНІ СПОСОБИ РОЗДІЛЕННЯ СУМІШЕЙ: ВІДСТОЮВАННЯ, ФІЛЬТРУВАННЯ, ВИПАРЮВАННЯ, ДИСТИЛЯЦІЯ, КРИСТАЛІЗАЦІЯ, ДІЯ МАГНІТОМ,ХРОМАТОГРАФІЯ
МОЛЕКУЛИ , АТОМИ ТА ЙОНИ
![]()
![]()
![]()
![]()
![]()
![]()
назва КИСЕНЬ АЗОТ ВОДЕНЬ ВОДА ВУГЛЕКИСЛИЙ ГАЗ
умовний O2 N2 H2 H2O CO2
![]()
![]()
![]()
![]()
![]() запис
запис
![]()
![]()
![]()
![]()
![]() молекули
молекули
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() атоми
атоми
![]()
назви атоми атоми атоми атоми атоми
атомів Оксигену Нітрогену Гідрогену Гідрогену Карбону
та Оксигену та Оксигену
символи O N H H , O C , O
ХІМІЧНЙ ЕЛЕМЕНТ – ЦЕ ПЕВНИЙ ВИД АТОМІВ
АТОМ – найдрібніша електронейтральна частинка речовини.
МОЛЕКУЛА - це електронейтральна частинка речовини, яка складається атомів двох і більше хімічних елементів.
ЙОН - це позитивно або негативно заряджені частинки, в які перетворюються атоми або групи атомів в результаті віддачі або приєднання електронів.
1911р. англійський вчений ЕРНЕСТ РЕЗЕРФОРД запропонував планетарну будову атома.
Атом складається з позитивно зарядженого ядра та негативно заряджених електронів, що рухаються навколо ядра по енергетичних рівнях.
![]()
 електрон
електрон

 е̄ ядро атома
е̄ ядро атома
 ̄е
̄е
![]()
![]() Енергетичні
Енергетичні
Рівні
Йони можуть бути прості( Na⁺, S ² ̄, Mg ² ⁺) та складні (SO4² ̄, PO4 ³ ̄ ).
КАТІОНИ – позитивно заряджені йони: Ca ²⁺, H⁺, NH4⁺;
АНІОНИ – негативно заряджені йони: OH ̄ , CO3 ² ̄ ,NO3 ̄;
В ПЕРІОДИЧНІЙ СИСТЕМІ ХІМІЧНИХ ЕЛЕМЕНТІВ АТОМИ ХІМІЧНИХ ЕЛЕМЕНТІВ РОЗМІЩЕНІ В ПОРЯДКУ ЗБІЛЬШЕННЯ ЗАРЯДУ ЯДРА АТОМА
номер періоду означає: кількість енергетичних рівнів в атомі
порядковий номер елемента означає: заряд ядра атома, кількість електронів в атомі, кількість протонів в ядрі атома
ЯДРО АТОМА: містить протони p₁⁺ та нейтрони n₁°
НЕЙТРОНИ: від округленої атомної маси елемента відняти порядковий номер елемента.
Al: е̄ =13, p ₁⁺ =13, n ₁°= 27 -13 = 14.
 ХІМІЧНІ ЕЛЕМЕНТИ
ХІМІЧНІ ЕЛЕМЕНТИ
 Англійський фізик Джон Дальтон підтвердив існування атомів, ввів поняття « хімічний елемент», «атомна маса», досліджував склад повітря.
Англійський фізик Джон Дальтон підтвердив існування атомів, ввів поняття « хімічний елемент», «атомна маса», досліджував склад повітря.
Шведський вчений Єнс Якоб Берцеліус розробив символи хімічних елементів .
|
хімічний символ |
латинська назва |
національна назва |
вимова |
атомна маса |
проста речовина |
|
H |
Гідрогеніум |
Гідроген |
аш |
1 |
H2-водень |
|
O |
Оксигеніум |
Оксиген |
о |
16 |
O2- кисень |
|
C |
Карбон |
Карбон |
це |
12 |
C- вулець |
|
N |
Нітрогеніум |
Нітроген |
ен |
14 |
N2- азот |
|
S |
Сульфур |
Сульфур |
ес |
32 |
S- сірка |
|
P |
Фосфор |
Фосфор |
пе |
31 |
P- фосфор |
|
K |
Калій |
Калій |
калій |
39 |
K- калій |
|
Ca |
Кальцій |
Кальцій |
кальцій |
40 |
Ca- кальцій |
|
Si |
Силіцій |
Силіцій |
силіцій |
28 |
Si- кремній |
|
Al |
Алюмініум |
Алюміній |
Алюміній |
27 |
Al-алюміній |
|
Cu |
Купрум |
Купрум |
Купрум |
64 |
Cu- мідь |
|
Mg |
Магній |
Магній |
Магній |
24 |
Mg- магній |
|
Ba |
Барій |
Барій |
Барій |
137 |
Ba- барій |
|
Zn |
Цинк |
Цинк |
Цинк |
65 |
Zn - цинк |
|
Cl |
Хлор |
Хлор |
Хлор |
35,5 |
Cl2- хлор |
|
Fe |
Ферум |
Ферум |
Ферум |
56 |
Fe- залізо |
|
F |
Флуор |
Фтор |
флуор |
19 |
F2- фтор |
|
Br |
Бром |
Бром |
Бром |
80 |
Br2- бром |
|
j |
Іод |
Йод |
Йод |
127 |
J2- йод |
|
Na |
Натрій |
Натрій |
Натрій |
23 |
Na- натрій |
|
Li |
Літіум |
Літій |
Літій |
7 |
Li- літій |
|
Mn |
Манганум |
Манган |
Манган |
55 |
Mn- марганець |
|
Ag |
Аргентум |
Аргентум |
Аргентум |
108 |
Ag-срібло |
|
Hg |
Меркурій |
Гідраргіум |
Гідраргіум |
201 |
Hg- ртуть |

БАГАТОМАНІТНІСТЬ РЕЧОВИН
![]()

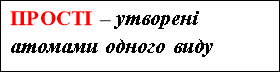
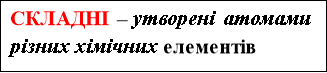






|
розміщення неметалічних елементів у ПСХЕ |
|||||||
|
ГРУПИ |
|||||||
|
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
|
H |
|
|
|
|
|
(H) |
He |
|
|
|
B |
C |
N |
O |
F |
Ne |
|
|
|
|
Si |
P |
S |
Cl |
Ar |
|
|
|
|
|
As |
Se |
Br |
Kr |
|
|
|
|
|
|
Te |
J |
Xe |
|
|
|
|
|
|
|
At |
Rn |
ЗАПАМЯТАЙ:ці прості речовини двохатомні
H2- водень; O2-кисень; N2-азот; F2-фтор; Cl2-хлор; Br2-бром; J2 –;йод;
ХІМІЧНІ ФОРМУЛИ РЕЧОВИН
Хімічна формула – це умовний запис складу речовини за допомогою символів та індексів.
![]()
![]()

 7H2O
7H2O
КОЕФІЦІЄНТ ІНДЕКС СИМВОЛ ЕЛЕМЕНТА
КОЕФІЦІЄНТ – це число, що позначає кількість молекул і пишеться перед формулою речовини.
ІНДЕКС – це число, що показує кількість атомів або груп атомів у складі речовини.
5H2O – п’ять молекул води;
4 HNO3 – чотири молекули нітратної кислоти;
O2 – два атоми Оксигену або одна молекула кисню;
2O2 – дві молекули кисню;
O3- три атоми Оксигену;
11Al –одинадцять молекул(атомів) алюмінію;
S6 – шість атомів сірки;
P4- чотири атоми фосфору;
ЧИТАННЯ ФОРМУЛ РЕЧОВИН:
H2SO4 – аш два ес о чотири;
CO2 – це о два;
Zn(OH)2 - цинк оаш двічі;
ВІДНОСНА МОЛЕКУЛЯРНА МАСА. МАСОВА ЧАСТКА ЕЛЕМЕНТА.
Відносна молекулярна маса – це число, яке показує, у скільки разів маса певної молекули більша від ![]() маси атома Карбону.
маси атома Карбону.
МОЛЕКУЛЯРНА МАСА – ЦЕ СУМА ВІДНОСНИХ АТОМНИХ МАС ЕЛЕМЕНТІВ, З ЯКИХ СКЛАДАЄТЬСЯ МОЛЕКУЛА РЕЧОВИНИ.
Молекулярна маса позначається Mr;
НАПРИКЛАД: обчислити відносну молекулярну масу речовин за формулами:SO2, NH3, Cu(OH)2, Al2O3.
Mr(SO2) = Ar(S)+Ar(O)=32+ 16×4 =32+ 64 =96;
Mr(NH3) = Ar(N) +Ar(H) = 14 +1×3 =14+3= 17;
Mr( Cu(OH)2) = Ar(Cu)+(Ar(O)+Ar(H))×2=64+(16+1)×2=64+17×2=98;
Mr (Al2O3)= Ar(Al)×2+Ar(O)×3= 27×2+16×3=54+48=102;
МАСОВА ЧАСТКА ЕЛЕМЕНТА – це відношення маси елемента до маси сполуки. Її виражають у відсотках або у частках від одиниці.
ω(Е) – масова частка елемента
Ar(E) – відносна атомна маса елемента
n- кількість атомів елемента
Mr- відносна молекулярна маса сполуки
ω(Е) = ![]() ×100% або ω(Е) =
×100% або ω(Е) = ![]() ;
;
Наприклад: обчислити масові частки елементів за формулою сполуки:CuO, MgSO4,Al2O3.
Спочатку обчисляємо відносну молекулярну масу сполуки, а потім за формулою обчислення масової частки елемента розраховуємо масові частки елементів за даною формулою.
Mr(CuO)= Ar(Cu) + Ar(O)= 64+16 = 80.
ω(Cu) = ![]() ×100% =
×100% = ![]() ×100% = 80%
×100% = 80%
ω(O) = ![]() ×100% =
×100% = ![]() ×100% = 20%
×100% = 20%
Відповідь: ω(Cu)= 80%, ω(О)=20%.
Mr (MgSO4) = Ar(Mg) + Ar(S)+Ar(O)×4=24+32+16×4=120.
ω(Mg) = ![]() ×100% =
×100% = ![]() ×100% =20%.
×100% =20%.
ω(S) = ![]() ×100% =
×100% =![]() 100% =26,6 = 27%.
100% =26,6 = 27%.
ω(O4) = ![]() ×100% =
×100% =![]() 100% =
100% =![]() 100% =53,3= 53%.
100% =53,3= 53%.
Відповідь: ω(Mg)= 20%, ω(S)=27%, ω(О4)=53%.
Mr(Al2O3) = Ar(Al)×2 + Ar(O) ×3 =27×2+ 16×3 =102.
ω(Al2) = ![]() ×100% =
×100% = ![]() ×100% =
×100% = ![]() ×100% =52,9= 53%
×100% =52,9= 53%
ω(O3) = ![]() ×100% =
×100% =![]() 100% =
100% =![]() 100% = 47%.
100% = 47%.
Відповідь: ω(Al)= 53%, ω(O)=47%.
 Правильним буде розв’язок, якщо сума масових часток елементів, що входять до складу певної сполуки, становитиме 100%.
Правильним буде розв’язок, якщо сума масових часток елементів, що входять до складу певної сполуки, становитиме 100%.

ЗАКОН ЗБЕРЕЖЕННЯ МАСИ РЕЧОВИНИ

У 1748 р. великий російський учений Михайло Васильович Ломоносов відкрив і експериментально підтвердив закон збереження маси речовини.
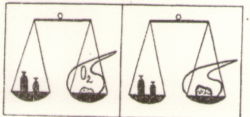 А).ДОСЛІД ІЗ ВІДКРИТОЮ РЕТОРТОЮ Б,) ДОСЛІД ІЗ ЗАКРИТОЮ РЕТОРТОЮ
А).ДОСЛІД ІЗ ВІДКРИТОЮ РЕТОРТОЮ Б,) ДОСЛІД ІЗ ЗАКРИТОЮ РЕТОРТОЮ
А.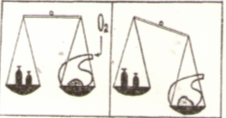 Б.
Б.



В 1789 р. Закон збереження маси незалежно від М.В.Ломоносова відкрив французький хімік Антуан Лоран Лавуазьє, який довів, що під час реакції залишається сталою не лише загальна маса речовини, а й маса кожного з елементів речовини, що взаємодіють.

![]()
![]()
![]()
![]()
![]()
![]() Fe + S → FeS; S + O2 → SO2
Fe + S → FeS; S + O2 → SO2
![]()
![]()
![]()
![]() + = + →
+ = + →
![]()
![]()
![]()
![]() 56 + 32 = 88 32 + 16×2 = 64
56 + 32 = 88 32 + 16×2 = 64
88 = 88 64 = 64
ХІМІЧНІ РЕАКЦІЇ
ХІМІЧНА РЕАКЦІЯ – ЦЕ ВЗАЄМОДІЯ МІЖ РЕЧОВИНАМИ, ВНАСЛІДОК ЧОГО УТВОРЮЮТЬСЯ НОВІ РЕЧОВИНИ З НОВИМИ ВЛАСТИВОСТЯМИ
ВЗАЄМОДІЯ ЗАЛІЗА ТА СІРКИ
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() + →
+ →
![]()
![]() Fe + S → FeS
Fe + S → FeS
ДО РЕАКЦІЇ ПІСЛЯ РЕАКЦІЇ
ВИХІДНІ РЕЧОВИНИ(РЕАГЕНТИ) ПРОДУКТ РЕАКЦІЇ
|
ФІЗИЧНІ |
РЕЧОВИНИ |
||
|
ЗАЛІЗО(Fe) |
СІРКА (S ) |
ФЕРУМ(II) СУЛЬФІД (FeS) |
|
|
Агрегатний стан |
Твердий |
Твердий |
Твердий |
|
Колір |
Сріблясто - сірий |
Жовтий |
Чорний |
|
Запах |
Відсутній |
Відсутній |
Відсутній |
|
Смак |
Відсутній |
Відсутній |
Відсутній |
|
Блиск |
Має блиск |
Блиск відсутній |
Блиск відсутній |
|
Електропровідність |
Проводить струм |
Електроізолятор |
Відсутня |
|
Магнітність |
Намагнічується |
Не намагнічується |
Не намагнічується |
|
Пластичність |
Пластичний |
Крихка |
Крихкий |
|
Відношення до води |
Не розчиняється, важчий за воду |
Не розчиняється, легша за воду |
Не розчиняється, тоне у воді |
Під час хімічних реакцій властивості атомів та молекул вихідних речовин змінюються з утворенням нових речовин з новими властивостями
2Ca + O2 → 2 CaO;
MgSO4 + 2HNO3 → Mg(NO3)2 + H2O;
2Al + 6 HCl → 2AlCl3 + 3 H2↑;
ОКСИГЕН.
ОКСИГЕН - ХІМІЧНИЙ ЕЛЕМЕНТ
Хімічний знак – О
Латинська назва – Оксигеніум
Національна назва - Оксиген
Вимова – О
Валентність – II ( двовалентний)
В періодичній системі хімічних елементів має порядковий номер 8, заряд ядра атома Оксигену +8; атом Оксигену має 8 електронів.
Знаходиться в 2 періоді; VI групи, головної підгрупи
Відносна атомна маса -16
 Оксиген входить до складу води, кислот, основ, оксидів,солей, мінералів, гірських порід. Оксиген (від слова Оxygenium – «той, що народжує вогонь») – це неметалічний елемент, оскільки він утворює прості речовини які є неметалами. Оксиген – один із найпоширеніших елементів у природі. Оксиген утворює дві прості речовини: Кисень O₂ та Озон О₃;
Оксиген входить до складу води, кислот, основ, оксидів,солей, мінералів, гірських порід. Оксиген (від слова Оxygenium – «той, що народжує вогонь») – це неметалічний елемент, оскільки він утворює прості речовини які є неметалами. Оксиген – один із найпоширеніших елементів у природі. Оксиген утворює дві прості речовини: Кисень O₂ та Озон О₃;
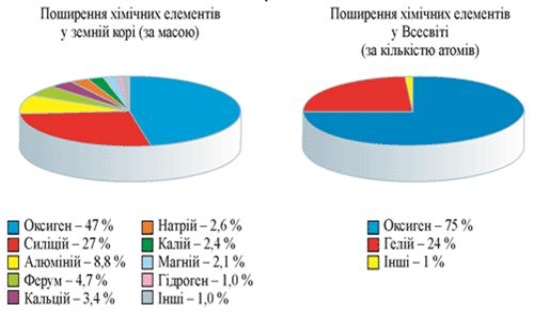
ПОШИРЕНІСТЬ ОКСИГЕНУ В ПРИРОДІ
Гідросфера містить 86% - 89% Оксигену за масою
В атмосфері міститься 23% Оксигену за масою
У вигляді сполук з іншими елементами він складає47% від маси земної кори(літосфери)
До 50% - 85% ваги живих і рослинних тканин складає Оксиген



КИСЕНЬ – ПРОСТА РЕЧОВИНА
 Хімічна формула простої речовини кисню – О2.
Хімічна формула простої речовини кисню – О2.
Відносна молекулярна маса кисню: Mr(O2) = 32;
Молярна маса: M(O2) = 32г/моль.
Кисень був відкритий у другій половині 18 ст.Цей газ першим добув шведський хімік Карл Вільгельм Шеєле в 1772 році, а в 1774 році – кисень добув англійський хімік Джон Бойнтон Прістлі. В 1775 році французький вчений Антуан Лорен Лавуазьє дослідив кисень і дав йому назву «oxygen».
Кисень – газ без кольору і запаху, трохи важчий за повітря; розчинність у воді невелика (0,004% при 20С°); температура плавлення -218С°, температура кипіння -192,98 С.°
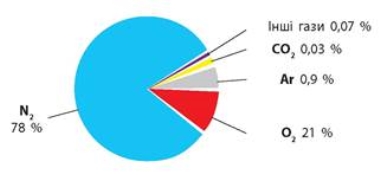
Поширення кисню в повітрі
 ДОБУВАННЯ КИСНЮ
ДОБУВАННЯ КИСНЮ
Кисень добувають лабораторним та промисловим способами. В лабораторії кисень добувають розкладанням складних оксигеновмісних сполук. Такі реакції називаються реакціями розкладу.
РЕАКЦІЯ РОЗКЛАДУ – ЦЕ РЕАКЦІЯ КОЛИ З ОДНІЄЇ СКЛАДНОЇ РЕЧОВИНИ УТВОРЮЄТЬСЯ ДЕКІЛЬКА ПРОСТИХ ЧИ СКЛАДНИХ РЕЧОВИН.
 Лабораторний спосіб одержання кисню:
Лабораторний спосіб одержання кисню:
2 H2O → 2H + O2↑;
KMnO4 → K2MnO4 + MnO2 + O2↑;
2KClO3 → 2KCl + O2↑;
![]() MnO2- каталізатор
MnO2- каталізатор
2H2O2 → 2H2O + O2↑;
КАТАЛІЗАТОР – речовини, що прискорюють швидкість хімічних реакцій, але самі участі в них не беруть.
Промисловий спосіб одержання кисню
а) з повітря
б) електролізом води: 2 H2O → 2H + O2↑;

 ЗАСТОСУВАННЯ КИСНЮ
ЗАСТОСУВАННЯ КИСНЮ




![]()

![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()

ХІМІЧНІ ВЛАСТИВОСТІ КИСНЮ

 Реакції окиснення – це взаємодія речовин з киснем.
Реакції окиснення – це взаємодія речовин з киснем.
Швидке окиснення – це горіння. Горіння – це процес, який супроводжується виділенням великої кількості теплоти та світла.
УМОВИ ВИНИКНЕННЯ ГОРІННЯ:
* доступ кисню;
*довільне займання;
*досягнення температури займання речовини;
УМОВИ ПРИПИНЕННЯ РЕАКЦІЇ ГОРІННЯ:
* припинення доступу кисню;
* зниження температури нижче точки займання речовини;



+ →
S + O2 → SO2;
2Ca + O2 → 2 CaO;
ОКСИД – це складна речовина, яка складається з двох елементів, одним з яких є Оксиген.
НАЗВА ОКСИДУ: назва елемента, (змінна валентність), оксид.
Наприклад: SO2 – Сульфур( IV)оксид; CaO-Кальцій оксид;
K2O- Калій оксид; Fe2O3 –Ферум(III ) оксид;
 РЕАКЦІЯ СПОЛУЧЕННЯ – це хімічна реакція між двома чи більше простих та складних речовин, внаслідок чого утворюється одна складна речовина.
РЕАКЦІЯ СПОЛУЧЕННЯ – це хімічна реакція між двома чи більше простих та складних речовин, внаслідок чого утворюється одна складна речовина.
НАПРИКЛАД: 2Cu + O2 →2CuO; Fe + S → FeS;
В реакції окиснення (горіння) з киснем вступають і складні речовини.
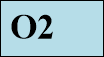


+ →
CH4 + 2 O2 → CO2 +2 H2O;
 Метан взаємодіє з киснем, утворюючи Карбон(IV) оксид та воду.
Метан взаємодіє з киснем, утворюючи Карбон(IV) оксид та воду.
ПРИКЛАДИ ГОРІННЯ СКЛАДНИХ РЕЧОВИН:
2H2S + 3O2 →2H2O + 2 SO2;
 2C2H6 + 7O2 →4CO2 + 6H2O;
2C2H6 + 7O2 →4CO2 + 6H2O;
![]()
![]()
![]()

 СОЛЕТВОРНІ НЕСОЛЕТВОРНІ
СОЛЕТВОРНІ НЕСОЛЕТВОРНІ
ОСНОВНІ КИСЛОТНІ АМФОТЕРНІ

 ОСНОВНІ ОКСИДИ КИСЛОТНІ ОКСИДИ АМФОТЕРНІ ОКСИДИ
ОСНОВНІ ОКСИДИ КИСЛОТНІ ОКСИДИ АМФОТЕРНІ ОКСИДИ


 ВОДА.
ВОДА.
ФІЗИЧНІ ВЛАСТИВОСТІ ВОДИ:



![]()
![]()
![]()



![]()
![]()
![]()
![]()


МОЛЕКУЛЯРНА ФОРМУЛА ВОДИ: Н2О
![]() СТРУКТУРНА ФОРМУЛА ВОДИ: Н –О
СТРУКТУРНА ФОРМУЛА ВОДИ: Н –О
Н
ХІМІЧНІ ВЛАСТИВОСТІ ВОДИ:
а) вода взаємодіє з активними металами, утворюючи при цьому основи:
2H2O + 2Na → 2NaOH +H2↑;
2H2O + 2K → 2KOH +H2↑;
2H2O + Ca → Ca(OH)2 +H2↑;
2H2O + Mg → Mg(OH)2 +H2↑;
NaOH – Натрій гідроксид; KOH - Калій гідроксид;
Mg(OH)2 – Магній гідроксид; Ca(OH)2-Кальцій гідроксид;
 б) вода взаємодіє з основними оксидами (оксиди металів), утворюючи при цьому основи:
б) вода взаємодіє з основними оксидами (оксиди металів), утворюючи при цьому основи:
H2O + Na2О → 2NaOH;
H2O + K2О → 2KOH;
H2O + CaО→ Ca(OH)2;
H2O + MgО → Mg(OH)2;
в) вода взаємодіє з кислотними оксидами (оксиди неметалів), утворюючи при цьому кислоти:
H2O + SО2→ H2SO3;
H2O + SО3 → H2SO4;
H2O + CO2→ H2CO3;
3 H2O + P2O5 → 2H3PO4;
H2SO3 – Сульфітна кислота; H2SO4 – Сульфатна кислота;
H2CO3 – Карбонна кислота; 2H3PO4 – Ортофосфатна кислота;
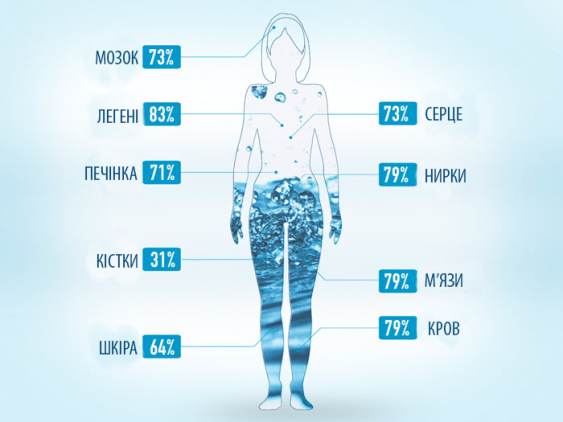
ВМІСТ ВОДИ В ОРГАНІЗМІ ЛЮДИНИ
ВОДА – РОЗЧИННИК
Вода розчиняє багато речовин і є найпоширенішим розчинником. У воді розчиняються тверді, рідкі та газоподібні речовини.
ВОДА – це розчинник.
РОЗЧИНЕНА РЕЧОВИНА –це речовина, що розчинилася у воді(кухонна сіль, цукор, спирт, оцет, вуглекислий газ та інші).
РОЗЧИН – це розчинник і розчинена речовина( вода і спирт; вода і цукор).
МАСОВА ЧАСТКА РОЗЧИНЕНОЇ РЕЧОВИНИ
m(реч.) – маса розчиненої речовини в розчині –г;
m(розч.) – маса розчину –г;
W – масова частка розчиненої речовини в розчині;
W = ![]() × 100% або W =
× 100% або W = ![]() ;
;
m(реч.) = ![]() ; або m(реч.) = W × m(розч.) ;
; або m(реч.) = W × m(розч.) ;
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ:
Задача 1. Скільки потрібно взяти кухонної солі та води для приготування 5% розчину масою 200г?
Коментар до задачі: Записуємо, що дано і що потрібно знайти. В задачі дано масову частку розчиненої речовини та масу розчину. Згідно формули на обчислення маси речовини, знаходимо масу солі. Весь розчин становить 200г, то від маси всього розчину віднімаємо масу солі і знаходимо масу води, яку необхідно взяти для приготування розчину.
Дано:
![]() m(розч.)= 200г m(реч.) =
m(розч.)= 200г m(реч.) = ![]() ; m(реч.) =
; m(реч.) = ![]() = 10г;
= 10г;
![]() W =5% m(води) – 200г – 10г =190г;
W =5% m(води) – 200г – 10г =190г;
m(солі) - ?
m(води) - ? Відповідь: m(солі)=10г; m(води)=190г;
Задача 2. До 275 г води добавили 125г цукру. Обчислити масову частку цукру в утвореному розчині.
Коментар до задачі: Записуємо, що дано і що потрібно знайти. В задачі дано масу розчиненої речовини та масу води. Потрібно знайти масову частку розчиненої речовини. Записуємо формулу обчислення масової частки розчиненої речовини. За даною формулою маса речовини відома(125г), а маси розчину немає. Знаходимо масу розчину(до маси цукру додаємо масу води). У формулу на обчислення масової частки розчиненої речовини підставляємо отримані дані.
Дано:
![]() m(цукру)= 125г W =
m(цукру)= 125г W = ![]() × 100%
× 100%
![]() m(Н2О)= 275г m(розчину)= 125г + 275г =400г
m(Н2О)= 275г m(розчину)= 125г + 275г =400г
W = ? W = ![]() × 100% =
× 100% = ![]() × 100% = 31,25%
× 100% = 31,25%
Відповідь: W =31,25%;
Задача 3. До 25% розчину спирту масою 500г долили 120г води. Обчислити масову частку спирту в утвореному розчині.
Коментар до задачі: Записуємо, що дано і що потрібно знайти. В задачі дано масову частку спирту, масу розчину, в якому розчинений спирт та масу води, яку долили до розчину. Потрібно знайти масову частку спирту в утвореному розчині. Записуємо формулу обчислення масової частки розчиненої речовини. За даною формулою маса речовини невідома, а маси утвореного розчину немає. Знаходимо масу розчину(до маси розчину додаємо масу води). За формулою на обчислення маси речовини знаходимо масу спирту в розчині масою 500г. У формулу на обчислення масової частки розчиненої речовини підставляємо отримані дані.
Дано:
![]() m(розчин)= 500г W =
m(розчин)= 500г W = ![]() × 100%
× 100%
m(Н2О)= 120г m(спирту) = ![]() =
= ![]() = 125г
= 125г
![]() W - ? m(розчин)= 500 г + 120 г =620 г
W - ? m(розчин)= 500 г + 120 г =620 г
W = ![]() × 100%; W =
× 100%; W = ![]() × 100% = % =20%
× 100% = % =20%
Відповідь: W(спирту) = 20%.
ЛАБОРАТОРНИЙ ПОСУД


ПЛОСКОДОННА КОЛБА ХІМІЧНА СКЛЯНКА


МІРНИЙ ЦИЛІНДР ЛІЙКА


СТУПКА З ТОВКАЧЕМ ТЕХНІЧНІ ТЕРЕЗИ


СПИРТІВКА ПРОБІРКА ХІМІЧНА


ПРОМИВАЛКА ШТАТИВ ДЛЯ ПРОБІРОК


ПРОБІРКОТРИМАЧ ЛОЖКА ДЛЯ СПАЛЮВАННЯ РЕЧОВИН
1


про публікацію авторської розробки
Додати розробку