Міждисциплінарне заняття (органічна хімія + біологія) з теми "Білки"
Систематизувати, закріпити й поглибити знання про особливості білкових речовин, знати їхній склад, будову, властивості; вміти розкрити функції білків на прикладах; знати кольорові реакції на білки; вміти довести амфотерні властивості; мати уявлення про біологічний синтез білків;знати значення білків у житті людини.
Міждисциплінарне заняття ЗМ 7.3 Білки
|
Хід міждисциплінарного заняття
1 Організаційна частина Перевірка присутності студентів на занятті.
2 Повідомлення теми, формування теми та основних завдань 1 Склад білків 2 Класифікація і будова білка 3 Властивості білків. Якісні реакції 4 Функції білків 5 Споживання і значення білків
Викладач хімії Серед усіх речовин органічної природи білки займають особливе місце. Вони є найскладнішими і найважливішими органічними сполуками. Біологічна роль білків надзвичайно велика: вони складають основну масу протоплазми і ядра клітин, з яких побудовані всі живі організми. Ось чому їх вважають основними носіями життя. Вперше з вичерпною ясністю роль білків у життєвих явищах визначив Ф.Енгельс. У своїй відомій роботі «Анти-Дюрінг» він писав: «Життя є спосіб існування білкових тіл…». Викладач біології «У всіх рослинах і тваринах присутня якась речовина, яка, без сумніву, є найважливішою зі всіх відомих речовин живої природи і без якої життя було б на нашій планеті неможливе». Так писав ще в 1838 році голландський біохімік Жерар Мюльдер, який вперше відкрив існування білкових тіл і сформулював свою теорію протеїну. Слово «протеїн» (білок) походить від грецького слова «протейос», що означає «той, що займає перше місце». І дійсно, все живе на землі містить білки. Вони складають близько 50% сухої ваги тіла всіх організмів. Викладач хімії Проблемні питання:
4 Актуалізація опорних знань Актуалізація опорних знань буде проведена на різних етапах заняття. Це буде поєднання внутрішніх зв’язків дисципліни Органічна хімія з вивчення нового матеріалу та детальним повторенням базових знань з Біології.
5 Вивчення нового матеріалу
5.1 Склад білків. (Викладач хімії)
З курсу біології ви знаєте, що білки – це основа життя, вони беруть участь у обміні речовин, забезпечують розмноження і ріст живих організмів. Давайте пригадаємо:
Питання: Які сполуки називають полімерами? Відповідь: це високомолекулярні речовини, молекули яких складаються з великої кількості структурних одиниць (елементарних ланок). Як називають низькомолекулярні речовини, з яких утворюється полімер? Відповідь: це мономер (елементарна ланка, яка повторюється n разів у молекулі полімеру) Яка реакція призводить до утворення полімерів? Відповідь: полімеризація або поліконденсація. Яка відмінність між полімеризацією та поліконденсацією? Відповідь: при поліконденсації крім полімеру утворюється побічний продукт
Отже, що ж таке білки як найбільш складні природні речовини?
Білки – це високомолекулярні сполуки біологічного походження (біополімери), що побудовані із залишків -амінокислот.
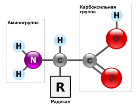
Питання: Які сполуки називають амінокислотами? Відповідь: Це органічні сполуки, що містять карбоксильну та аміногрупу. Загальна формула амінокислот має вигляд:
Питання: За якими ознаками класифікують амінокислоти? Відповідь:
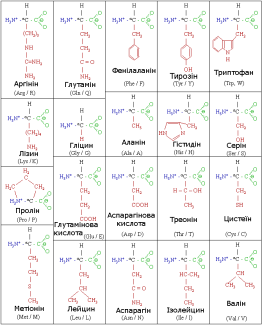
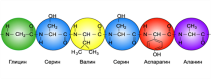
Відомо більше 400 амінокислот, зокрема в тканинах живих істот трапляється лише понад 100 амінокислот. Однак до складу білків входять лише 20, які зустрічаються майже в усіх білках. Двадцять амінокислот, які входять до складу білків, називають основними, для того, щоб відрізнити їх від інших амінокислот, також присутніх в організмах, але не в складі білків. В таблиці наведено повні та скорочені назви основних амінокислот.
Назви та формули основних амінокислот та їхні скорочені позначення:
Зокрема, амінокислоти поділяють на замінні та незамінні.
Білки, які містять усі незамінні амінокислоти, називають повноцінними, на відміну від неповноцінних, до складу яких не входять окремі незамінні амінокислоти.
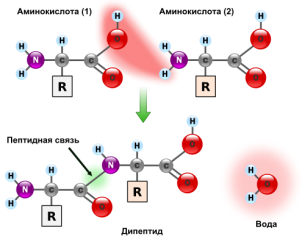
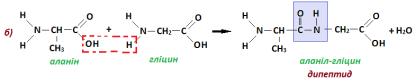
Таким чином, мономерами для утворення білків є амінокислоти. Залишки молекул амінокислот у складі білків сполучені між собою міцним ковалентним зв’язком, який виникає між карбоксильною групою однієї амінокислоти та аміногрупою іншої. Цей тип зв’язку називають пептидним (від грец. пептос - зварений). Завдяки такому міцному зв’язку утворюється сполука, яка складається із залишків двох амінокислот – дипептид.
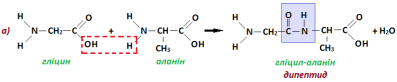
Молекули двох амінокислот можуть сполучатись двома різними способами а) і б):
З трьох різних амінокислот можуть утворитися шість різних трипептидів, до кожного з яких двома способами може приєднатися залишок четвертої амінокислоти. Структури, які складаються з великої кількості залишків амінокислот (від 6-10 до декількох десятків), належать до поліпептидів:
Ускладнення структури, що призводить до утворення білка можна подати простою схемою: амінокислота дипептид поліпептид білок
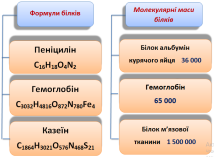
Поліпептиди з високою молекулярною масою (від 6000 до кількох мільйонів) називають білками. Вони складаються з одного або декількох поліпептидних ланцюгів і можуть містити до кількох тисяч амінокислотних залишків. Усі білки містять п’ять основних елементів: Карбон, Оксиген, Гідроген, Нітроген, Сульфур, а також невеликі кількості Фосфору, Йоду, Феруму. Молекулярна маса білків складає від 6500 (інсулін) до 32 мл. (білок вірусу грипу).
Для порівняння: молекулярна маса спирту -46, оцтової кислоти – 60, бензолу – 78. Для кожного білка послідовність сполучення амінокислот різна, і це має важливе життєве значення. Різні комбінації лише 20 амінокислот забезпечують нескінченну різноманітність білкових молекул (число можливих варіантів – близько 21018). Зокрема, в організмі людини трапляється понад 6 млн. типів білкових молекул.
Викладач біології Утворення білків можна порівняти з будовою слова (сир - сон). Змінюється одна буква – утворюється нове слово. Змінюється одна з 20 амінокислот – утворюється новий білок.
Питання: Отже, у чому причина різноманітності білків? Відповідь: причина в різній комбінації 20 основних амінокислот.
Питання: Як ви думаєте, з чого утворюється в організмі білок? (ДНК – і-РНК –білок.)
Питання: Завдяки чому всі організми є універсальними ? Відповідь: всі живі організми утворені за єдиним генетичним кодом.
Генетичний код – встановлення відповідності між певною послідовністю нуклеотидів ДНК і амінокислотами у молекулі білка. Всі живі організми мають клітинну будову, та з чого побудовані клітини? - Звичайно з білків. Завдяки генетичному коду інформація, закодована в ДНК через інформаційну РНК переноситься до рибосоми (місце синтезу білка). А далі, за допомогою т-РНК перетворюється в інформацію про амінокислотний склад майбутнього білка. Так утворюється унікальна для кожного білка послідовність амінокислот. Тобто первинна структура білкової молекули. Відеосюжет «Біосинтез білка»
Знаючи масу білка можна довідатись кількість АК, що входять до нього: Мбілка = nак х 100
Також, можемо знайти і довжину білка: lбілка = nак х 0,35 нм Час приєднання 1 амінокислоти становить 0,2 сек. Тому в нашому організмі за 2 хв. Відбувається синтез білка з 100 АК.
Викладач хімії
Білкова молекула стабілізується різними зв’язками.
У результаті утворення цих зв’язків формується складноорганізована молекула білка.
5.2 Класифікація і будова білка (Викладач біології)
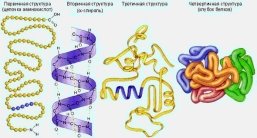
При описі будови білків розрізняють чотири рівні їхньої морфологічної організації – чотири структури: первинна, вторинна, третинна і четвертинна.
Первинна структура білка – довгий поліпептидний ланцюг із чіткою послідовністю залишків амінокислот. Саме вона визначає його біологічну функцію. Заміна однієї-єдиної амінокислоти в молекулі даного білка може різко змінити його функцію і призвести до серйозних порушень у роботі всього організму.
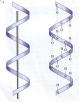
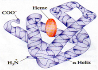
Вторинна структура – це певна просторова форма, якої набуває поліпептидний ланцюг (здебільшого це спіраль). Звичайно білкова молекула нагадує розтягнену пружину. Це так звана - спіраль, яка стабілізується безліччю водневих зв’язків між карбоксильними групами і аміногрупами, що розташовані на сусідніх витках спіралі. Повністю - спіральну конформацію має, наприклад, білок кератин. Це структурний білок волосся, вовни, нігтів, пазурів, дзьоба, пір’я і рогів, який входить також до складу шкіри хребетних. Твердість і розтяжність кератину варіюються залежно від кількості дисульфідних містків між сусідніми поліпептидними ланцюгами.
- Шар, або складчастий, - це інший тип вторинної структури. Білок натурального шовку фіброїн має саме таку структуру. У ній поліпептидні ланцюги розташовані паралельно. Але сусідні ланцюги за своїм напрямком розміщені протилежно один одному, тобто є антирівнобіжними. Структура стабілізується також здебільшого водневими зв’язками й називається, в цілому, складчастим шаром. Рис. 6. b-структура (а) – антипаралельна; (b) – паралельна
Третинна структура – просторове ускладнення спіралі в клубок (глобулу). Третинна структура підтримується іонними, водневими, дисульфідними зв’язками, при цьому гідрофобні ланцюги сховані всередині молекули, а гідрофільні, навпаки, виставлені назовні.
Четвертинна структура білків виникає, коли об’єднуються кілька глобул. Наприклад, молекула гемоглобіну складається з чотирьох залишків молекул білка міоглобіну.
Питання: Отже, у чому полягає причина унікальності білків? Відповідь: унікальність білків пояснюється їхньою будовою, якої не має жодна інша сполука. Єдиної класифікації білків не існує. Різні автори в основу класифікації кладуть різні принципи. Пробували класифікувати білки за походженням, за їх фізико-хімічними властивостями, за функціями та хімічним складом. Звідси, за походженням розрізняють: білки тваринні, рослинні, бактеріальні; за місцем знаходження: білки крові, мозку, м'язів тощо. Класифікація білків за особливостями хімічної будови
Загальноприйнятою є класифікація білків за хімічною структурою компонентів, що входять у склад білкової молекули. Усі білки діляться на 2 групи: прості (протеїни) й складні (протеїди). Протеїни (прості) – містять лише залишки амінокислот. Протеїди (складні) – місять ще й залишки молекул небілкової природи (вуглеводів, нуклеїнових кислот, ортофосфатну кислоту, барвникові речовини тощо). Прості білки ( протеїни) при гідролізі розщеплюються тільки до амінокислот. Як було сказано вище, ці білки при гідролізі розщеплюються до амінокислот, але разом із тим відрізняються між собою набором амінокислот, їх кількісним та якісним складом, що в кінцевому результаті надає їм відмінних фізико-хімічних та біологічних властивостей. Розглянемо представників простих білків. Складні білки (протеїди) – це двокомпонентні білки. Вони складаються з будь-якого простого білка та небілкового компонента, який називається простетичною групою. Складні білки поділяються на підгрупи, залежно від будови небілкового компонента.
Класифікація білків за формою молекул
Форма молекул білка, як було сказано при розгляді їх структурної організації, залежить від розміру поліпептидних ланцюгів і їх кількості, від характеру розміщення у просторі (їх упаковки). Поліпептидні ланцюги в молекулах білків можуть скручуватися у вигляді спіралей, дисків або набувати витягнутих форм (видовжених) у вигляді різних джгутів. Тому за формою молекул білки діляться на глобулярні й фібрилярні.
Глобулярні білки. Значна частина розчинних білків, наприклад, альбуміни і глобуліни сироватки крові, білки молока, яєць та інші, мають заокруглену форму, що наближається до еліпсоїдної. Такі білки були названі глобулярними (globulus– кулька з лат.).
5.3 Властивості білків. Якісні реакції. (Викладач хімії)
Фізичний стан білкових речовин різноманітний. Здебільшого це тверді аморфні порошки білого або жовтуватого кольору. Наприклад білки шерсті та шовку – це міцні волокна. Деякі білки одержані у вигляді кристалів (гемоглобін крові). Багато білків є в’язкими рідинами. За фізичним станом білки умовно можна поділити на 4 групи: 1 Фізичний стан: а) рідкі – молоко, б) напіврідкі – м’язи, в) тверді (білі аморфні порошки) – нігті, кігті, волосся, шерсть. г) в’язкі рідини або драглі – яйце, око.
2 Розчинність: а) розчинні, б) нерозчинні У безводному спирті, ефірі та інших органічних розчинниках білки нерозчинні. Майже всі вони розчиняються в лугах, більшість – у кислотах, деякі – в дистильованій воді, у слабких водних розчинах нейтральних солей або у розчинах спирту.
3 При високій температурі всі білки згорають (СО2, Н2О, N2)
Питання: Чи мають білки певні температури плавлення та кипіння? (Відповідь: ні, бо під час нагрівання вони темніють і розкладаються, поширюючи запах паленого пір’я). 4 Білки не мають температури плавлення та кипіння, Білкові речовини нездатні плавитися і переходити в пару.
Гідроліз білків. При нагріванні білків у воді в присутності кислот або лугів (кислотно-основний гідроліз), а також при звичайних температурах під впливом ферментів (ферментативний гідроліз) білки гідролізуються до амінокислот. Гідроліз проходить поступово через ряд проміжних продуктів. Високомолекулярні білки спочатку розщеплюються до альбумоз і пептонів (суміш сполук з молекулярною масою 700-2000). Альбумози ще близько стоять до білків. Як альбумози, так і пептони не зсідаються при кип’ятінні їх розчинів; дають біуретову і ксантопротеїнову реакції. При дальшому гідролізі з пептонів утворюються ще більш прості сполуки – поліпептиди, дипептиди і, нарешті, амінокислоти. Поступовий процес гідролітичного розкладу білків можна зобразити такою схемою: Білок альбумози пептони поліпептиди дипептиди амінокислоти.
Гідроліз білків має велике біологічне значення. Білок нездатний дифундувати через стінки кишок і проникати в кров. Тому, попадаючи в шлунок та кишечник під впливом протеолітичних ферментів він розщеплюється на розчинні амінокислоти. Які легко потрапляють у кров.
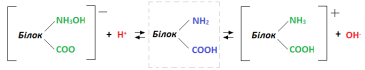
Амфотерність білків Властивості білків визначаються набором амінокислот, в яких наявні певні функціональні групи та залишки. Білки, як і амінокислоти, є амфотерними сполуками. Амфотерність їх зумовлюється присутністю на одному кінці молекули вільної карбоксильної групи, а на другому – аміногрупи. За рахунок електролітичної дисоціації NH2 і СООН груп білки проявляють властивості амфотерних сполук: у кислому середовищі білок дисоціює як луг, а в лужному – як кислота.
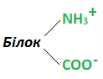
Дисоціація атома Гідрогену дає негативно заряджений білковий йон (аніон), а відщеплення гідроксилу гідратованої аміногрупи – позитивно заряджений білковий йон (катіон). У нейтральному середовищі молекули білка мають вигляд біполярних молекул:
Денатурація білка
Питання: Пригадайте варене яйце чи скисле молоко. Чи можна повернути їх у первісний стан? Ні, бо це необоротний процес.
Руйнування вищих структур білкової молекули при збереженні первинної структури та втрати білком нативних фізико-хімічних та біологічних властивостей називається денатурацією. Усе ж у деяких випадках денатурація не є абсолютно незворотним процесом, тобто при усуненні денатуруючого чинника може наставати відновлення біологічних властивостей білка. Процес відновлення фізико-хімічних і біологічних властивостей денатурованого білка називається ренатурацією або ренативацією.
Процес руйнування первинної структури білків завжди необоротний, він називається деструкцією.
Чинники денатурації:
В основі денатурації лежить руйнування зв'язків, що стабілізують вищі структури білка (четвертинна, третинна, вторинна). Як наслідок, відбувається розрив поліпептидного ланцюга і набування ним форми невпорядкованого клубка та випадання в осад. Денатурацію можна викликати як хімічними, так і фізичними чинниками. До останніх можна віднести температуру, тиск, ультразвук, іонізуюче випромінювання. Найбільш вивченою є температурна, або теплова денатурація. Більшість білків зазнає денатурації в розчинах при температурі, вищій 50-60 °С. Отже, унаслідок денатурації білок більше не може виконувати свою біологічну функцію.
Білки дають ряд характерних кольорових реакцій, за допомогою яких їх розпізнають. Суть цих реакцій полягає в тому, що при дії деяких речовин білки утворюють забарвлені в певні кольори розчини або осади. Найважливішими є ксантопротеїнова і біуретова реакції. Ксантопротеїнова реакція. В пробірку вводять 3 краплі розчину білку і 1 краплю нітратної кислоти. З’являється білий осад. При нагріванні реакційної суміші осад стає яскраво-жовтим. Суміш охолоджується і добавляють 2 краплі їдкого натру. При цьому жовте забарвлення переходить в яскраво-оранжеве. Ця реакція зумовлена наявністю в білку ароматичних амінокислот. Біуретова реакція. В пробірку поміщають 2 краплі розчину білку і краплю розчину лугу і 1 краплю розчину купруму сульфату. Рідина забарвлюється у фіолетовий колір. Ця реакція пов’язана з наявністю пептидних угрупувань.
5.4 Функції білків (Викладач біології)
1) каталітична полягає в тому, що білки (ферменти) прискорюють біохімічні реакції в процесі обміну речовин; 2) транспортна – перенесення по крові гормонів, газів (гемоглобін і міоглобін), заліза, залишків жирних кислот (альбумін крові), та ін.; активний транспорт багатьох речовин через клітинну мембрану; 3) структурна – білки у тварин утворюють рогові покриви, є основою сполучення між клітинами (на структурний білок сполучної тканини колаген припадає третина всіх білків організму за масою); 4) захисна функція білків полягає у синтезі антитіл у відповідь на появу чужорідних молекул (антитіла зв’язують і знешкоджують їх); одним із білків, що виконує таку функцію є білок інтерферон, що знешкоджує чужорідну нуклеїнову кислоту; токсини (наприклад ботулізму); 5) регуляторна – регулювання швидкості біохімічних процесів (гормони гіпофізу, підшлункової залози, які є білками або похідними амінокислот); нейроолігопептиди забезпечують в головному мозку складні психічні і фізіологічні явища (пептид страху, пам’яті тощо); білки є регуляторами зчитування спадкової інформації з ДНК; рецепторами мембран, які забезпечують трансформацію і передачу в клітину інформації (гормонального сигналу); 6) рухова, яку виконують скорочувальні білки, які у всіх живих організмів побудовані і функціонують за спільним принципом, наприклад, актин і міозин у м’язовому волокні; 7) енергетична – білки можуть бути джерелом енергії для людини, так в результаті повного окиснення 1 г білка виділяється біля 17 кДж енергії, проте білки не відкладаються про запас – надмірна кількість білків, що надійшла до організму, витрачається для отримання енергії; крім того, під час розщеплення білків вивільняється токсичний продукт – аміак, на детоксикацію якого витрачається енергія. Половина з амінокислот, які утворюють білки, в організмі людини не синтезується і повинна надходити з їжею, тому використання білків як джерела енергії є для організму вимушеним, пов’язаним із незбалансованим вмістом в їжі амінокислот, необхідних для побудови білків; 8) інформаційна функція білків полягає в тому, що через білки відбувається передача генетичної інформації з покоління в покоління.
5.5 Споживання і значення білків
В організмі постійно відбувається білковий обмін. Якісь з білків розщеплюються, якісь-синтезуються, з'єднуються між собою, розпадаються, виділяючи при цьому енергію, за рахунок якої людина живе. Однак не всі білки, що надходять з їжею, цінні й перетворюються на паливо для організму. Велика частина амінокислот, особливо, приходить «з неякісної їжі», просто виводиться. Тому дуже важливо не тільки їсти білкову їжу, але і звертати увагу на її якість. Інсулін і гемоглобін - важливі для здоров'я білки, надлишок або нестача яких може призвести до страшних наслідків. Вважається, що норма для дорослої людини - від 1,0 до 1,7 г на кг ваги, однак дуже важливо враховувати особливості організму, і те, як людина живе і чим займається. Наприклад, чоловікам, які більше рухаються, виконують більш важку фізичну роботу, потрібно більше білка, ніж жінкам. Дітям же білок необхідний подвійно, так як їх організм росте, і вимагає будівельні цеглинки в належній кількості. Вагітним і годуючим мамам потрібно 2 г білка на 1 кг маси тіла, людям похилого віку – 1г. А що буде, якщо сидіти на дієті з дефіцитом білка? Роль білків в організмі настільки висока, що при їх нестачі, а тим більше при відсутності білків в їжі, відбудуться катастрофічні порушення в роботі більшості органів. Що ж станеться з організмом, якщо він буде відчувати нестачу білка? В першу чергу, не буде засвоюватися кальцій, а це значить, що кістки стають більш крихкими, порушиться процес утворення нових клітин кісток і шкіри, розвивається атрофія м'язів, шкіра почне лущитися і буде дуже суха, волосся може почати випадати, а нігті - ламатися. Крім того, сповільниться виділення гормонів і знизиться імунітет людини, порушиться робота нервової системи, може з'явитися цироз печінки, ожиріння, і, що саме важливо, трапиться збій у роботі кровотворення. На жаль, відкласти запаси білка «до кращих часів» організм не в змозі. І якщо сьогодні ви з'їли достатньо, то засвоїться рівно стільки, скільки необхідно, а решта - в утиль, і завтра все треба повторювати знову. Тому дуже важливий щоденний збалансований раціон, в якому буде присутній білок в достатній, але не надмірній кількості. Людина може отримувати білок тваринного і рослинного походження, причому пропорція їх при цьому повинна бути 2 до 1. Ми добре переварюємо рибні та молочні продукти, білок з них відмінно засвоюється, а от білки з м'яса і горіхів з бобовими - гірше. Краще засвоюється кролятина, індичка, курка, телятина, яловичина, гірше - свинина, баранина. Важливо і час, коли ви приймаєте їжу. Наприклад, найгірше білок засвоюється ввечері, краще - з шостої ранку і до полудня. Тому його рекомендують включати в меню сніданку та обіду, а вечерю робити легкою овочевою або фруктовою . Важливість ролі білків в організмі аж ніяк не означає, що можна харчуватися одними білками. Тут необхідний баланс. Якщо перегодовувати себе білками, їх надлишок, також, позначиться негативно на здоров'я: порушиться пуриновий обмін, робота печінки і нирок (посилюється їх робота і знос), травної і видільної систем. Тому так важливо саме раціональне харчування, в якому присутні і білки, і жири, і вуглеводи, то є і м'ясо, і молоко, і овочі, які допомагають білкам засвоюватися.
Підведення підсумків заняття:
Сьогодні ми всі зрозуміли? що кожен організм є індивідуальним, універсальним, тому що побудований із білків, які беруть всій початок із ядра клітини, де містяться гени. З’ясували хімічні властивості та біологічні функції білків та їх значення для організмів. Генетичний код єдиний для всіх живих організмів, які існують на Землі, а білки - це життя.
|
слайд № 1
слайд № 2
слайд № 3
Постановка проблемних питань
Бесіда, фронтальне та індивідуальне опитування
Актуалізація опорних знань
слайд № 4
Актуалізація опорних знань
слайд № 5
Актуалізація опорних знань
слайд № 6,7
Відновлення набутих знань
слайд № 8
слайд № 9
слайд № 10
слайд № 11
слайд № 12
слайд №13, 14
Проблемне питання
слайд №15
Відеосюжет
слайд №16
слайд №17
Відновлення набутих знань
слайд №18
слайд №19
слайд №20
слайд №21
слайд №22-24
слайд №25
Проблемне питання
Відновлення набутих знань
слайд №26
слайд №27
слайд №28
слайд №29
Розвиток логічного мислення
слайд №30
Розвиток логічного мислення
слайд №31
Відеодослід (творча робота студентів)
слайд №32
Відеодосліди (творча робота студентів)
Відновлення набутих знань
слайд №33-35
Самостійна робота студентів
|


про публікацію авторської розробки
Додати розробку