Презентація на тему "Нітроген і Фосфор"
Про матеріал
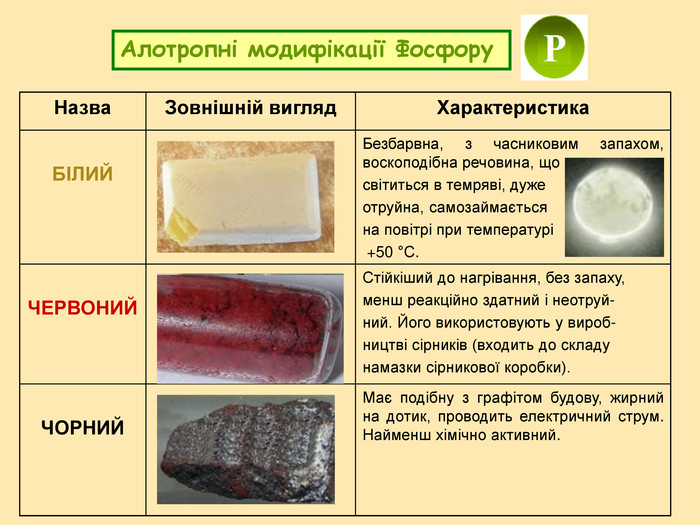
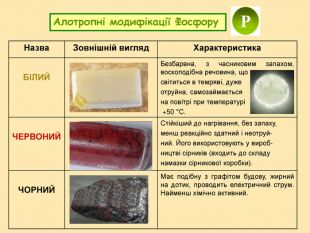
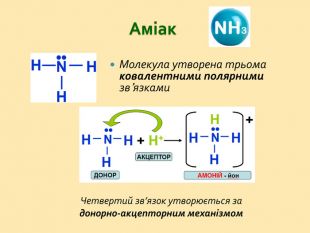
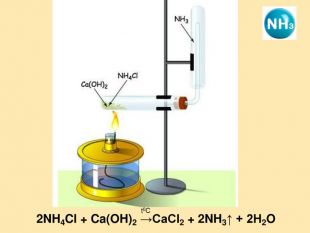
: дати характеристику елементам Нітрогену і Фосфору відповідно до їх положення в періодичній системі і будови атомів; розширити знання студентів з алотропії на прикладі алотропних модифікацій фосфору; розглянути хімічні й фізичні властивості простих речовин, утворених Нітрогеном і Фосфором; систематизувати і доповнити знання студентів про поширення Нітрогену і Фосфору у природі; показати на прикладі елементів V групи взаємозв'язок між будовою атому, положенням елементів у періодичній системі та їхніми фізичними і хімічними властивостями;
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку