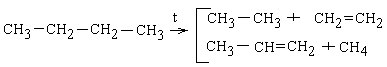
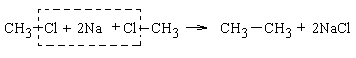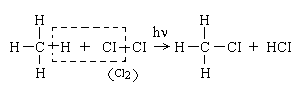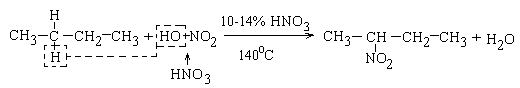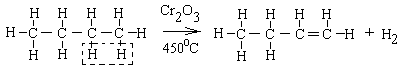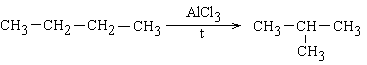Урок з теми "Насичені вуглеводні - Алкани (парафіни)"
ознайомитись з насиченими вуглеводнями, загальною формулою, вивчити гомологічний ряд алканів; вивчити хімічні властивості алканів, методи одержання алканів. Ознайомитись з природними джерелами алканів.
![]()
Алкани – це вуглеводні, найбільш багаті гідрогеном, вони насичені ним повністю. Звідси і пішла назва – насичені вуглеводні (інша назва – парафіни).
Алканами, або аліфатичними вуглеводнями, називаються сполуки з відкритим (нециклічним) ланцюгом, у молекулах яких атоми карбону сполучені між собою - зв’язком. Атоми Карбону у молекулах алканів перебувають в стані sp3 – гібридизації.
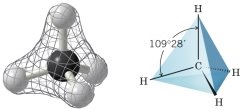
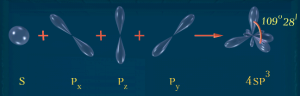
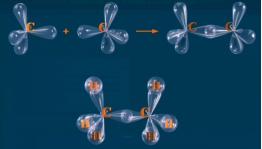
- зв’язк – зв’язок, утворений перекриванням s-, p і гібридних орбіталей вздовж осі, що з’єднує ядра двох атомів. - зв’язк має одну ділянку перекривання орбіталей, завжди одинарний (одна рисочка валентного зв’язку).


Алкани практично не розчинні у воді, тому що їхні молекули малополярні й не взаємодіють із молекулами води, вони добре розчиняються в неполярних органічних розчинниках, таких як тетрахлорметан тощо. Рідкі алкани легко змішуються один з одним.
Гомологічний ряд алканів
|
СН4 |
Метан |
ГАЗИ |
|
С2Н6 |
Етан |
|
|
С3Н8 |
Пропан |
|
|
С4Н10 |
Бутан |
|
|
С5Н12 |
Пентан |
РІДИНИ |
|
С6Н14 |
Гексан |
|
|
С7Н16 |
Гептан |
|
|
С8Н18 |
Октан |
|
|
С9Н20 |
Нонан |
|
|
С10Н22 |
Декан |
|
|
С11Н24 |
Ундекан |
|
|
С12Н26 |
Додекан |
|
|
С13Н28 |
Тридекан |
ТВЕРДІ РЕЧОВИНИ |
|
С14Н30 |
Тетрадекан |
|
|
С15Н32 |
Пентадекан |
Цікаво! Парафін, з якого виготовляють свічки, - це суміш насичених вуглеводнів переважно нерозгалуженої будови, у молекулах яких міститься від 18 до 40 атомів Карбону. Ця легкоплавка хімічно малоактивна суміш ( тем. плав. – 40-65оС ) набула різноманітного використання. Нею просочують папір і деревину, зменшують тертя деревяних деталей, чим зручно скористатися і в домашніх умовах, наприклад, щоб ящики шаф легко відкривалися і закривалися. Парафін глибокої очистки застосовується як харчова добавка, компонент багатьох косметичних препаратів.
Номенклатура та ізомерія
Алгоритм створення назви алканів розгалуженої будови
за міжнародною номенклатурою
1 За основу назви сполуки беруть назву вуглеводню, кількості карбонових атомів головного ланцюга. Головним ланцюгом вважають:
- Найдовший;
- Найскладніший (з найбільшою кількістю розгалужень). Розгалуження, які не увійшли до складу головного ланцюга, називають алкільними замісниками. За наявності двох чи декількох ланцюгів однакової довжини за головний ланцюг обирають ланцюг з найбільшою кількістю розгалужень.
2 Після встановлення головного ланцюга атоми Карбону нумерують.
- Нумерацію починають з того кінця, до якого найближче розташований будь-який алкільний замісник (принцип найменших локантів). Локант – числове або буквене позначення атома Карбону головного ланцюга, яким вказують положення замісників, кратних зв’язків та старшої функціональної групи щодо родоначальної структури (головного ланцюга). На письмі локанти розділяють комами.
- Якщо алкіли розміщені на однаковій відстані від кінців, то при виборі нумерації користуються алфавітним порядком (етил метил …..).
- Якщо на однаковій відстані від кінців розміщені однакові алкіли, то нумерацію починають з того кінця, де є більше розгалужень.
3 Назву сполуки становлять:
а) замісники, перераховані за абеткою:
- Перед назвою замісника вказують номер атома Карбону, біля якого розміщений алкіл;
- Якщо необхідно вказати кілька однакових замісників, то використовують множинні префікси: ди-, три-, тетра-, пента (їх не враховують при визначенні алфавітного порядку);
- Локанти однакових замісників записують у послідовності зростання числа і відокремлюють один від одного комами; якщо два однакові алкіли розміщені біля атома Карбону, то число ставлять двічі; локант від назви алкіла (і навпаки) відділять дефісом;
- Назву останнього алкілу пишуть разом з назвою головного ланцюга.
б) назва алкану, яка відповідає головному карбоновому ланцюгу
Раціональна номенклатура
Алкани розглядають як похідні метану, у якому атоми Гідрогену частково або повністю заміщені на залишки (R).
1 Знаходять «метановий» атом Карбону. За метан приймають атом Карбону біля якого міститься найбільша кількість замісників (алкілів).
2 Перераховують замісники (алкіли) навколо «метанового» атома Карбону за зростанням їх молекулярної маси або складності (від найпростішого до найскладнішого).
3 Кількість однакових залишків вказують грецькими чисельними.
4 Алгоритм: назва залишків (R) + метан
![]()
|
Промислові методи
|
|
1 Добування алканів з нафти і газу
Алкани належать до сполук, яких більше всього існує у природних джерелах (газ, нафта, вугілля, торф, деревина, сланець). Тому основною метою промислового добування алканів є виділення їх у вигляді суміші (фракцій) або індивідуальних сполук за допомогою, як правило, розгонки або ректифікації.
нафта НПЗ вугілля
|
|
2 Гідрування вугілля (метод Бергіуса)
Кам’яне або буре вугілля в автоклавах при 30 МПа (30 ат) у присутності каталізаторів (оксиди та сульфіди Fe, Mo, W, Ni) в середовищі вуглеводнів гідрується і перетворюється в алкани, так зване моторне паливо.
nC + (n+1)H2
5С + 6Н2 С5Н12; 4С + 5Н2 С4Н10
|
|
3 Оксосинтез алканів (метод Ф.Фішера-Г.Тропша, 1922р.)
За методом Фішера-Тропша алкани одержують з синтез-газу. Синтез-газ являє собою суміш СО і Н2 з різним співвідношенням
nCO + (2n+1)H2
3СО + 7Н2 С3Н6 + 3Н2О
|
|
4 Суха перегонка
У відносно невеликих кількостях алкани одержують за допомогою сухої перегонки чи нагрівання вугілля, сланців, деревини, торфу без доступу повітря. Приблизний склад отриманої суміші при цьому становить 60% водню, 25% метану, 3-5% етену.
|
|
Лабораторні методи
|
Реакція Вюрца – синтез алканів, що полягає у взаємодії галогеналкілів з металічним натрієм
Відома реакція Вюрца полягає у взаємодії металічного натрію або інших лужних металів з галоген алкілом і застосовується для синтезу вищих симетричних алканів:
У разі участі в реакції двох різних галогеналкілів утворюється суміш алканів, що призводить до малої ефективності методу внаслідок труднощів при розділенні утвореної суміші.
|
|
2 Розклад солей карбонових кислот:
а) електроліз (реакція Кольбе) реакція полягає в електролізі водних розчинів солей карбонових кислот
2СН3-СООК
б) термічний розклад (сплавляння солей з лугами р.Дюма) солі лужних металів карбонових кислот при сплавленні з лугом утворюють алкани
СН3СН2-СООК + КОН
|
|
3 Відновлення галеналкілів воднем або галогеноводнем
СН3-СІ + Н2 → СН4 + НСІ СН3-І + НІ → СН4 + І2
|
|
4 Відновлення спиртів СН3СН2-ОН + 2НІ → СН3СН3 + І2 + Н2О
|
|
5 Гідрування ненасичених вуглеводнів
СН3 – СН = СН2 + Н2 СН СН + 2Н2 СН3 – СН3
|
|
6 Взаємодія алюміній карбіду з водою (одержання метану)
АІ4С3 + 12 Н2О 4 АІ(ОН)3 + 3СН4
|
![]()
|
1 Галогенування
Галогенування – реакція введення галогену – СІ, - Вг, до сполуки
Хлор реагує з алканами лише при нагріванні до температури 250 - 400оС, під дією УФ - опромінення або в присутності каталізаторів. При таких умовах хлорування алканів відбувається за радикально -ланцюговим механізмом, який складається з 3-х основних стадій:
( на галоген можуть заміститися усі атоми гідрогену у алкані).
|
|
2 Нітрування (реакція Коновалова)( SR)
Нітрування – реакція введення нітрогрупи –NO2 до сполуки
При нітруванні в рідкій фазі концентрованою нітратною кислотою остання поводиться як окисник карбонових ланцюгів з одночасним їх розщепленням. Тому застосовують розведену нітратну кислоту.
Легкість заміщення гідрогену біля карбонових атомів збільшується в ряду: первинний вторинний третинний
При збільшенні карбонового ланцюга алкану утворюється суміш ізомерів нітросполук.
|
|
3 Сульфохлорування
Сульфохлорування - реакція введення сульфонілхлоридної (сульфохлоридної) групи SO2Cl до сполуки.
Алкани за звичайних умов стійкі до сульфатної кислоти. Лише “димуча” кислота (олеум) здатна сульфувати алкани, але цю реакцію важко реалізувати. Тому перспективними методами є сульфохлорування та сульфоокислення: Реакція сульфохлорування полягає у дії на алкан молекул хлору та диоксиду сульфуру в газоподібному стані. Реакція заміщення гідрогену на сульфохлоридну групу біля вторинного атома карбону протікає значно легше, ніж біля первинного. Реакція заміщення не протікає біля третинного атома карбону внаслідок просторових перешкод.
СН3 – СН3 + SO2 + Cl2 Етансульфохлорид (подальший гідроліз)
|
|
4 Сульфоокиснення
Сульфоокиснення – реакція введення сульфогрупи – SO2OH до сполуки
2СН3 – СН3 + 2SO2 + О2 етансульфокислота
|
|
5 Дегідрування
Дегідрування – реакція відщеплення водню (дегідрогенізація)
Реакції розщеплення для алканів відбуваються як по зв’язку С-Н, так і по С-С зв’язку. Дегідрування алканів застосовується для одержання ненасичених вуглеводнів (алкенів і дієнів)
|
|
6 Окиснення
При м’якому окисненні метану киснем повітря в присутності різних каталізаторів можуть бути отримані метиловий спирт, формальдегід, мурашина кислота:
2 СН4 + О2 2СН3 – ОН СН4 + О2 СН2О + Н2О 2СН4 + 3О2 2НСООН + 2Н2О
М’яке каталітичне окиснення бутану киснем повітря – один із промислових способів добування оцтової кислоти: 2 С4Н10 + 5О2 4СН3СООН + 2Н2О
|
|
7 Крекінг
Крекінгом називається термічне перетворення алканів при температурах 470-540оС. Перетворення алканів при вищих температурах (700-1000оС) називається піролізом
Розрізняють термічний і каталітичний крекінг. Головними процесами при крекінгу є розщеплення (деструкція) карбонового ланцюга по зв’язках С-С з одночасним дегідруванням, ізомеризацією та циклізацією. При цьому утворюються головним чином ненасичені вуглеводні. Будова продуктів крекінгу визначається: 1) природою вихідного алкану, 2) умовами проведення процесу (температурою, тиском, часом, природою каталізатора). Початкова температура крекінгу алканів залежить від їхньої молекулярної маси. Чим більша молекулярна маса, тим легше розщеплюються алкани. Існують такі тенденції розриву зв’язку С-С: з підвищенням температури спостерігається зміщення місця розриву до краю молекули, з підвищенням тиску вуглецевий ланцюг розщеплюється ближче до середини.
|
|
8 Піроліз
а) СН4
б) 2СН4
|
|
9 Конверсія метану
Взаємодія метану з водяною парою та вуглекислим газом (kat, t):
а) СН4 + Н2О СО + 3Н2 (каталізатори: Ni, MgO, Al2O3) б) СН4 + СО2 2СО + 2Н2
|
|
10 Ізомеризація
Ізомеризація – процес перетворення алкану нормальної будови в його ізомер з розгалуженою будовою.
Паралельно процесу утворення алкенів (крекінг) відбувається реакція ізомеризації, яка надзвичайно важлива для одержання розгалужених алканів, особливо ізобутану та ізопентану. Процес відбувається при нагріванні і в присутності каталізатора AlCl3.
Утворені за допомогою каталітичного крекінгу розгалужені алкани – цінні високооктанові бензини і сировина для одержання каучуків.
Одним з найважливіших властивостей пального є його детонаційна стійкість, тобто опірність пального до детонації (вибуху) при стисканні. Адже при стисканні робочої суміші у двигуні підвищується тиск і відповідно температура, завдяки чому окиснення вуглеводню може відбутися мимовільно, без іскри від свічок запалювання, а отже, невчасно. Детонація супроводжується шумом, характерним вихлопом, спричиняє зниження потужності, перегрівів, підвищений знос двигуна і навіть його руйнування.
Розгалужені алкани позбавлені цього недоліку. Особливо цінні вуглеводні з неоструктурою або структурою, подібною до структури ізооктану (останньому умовно присвоєно октанове число 100, а для н-гептану октанове число становить 0):
Отже, якщо бензин має марку, наприклад , 76, то це означає, що йому відповідає октанове число 76 і він проявляє таку саму детонаційну стійкість, як суміш 76% ізооктану і 24% н-гептану. Найвище октанове число (130) має 2,2,3-триметилбутан (тринтан).
Октанове число – це об’ємна доля (в %) ізооктану в суміші з нормальним гептаном, яка за своїми детонаційними властивостями еквівалентна досліджуваному паливу при стандартних умовах. Паливо для дизельних двигунів характеризується іншим показником – цетановим числом. Найцінніші палива при цьому, навпаки, складаються з алканів нормальної, нерозгалуженої будови.
|
|
|
Антрацит — це викопне вугілля, що при своєму виникненні прогрівалося найглибше, вугілля найвищої міри вуглефікації. Характеризується великою густиною і блиском. Містить 95 % вуглецю. Застосовується як тверде висококалорійне паливо (теплотворність 6800-8350 ккал/кг). Має найбільшу теплоту згоряння, але погано спалахує. Утворюється з кам'яного вугілля при підвищенні тиску й температури на глибинах близько 6 кілометрів.
Кам'яне вугілля — осадова порода, що є продуктом глибокого розкладу решток рослин (дерев'янистих папоротей, хвощів і плаунів, а також перших голонасінних рослин). Більшість покладів кам'яного вугілля було утворено в палеозої, головним чином у кам'яновугільний період, приблизно 300—350 мільйонів років тому. За хімічним складом кам'яне вугілля є сумішшю високомолекулярних поліциклічних ароматичних сполук з високою масовою часткою вуглецю, а також води й летких речовин із невеликою кількістю мінеральних домішок, які під час спалювання вугілля утворюють золу. Викопне вугілля різниться співвідношенням своїх компонентів, що визначає їхню теплоту згоряння. Низка органічних з'єднань, які входять до складу кам'яного вугілля, має канцерогенні властивості.
Уміст вуглецю в кам'яному вугіллі, залежно від його сорту, становить від 75 % до 95 %. Містить до 12 % вологи (3-4 % внутрішньої), тому має вищу теплоту згоряння порівняно з бурим вугіллям. Містить до 32 % летких речовин, завдяки чому непогано спалахує. Утворюється з бурого вугілля на глибинах бл. 3 кілометрів.
Буре вугілля — тверде викопне вугілля, що утворилося з торфу, містить 65-70 % вуглецю, бурого кольору, наймолодше з викопного вугілля. Використовується як місцеве паливо, а також як хімічна сировина. Містить багато води (43 %), і тому має низьку теплоту згоряння. Крім того, містить більшу кількість летких речовин (до 50 %). Утворюється з відмерлих органічних решток під тиском навантаження і дією підвищеної температури на глибинах бл. 1 км.

Природним газом називають суміші газів, що в стисненому стані перебувають у пустотах пористих порід, утворюючи в надрах землі газоносні пласти. Вони містяться на глибині від 800 м до кількох кілометрів, тому газ із них добувають через свердловини, самочинно природний газ дуже рідко виходить на поверхню землі.
Природний газ на 80-98% складається з метану. Решту становлять етан, пропан, бутан. Окрім зазначених парафінів, у невеликих кількостях трапляються водень, сірководень, вуглекислий газ, азот, гелій.
Природний газ безбарвний, майже вдвічі легший за повітря, погано розчинний у воді, без запаху. Природний газ – цінне джерело енергії та різноманітних органічних і неорганічних речовин.
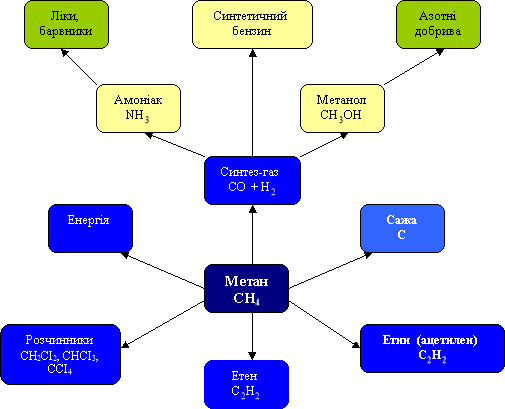
Схема використання метану
Супутній нафтовий газ – це суміш газів, що утворилася разом із нафтою й в умовах високого тиску перебуває в ній у розчиненому стані або утворює газове скупчення – «газову шапку». Склад супутнього газу подібний до складу природного газу, однак уміст метану значно менший, а його гомологів (до гексану включно) значно більше.
Приблизний склад супутнього нафтового газу
|
СН4 (МЕТАН) |
64% |
|
С2Н6 (ЕТАН) |
11% |
|
С3Н8 (ПРОПАН) |
11% |
|
С4Н10 (БУТАН) |
3% |
|
С5Н12 (ПЕНТАН) |
2% |
|
N2 (АЗОТ) |
9% |
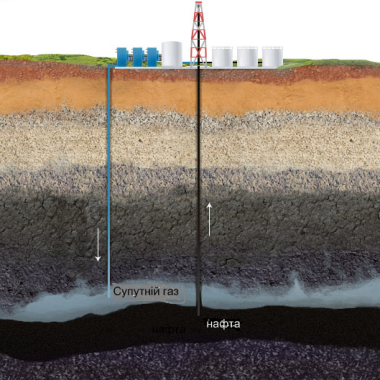
Не менш важливим за природний газ джерелом органічних сполук є нафта.
Нафта – природна рідка оліїста суміш вуглеводнів і деяких неорганічних речовин. Основними вуглеводнями нафти є парафіни, циклопарафіни, арени.
У нафті налічується до 1000 компонентів – переважно речовин органічного походження. Найбільше в складі нафти рідких вуглеводнів, а в них у розчиненому стані містяться газоподібні й тверді.
Приблизний склад нафти
|
Вуглеводневий склад |
Елементний склад |
|
Парафіни – 30-35% |
Карбон - 79-88% |
|
Циклопарафіни – 25-75% |
Гідроген – 11-14% |
|
Арени - 10-20% |
Сульфур – 0,1 – 5% |
|
|
Інші елементи – 1 – 4 % |
Нафта густа оліїста рідина зі специфічним запахом. Через відмінності в кількісному та якісному складі нафта різних родовищ може мати чорний, червоно-коричневий колір або бути практично прозорою. Нафта не розчинна у воді. Видобуту зі свердловини сиру нафту спершу зневоднюють і знесолюють, відокремлюють від механічних домішок, після чого відправляють на переробку.

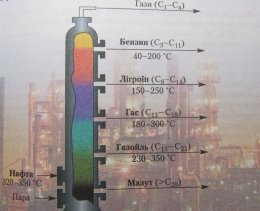
Лабораторна установка з розділення Схема промислової установки з
компонентів нафти перегонки нафти


про публікацію авторської розробки
Додати розробку