Навчальний урок-проект "Алкіни"
"Алкіни"- навчальний поект, над реалізацією якого учні працювали у домашніх групах. На уроці кожна група захищала своє завдання у формі електронної презентації та письмового опорного конспекту.
АЛКІНИ
( бінарний урок-проект у 11 класі )
вчитель хімії та біології
Доброводівського районного
комунального технічного ліцею імені О.Смакули
Барановська Тетяна Іванівна
Тема. Алкіни
Мета. Навчити учнів самостійно здобувати знання, вивчити будову етинів,sp-гібридизацію,номенклатуру,ізомерію;властивості етинів на прикладі ацетилену,розвивати логічне мислення,уміння порівнювати й аналізувати,формувати навички самоаналізу й об'єктивного оцінювання,виховувати почуття взаємодопомоги.
Тип уроку. Урок-проект
Обладнання. Ноутбук, проектор, електронна презентація «Алкіни»; картки із завданнями.
Хід уроку
I.Організаційний момент.
Доброго дня! Налаштуйтесь на роботу з хорошим настроєм. Усміхніться і намалюйте усмішку на смайлику.
II. Актуалізація опорних знань.
Мозковий штурм (слайд 2)
- Які речовини називають вуглеводнями?
- Які класи органічних сполук виділяють серед вуглеводнів?
- За якими ознаками їх класифікують?
- Які вуглеводні називають алканами?
- Які вуглеводні називають алкенами?
III. Мотивація навчальної діяльності
Напевно не раз ви спостерігали на будовах яскраві спалахи газозварювання.
(слайд 3)Сліпуче полум’я – наслідок горіння дуже цікавої речовини ,склад якої
зашифрований таким чином
Відносна густина пари цієї речовини за воднем дорівнює 13. Масова частка Карбону у цій речовині дорівнює 92,3%, Гідрогену- 7,7%.
Спробуйте розшифрувати напис. Знайдіть молярну масу речовини та її формулу. (слайд 4)
(учні розв'язують задачу: виводять молекулярну формулу і обчислюють молярну масу речовини)
Це формула вуглеводню, який належить до класу Алкіни.(слайд 5)
Оголошення теми і мети.
Сьогодні ми реалізуємо навчальний проект « Алкіни», над яким ви працювали у домашніх групах (слайд 6)
План проекту
- 1.Що таке алкіни
- 2.Будова молекул алкінів
- 3.Властивості алкінів,на прикладі ацетилену.
- 4.Добування і застосування ацетилену
- 5.Ацетилен у природі
Кожна група презентує своє завдання та записує опорний конспект на дошці(усі учні записують у зошити)
Епіграф уроку
Найкращий спосіб вивчити що-небудь - це відкрити самому (Д. Пойа) (слайд 7)
Адже,як каже китайська мудрість:
«Те,що я чую я забуваю.
Те,що я бачу,я пам'ятаю.
Те,що я роблю,я розумію».
IV. Реалізація проекту
I група ” Що таке алкіни” (слайд 8)
- Алкіни або ацетиленові вуглеводні,які в молекулі містять один потрійний карбон-карбоновий звꞌязок СС і утворюють гомологічний ряд з загальною формулою СnH2n-2,де n≥2
- Номенклатура.Назви окремих речовин утворюють з назв алканів заміною суфікса – ан на - ин чи – ін.
- Гомологічний ряд. Етин, пропін,бут-1-ин,пент-1-ин,гекс-1-ин.
- Ізомерія структурна:за видом карбонового ланцюга та місцем потрійного звꞌязку у ньому
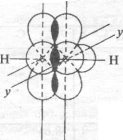
II група ”Будова молекул алкінів” (слайд 9)
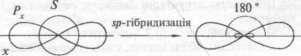
Схема утворення двох гібридних електронних хмар атома Карбону
|
|
|
|
|
|
|
|
![]()
Схема утворення сігма-зв 'язків
0,120 нм
н-с_ = с-н
180°
Геометрія молекули
III група ”Властивості алкінів” (слайди 10,11)
Фізичні властивості:С1-С3-гази,С4-С8-рідини,від С9-тверді речовини,із зростанням Мr вуглеводнів зростає температура кипіння
Ацетилен:безбарвний газ,без запаху,малорозчинний у воді,легший за повітря,tк = -84 С,вибухонебезпечний
Увага! Безпека!
Зберігають і перевозять його в балонах білого кольору (з червоним написом «А»), наповнених інертною пористою масою, наприклад, деревним вугіллям, просоченими ацетоном, у якому ацетилен розчиняється під тиском у великих кількостях. Вибухонебезпечний. Не допускати витікання з балонів на відкрите повітря !!!
При тривалому контакті ацетилену з міддю або сріблом утворюються вибухові сполуки (ацетиленіди). Тому при зберіганні не використовуються матеріали, що містять мідь чи срібло (наприклад, вентилі балонів
Хімічні властивості алкінів (слайд 12,13)
1.Горіння (яскравим кіптявим полум’ям):
2С2Н2 + 5O2 → 4СО2 +2Н2О
2. Реакції приєднання по місцю розриву
π - зв’язків відбуваються у дві стадії
а) гідрування (каталітичне): kat
С2Н2 + Н2→ С2Н4
С2Н4 + Н2→ С2Н6
б) галогенування: С2Н2 + Cl2 → С2Н2 Cl2 (дихлороетен)
С2Н2Cl 2 + Cl2 →С2Н2Cl4 (тертахлоретан)
Якісне визначення ненасичених вуглеводнів - знебарвлення бромної води та розчину калій перманганату.
IV група”Добування і застосування ацетилену”( слайди 14,15)
- 1836 р. Едмунд Деві синтезував ацетилен з вуглецю та водню
- 1860 р. Марселін Бертло повторив відкриття і назвав добутий газ ацетиленом
- 1862 р. Фрідріх Велер запропонував спосіб добування ацетилену дією води на кальцій карбід СаС2+ 2 Н2О = С2Н2 + Са(ОН)2
- Добування у промисловості: розкладання метану при t=1500 C: 2CН4 = С2Н2 + 3Н2
Увага! Безпека!
Оскільки ацетилен розчинний у воді і його суміші з повітрям вибухонебезпечні у широкому діапазоні концентрацій, його не можна збирати в газометри. Вибухає при температурі близько 5000 С.
Застосування ацетилену (слайди 16,17,18)
Грунтується на використанні теплової та світлової енергії,яка виділяється під час його горіння
Ацетиленові (карбідні) ліхтарі використовували у велосипедних і автомобільних фарах, на маяках
Спелеологи та дигери й досі застосовують карбідні ліхтарі під час мандрівок
підземними лабіринтами
Шведський інженер Нільс Густав Дален одержав Нобелівську премію за винаходження пристрою для автоматичного запалювання і гасіння ацетиленового полум‘я у джерелах світла маяків і буїв.
Під час досліджень внаслідок вибуху газу втратив зір.
- 70% ацетилену використовується для потреб органічного синтезу: виробництво ацтового альдегіду, оцтової кислоти, поліхлорвінілу, синтетичного каучуку, органічних розчинників
- 30% ацетилену використовується для автогенного зварювання і різання металів
V група”Ацетилен у природі” (слайд 19)
Ацетилен у природі не трапляється(причина у високій реакційній здатності сполуки)
Астрохімічні дослідження показали (польоти космічних кораблів «Вояджер -1, 2»), що C2H2 є на Урані та Нептуні.
За допомогою космічного зонда Гюйгенс астрономи виявили ацетилен на поверхні Титана, супутника Сатурна. Вважають, що на Титані падають ацетиленові дощі внаслідок розпаду молекул метану під дією УФ випромінювання.
V. Коригування знань учнів
1. Фронтальне опитування
1) Назвіть загальну формулу алкінів, наведіть приклади представників гомологічного ряду.
2) Які хімічні реакції характерні для алкінів?
3) Поясніть механізм утворення потрійного зв'язку і просторову будову молекули ацетилену.
4) Які закономірності спостерігаються у зміні фізичних властивостей представників гомологічного ряду ацетилену зі збільшенням кількості атомів карбону в їх молекулах?
5) Яка номенклатура алкінів
2.Навчальна частина (виконання завдань)
1) Напишіть формули вуглеводнів:
а) З-метилбутин-1; б) 2,5-диметилгексин-З; в) 4-метилгексин-2; г) З-етилгексин-2) Здійсніть перетворення:
СаСОз-СаО-СаС2-С 2Н 2--С2Н4-С2Н5С1.
3) Серед зазначених структурних формул речовин вкажіть і назвіть формули ізомерів речовини складу СН3—С_=С—СН2-СН3;
а) СН2=СН-СН2-СН=СН2;
б) СН_=С-СН3;
в) СН3-С_=С-СН-СН3.
4) Чи реагує ацетилен з киснем, воднем, натрій хлоридом? Напишіть рівняння можливих реакцій, назвіть речовини, що утворюються.
5) Напишіть рівняння реакцій, у результаті яких можна здійснити перетворення ацетилену в пропілен. Зазначте умови перебігу реакцій.
6) Вода, що утворилася внаслідок спалювання ацетиленового вуглеводню кількістю речовини 0,1 моль, була поглинута фосфор(V) оксидом. При цьому утворилася ортофосфатна кислота масою 26,14 г. Встановіть формулу вуглеводню. (С5Н8.)
7) Зі зразка кальцій карбіду масою 200 г було одержано ацетилен об'ємом 56 л (н.у.). Визначте масову частку домішок, якщо практичний вихід ацетилену дорівнює теоретичному. (20 %.)
VI.Закріплення знань учнів
Самостійна робота.
IV рівень
Варіант І
1. Складіть структурні формули речовин за їх назвами:
а) 2,2-диметилгекс-3-ин; б) 2-етилбут-1-ин.
2. Щоб спалити 1 моль деякого ацетиленового вуглеводню, необхідно 56 л кисню (н.у.). Встановіть формулу сполуки. (С2Н2.)
Варіант 2
1. Складіть формули речовин за їх назвами: а) 3,3-диметил-4-етилгекс-2-ин; б) пент-2-ин.
2. На спалювання деякого ацетиленового вуглеводню кількістю речовини 0,5 моль витрачається кисень об'ємом 44,8 л (н.у.). Встановіть формулу сполуки. (С3Н4.)
III рівень
Варіант 1
1. Складіть рівняння реакції одержання пропану з пропену.
2. Вуглекислого газу, що виділився внаслідок спалювання деякого ацетиленового вуглеводню кількістю речовини 0,25 моль (н.у.), вистачило на утворення кальцій карбонату масою 100 г. Встановіть формулу вуглеводню. (С4Н6)
Варіант 2
1. Складіть рівняння взаємодії бут-2-ину з бромоводнем.
2. Виведіть молекулярну формулу вуглеводню, у результаті спалювання 2,24 л якого утворюється карбон(ІУ) оксид об'ємом 4,48 л (н.у.). Маса сполуки об'ємом 1 л дорівнює 1,607 г. (С2Н2)
II рівень
Варіант І
1. Складіть структурні формули речовин за їх назвами:
а) 3,3-дибром-2-метилбутан; б) 2,2,5-триметил-гепт-3-ин.
2. Обчисліть масу кальцій карбіду, що містить 7 % домішок, з якого можна добути ацетилен об'ємом 11,2л (н.у.). (34,4 г.)
Варіант 2
1. Складіть структурні формули речовин за їх назвами:
а) 2-метилбут-2-ен; б) 2,5-диметилгекс-3-ин.
2. Обчисліть об'єм кисню, у якому можна спалити ацетилен об'ємом 0,5 м3 (н.у.). (1,25 м3.)
VII .Підсумки уроку
VIII. Домашнє завдання
1


про публікацію авторської розробки
Додати розробку
