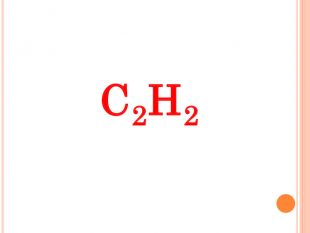
Презентація до навчального уроку-проекту "Алкіни"
Про матеріал
Презентація до навчального уроку-проекту "Алкіни" містить інформацію-звіт про виконане завдання кожної з домашніх груп,які працювали над реалізацією проекту.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку