Неметали IV групи. Матеріал для 11 класу Хімія. Неметали та їх сполуки.
Неметали IV групи
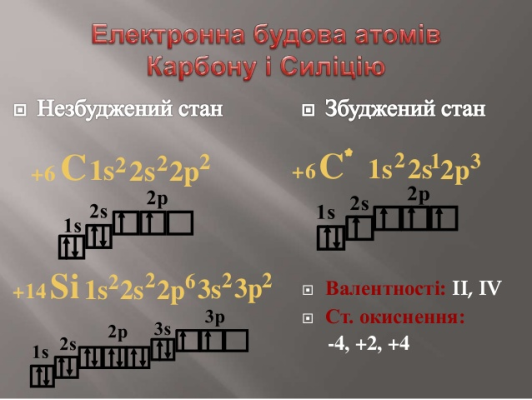
Карбон та Силіцій. Будова атомів.
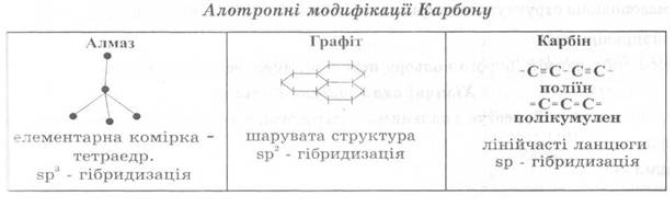
Чотири кристалічні модифікації карбону:
- Графіт
- Алмаз
- Карбін
- Лонсдейліт
Алотропні видозміни Карбону
Лонсдейліт
Лонсдейліт виявлено в метеоритах і отримано штучно; його структура та фізичні властивості остаточно не встановлено.
Цю речовину називають «гексагональним алмазом», тому що воно складається з графіту, тільки зміненого. У природі дуже рідко зустрічається в метеоритних кратерах, але там його твердість навіть поступається твердості карбонада . Вся справа в домішках, які обов'язково присутні в природних зразках лонсдейліта .
 Алотропні видозміни Карбону
Алотропні видозміни Карбону

Аморфний вуглець, або просто аморфне вугілля, насправді є кристалічним, але його кристалики такі малі, що їх не видно навіть у мікроскоп. Фізичні властивості «аморфного» вуглецю значною мірою залежать від дисперсності частинок та
від наявності домішок.
Аморфний вуглець
- Стан вуглецю з неврегульованою структурою;
- Вигляд сажі, деревного вугілля.
Адсорбція
- Адсорбція — явище поглинання газоподібних або розчинених речовин, поглинання молекул, йонів поверхневим шаром твердої речовини.
- Термін адсорбция походить від латинських слів ad — на, біля і sorbere — поглинати.
- Речовину, яка здатна адсорбувати на своїй поверхні інші речовини, називають адсорбентом.
- Найважливішими адсорбентами є деревне вугілля, активоване вугілля, силікагель, деякі силікатні мінерали.
Найпоширеніші карбонати:
- Кальцит (CaCO3)
- Доломіт (CaCO3 * MgCO3)
Кальцит карбонат CaCO3 (кальцит) знаходиться в природі в – основному у вигляді вапняку, крейди та мармуру.
Хімічні властивості
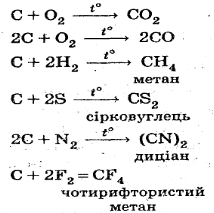 Найбільшу хімічну активність мають природні вуглецеві матеріали, але незалежно від модифікації, Карбон є відновником.
Найбільшу хімічну активність мають природні вуглецеві матеріали, але незалежно від модифікації, Карбон є відновником.
Він активно відновлює неметали. За нормальних умов вуглець безпосередньо взаємодіє тільки з фтором. З усіма іншими неметалами реакція йде при нагріванні:
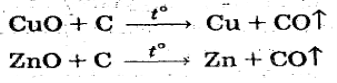
Вуглець відновлює метали з оксидів:
- Взаємодія з металами:
4Al+3C=Al4C3
2C+Ca=CaC2— кальцій карбід
СПОЛУКИ КАРБОНУ IV CO КАРБОН (II) ОКСИД
Фізичні властивості
Карбон (II) оксид СО (чадний газ) — безбарвний газ, малорозчинний у воді, tпл. = -205°С, tкип. = -192 °С. Молекула CO лінійна: С ≡ О.
Одержання
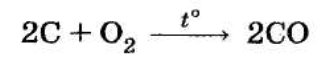 CO утворюється при неповному згорянні вуглецю або вуглецевмісних сполук:
CO утворюється при неповному згорянні вуглецю або вуглецевмісних сполук:
![]() У лабораторії CO одержують зневоднюванням мурашиної кислоти:
У лабораторії CO одержують зневоднюванням мурашиної кислоти:
Промисловий спосіб одержання CO — пропущення вуглекислого газу СО над розігрітим вугіллям:
СО2 + С = 2СО
Хімічні властивості
Карбон (ІІ) оксид проявляє низьку хімічну активність, однак у реакціях, у яких СО бере участь, він є відновником.
При нагріванні або в присутності каталізатора він взаємодіє з неметалами:
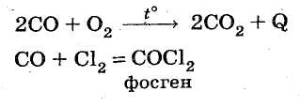
Фосген СОСl2 — отруйний газ. У промисловості CO використовують для відновлення металів з їхніх оксидів:
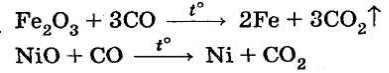
CO — несолетвірний оксид, однак він вступає в реакції з водою й лугами (реакції окиснення-відновлення):
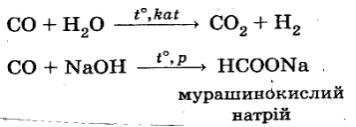
CO біологічно активний: він необоротно взаємодіє з гемоглобіном крові, у результаті чого порушується перенесення кисню від легенів до тканин. На цьому ґрунтується отруйна дія чадного газу.
Сильною отруйною дією вирізняється й продукт взаємодії карбон (II) оксиду з аміаком (ціанідна кислота):
CO + NH3 = HCN + H2O - ціанідна кислота
КАРБОН (IV) ОКСИД СО2
Фізичні властивості
Карбон (IV) оксид СО2 (вуглекислий газ) — безбарвний газ без запаху,
важчий за повітря, малорозчинний у воді. СО2 скраплюють під тиском
0,6 МПа, при температурі -78,5 °С СО2 сублімується.
Молекула СО2 лінійна, неполярна:
О = С = О
μ = 0
Одержання
У природі СО2 утворюється в результаті дихання, а також окиснення різних органічних речовин (гниття тваринних і рослинних залишків, спалювання палива).
У промисловості СО2 одержують термічним розкладанням кальцій карбонату (випалювання вапняку):
![]()
Лабораторний метод одержання СО2 — взаємодія хлоридної кислоти з кальцій карбонатом:
![]()
Хімічні властивості
СО2 — типовий кислотний оксид, вступає у взаємодію з водою, основними й амфотерними оксидами, а також з основами. У результаті реакцій утворюються вугільна кислота або солі-карбонати:
- CO2 + H2O ↔ H2CO3
- CaO + CO2 = CaCO3
- 2Al2O3 + 3CO2 = Al2(CO3)3
- 2NaOH + CO2 = Na2CO3 + H2O
В окисно-відновних реакціях СО2 проявляє окисні властивості:
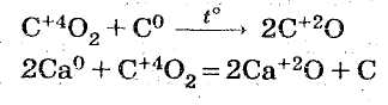
СО2 не підтримує горіння й дихання (при концентрації СО2 у людини наступає параліч). Однак, деякі речовини можуть горіти в атмосфері СО2:
2Mg + СО2 = 2MgO + С
Застосування
СО2 використовують при гасінні пожеж (коли не можна використовувати воду), у приготуванні мінеральної води й прохолодних напоїв.
В органічному синтезі СО2 дозволяє створювати інертну атмосферу.
Твердий СО2 («сухий лід») застосовується для охолодження продуктів, які швидко псуються, приготування й зберігання морозива.
КАРБОНАТНА (ВУГІЛЬНА) КИСЛОТА Н2СО3
Фізичні властивості
Карбонатна кислота Н2СО3 — нестійка сполука й існує тільки в розведених водяних розчинах.
Одержання
Карбонатна кислота може бути отримана розчиненням у воді карбон (IV) оксиду:
![]()
Рівновага в системі зміщена вліво, тому в розчині карбонатна кислота існує не у вигляді молекули Н2СО3, а у вигляді гідрату СО2 • Н2О.
Якісна реакція на карбонат-іони :
- СаСО3+2НСl = Н2СО3 + СаСl2
- СО2 + Са(ОН)2 = СаСО3 + Н2О
Якісною реакцією на карбонат - іони є виділення СО2, який можна розпізнати, пропускаючи його через розчин з вапняною водою, в результаті чого утворюється осад(потемніння розчину).
Силіцій
Другий за поширеністю в світі, бо кожний шостий атом на Землі – атом Силіцію, основа всіх гранітів.
Фізичні властивості і значення оксидів
- Силіцій оксид SiO2 – найпоширеніший твердий оксид
- Атоми Силіцію і Оксигену утворюють атомну кристалічну гратку, тому кристали тверді, тугоплавкі, але крихкі
Силіцій в природі, силікати алюмосилікати:
- Слюда
- Нефелін
- Каолін
- Польовий шпат
- Тальк
- Азбест
Силіцій утворює просту речовину – кремній.
- Кристалічний – темно-сірий колір, металічний блиск, напівпровідник
- Аморфний кремній – порошок бурого кольору, більш реакційно здатний, ніж кристалічний.
Фізичні властивості
Кремній Si — кристалічна речовина темно-сірого кольору з характерним блиском; існувати в аморфному стані. Найстійкіша конфігурація кремнію — алмазоподібна (кубічна гранецентрована кристалічна решітка).
Кристалічний кремній — дуже твердий і тугоплавкий (tпл. = 1428 °С, tкип. = 2600 °С), він є напівпровідником. Гексагональна модифікація кремнію нестійка.
Одержання
Кремній одержують відновленням його з оксидів з використанням сильних відновників (С, Mg):
![]()
Ця реакція лежить в основі промислового способу одержання кремнію, що здійснюється в електропечах. Отриманий кремній має 95-98% -ву чистоту. Відновлення магнієм частіше застосовують у лабораторіях:
![]()
Зберігають галогеніди кремнію в запаяних або щільно закритих посудинах, оскільки на повітрі вони димлять.
При значному нагріванні Силіцій реагує із Сульфуром,
Нітрогеном і Карбоном:
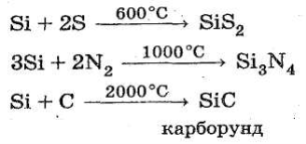
Кремній розчиняється в лугах з утворенням солей кремнієвої кислоти (силікатів):
![]()
Більшість кислот пасивує кремній, але в суміші концентрованої плавикової й нітратної кислот він розчиняється:
![]()
Кремній взаємодіє з активними металами і їхніми оксидами з утворенням силіцидів металів:

СИЛІЦІЙ (IV) ОКСИД SiO2
Фізичні властивості
Силіцій (IV) оксид SiO2 — тверда кристалічна речовина, тугоплавка (tпл. = 1713 °С, tкип. = 2590 °С). Кристали SiO2 мають наступну будову.
Хімічні властивості
SiO2 є кислотним оксидом, однак з водою він не взаємодіє. Взагалі, SiO2 досить інертний; вступає у взаємодію тільки з активними реагентами.
SiO2 у процесі сплавляння взаємодіє зі сполуками основної природи (основними оксидами, основами), а також з карбонатами з утворенням солей силікатної кислоти (силікатів):
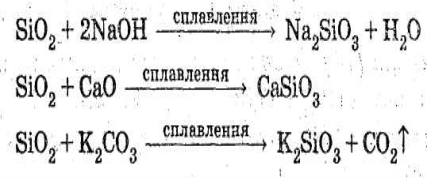
Силікатна кислота
Фізичні властивості
Силікатна кислота Н4SiO3 — драглиста речовина, погано розчинна у воді. У пересичених водяних розчинах вона поступово полімеризується й переходить у колоїдний стан.
Одержання
Н4SiO 3 одержують, витісняючи її з її солей.
![]()
Загальний спосіб одержання силікатів — сплавка SiO3 з відповідними основами:
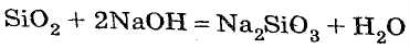
Хімічні властивості
Силікатна кислота — слабка (слабша за карбонатну):
![]()
Більшість солей силікатної кислоти нерозчинні у воді, розчинні тільки силікати лужних металів. У воді вони піддаються гідролізу за аніоном (солі слабкої кислоти):
![]()
Реакція середовища лужна.
1


про публікацію авторської розробки
Додати розробку
