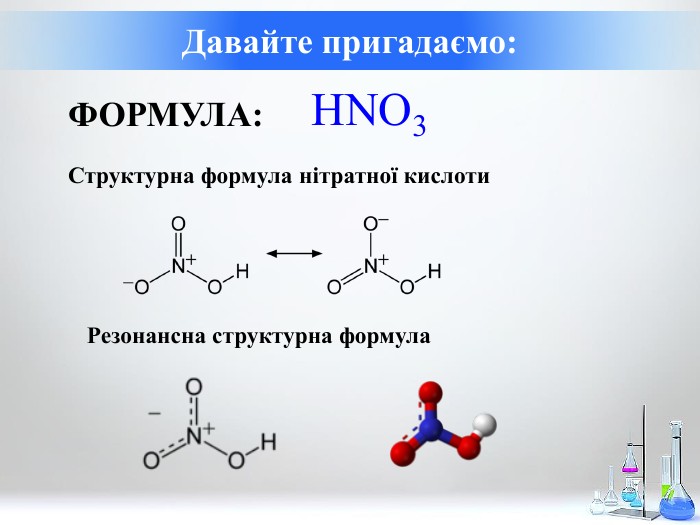
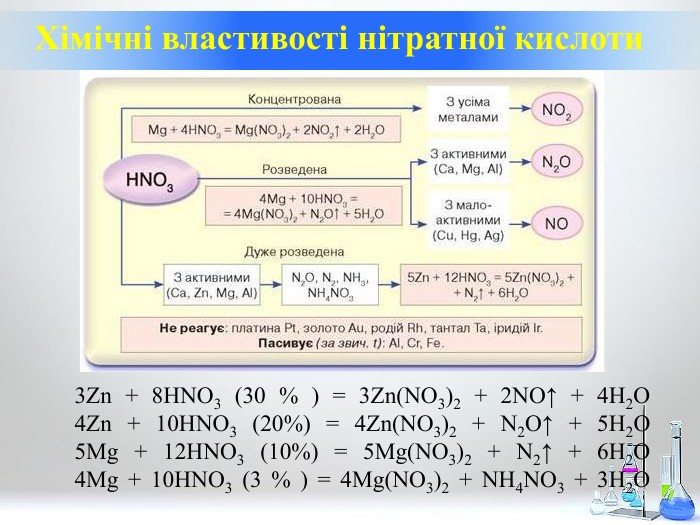
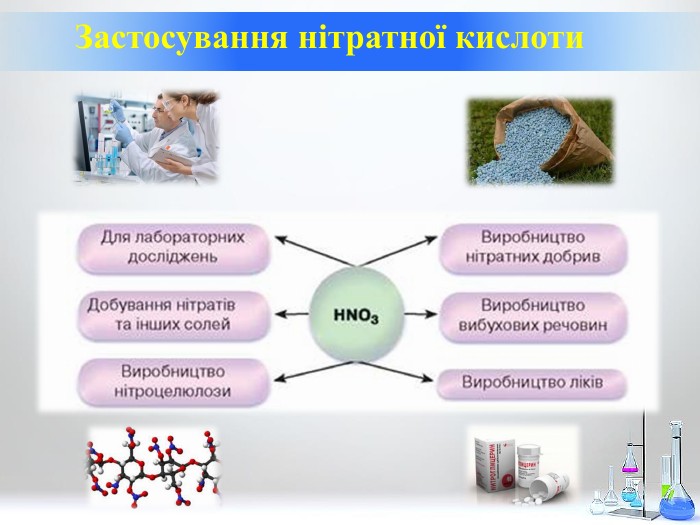
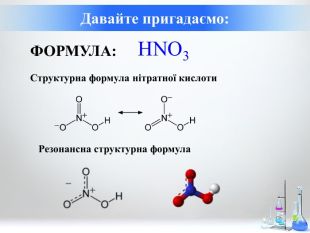
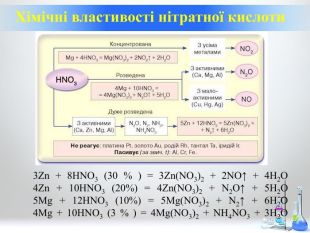
Нітратна кислота. Особливості взаємодії металів з нітратною кислотою.
Про матеріал
Презентація до уроку з хімії на тему: "Нітратна кислота. Особливості взаємодії металів з нітратною кислотою" Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку