Задачі на надлишок та домішки


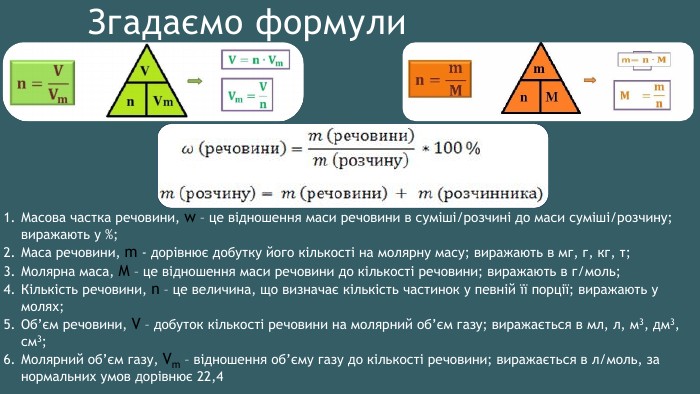









Згадаємо формули. Масова частка речовини, w – це відношення маси речовини в суміші/розчині до маси суміші/розчину; виражають у %;Маса речовини, m - дорівнює добутку його кількості на молярну масу; виражають в мг, г, кг, т;Молярна маса, М – це відношення маси речовини до кількості речовини; виражають в г/моль;Кількість речовини, n – це величина, що визначає кількість частинок у певній її порції; виражають у молях;Об’єм речовини, V – добуток кількості речовини на молярний об’єм газу; виражається в мл, л, м3, дм3, см3;Молярний об’єм газу, Vm – відношення об’єму газу до кількості речовини; виражається в л/моль, за нормальних умов дорівнює 22,4
Загальний алгоритм розв’язку: Прочитати умову задачі та записати «Дано»; Обчислити масову частку компонента в технічній суміші, яка містить домішки: w(компонента) = 100 % - w(домішок); Розрахувати масу компонента через відому масову частку; якщо потрібно перевести у зручні одиниці вимірювання: 𝐰компонента= 𝐦компонента𝐦(технічної суміші)∗𝟏𝟎𝟎 % −≫ 𝐦компонента= 𝐰компонента∗𝐦(технічної суміші)𝟏𝟎𝟎 % Написати рівняння задачі, розставити коефіцієнти; Підписати маси, об’єми, кількості речовин над сполуками, що нам відомі та написати їх одиниці вимірювання; позначити речовину, що потрібно знайти за х; Підписати молярний об’єм та розрахувати молярну масу під речовинами та підписати їх одиниці вимірювання: М(сполуки) = Мr(сполуки) =Ar1(Е)*n1(Е) + Ar2(Е)*n2(Е)+…+Arn(Е)*nn(Е) Поставити х над сполукою, що потрібно знайти та визначити її одиниці вимірювання; За рівнянням реакції знайти х; якщо потрібно перевести у зручні одиниці вимірювання. Записати відповідь.
Задача 1 Який об’єм водню виділиться за нормальних умов (н.у.) під час взаємодії 1,25 г магнію з достатньою кількістю етанової кислоти, якщо масова частка домішок у металі становить 4%?{2 D5 ABB26-0587-4 C30-8999-92 F81 FD0307 C}Дано: m(Mg із дом.) = 1,25 гw(домішок) = 4 %н.у. Розв’язання: 1. Знаходимо масову частку магнію в суміші, що містить домішки: w(Mg) = 100 % - 4 % = 96 % 2. Знаходимо масу магнію через масову частку та знаходимо молярну масу магнію:𝑤𝑀𝑔= 𝑚𝑀𝑔𝑚(𝑀𝑔 із домішками)∗100 % −≫𝑚𝑀𝑔= 𝑤𝑀𝑔∗𝑚(𝑀𝑔 із домішками)100 %𝑚𝑀𝑔= 96 % ∗1,25 г100 %=1,2 г. М(Mg) = Mr(Mg) = Ar(Mg) * n(Mg) = 24,3 * 1 = 24,3 г/моль3. Записуємо рівняння реакції, підписуємо величини, що нам відомі, над сполуками в рівнянні: 1,2 г х, л. Mg + 2 CH3 COOH → (CH3 COO)2 Mg + H2↑ 24,3 г/моль 22,4 л/моль4. Знаходимо об’єм водню, який виражено х: х= 1,2 г ∗22,4 л/моль24,3 г/моль=1,12 л Відповідь: V(H2) = 1,12 л. V(H2) - ?{2 D5 ABB26-0587-4 C30-8999-92 F81 FD0307 C}Дано: m(Mg із дом.) = 1,25 гw(домішок) = 4 %н.у. V(H2) - ?
Задача 2 Масова частка домішок у технічному кальцій карбіді 20 %. Обчисліть об’єм ацетилену (м3), який можна добути з 200 кг технічного кальцій карбіду.{2 D5 ABB26-0587-4 C30-8999-92 F81 FD0307 C}Дано:w(домішки) = 20 %m(Ca. C2 технічний) = 200 кг. Розв’язання: Знаходимо масову частку кальцій карбіду в технічній суміші:w(Ca. C2) = 100 % - 20 % = 80 %2. Знаходимо масу кальцій карбіду через масову частку та знаходимо молярну масу кальцій карбіду: 𝑤𝐶𝑎𝐶2=𝑚𝐶𝑎𝐶2𝑚(технічної суміші)∗100 % −≫ 𝑚𝐶𝑎𝐶2= 𝑤𝐶𝑎𝐶2∗𝑚(технічної суміші)100 %𝑚𝐶𝑎𝐶2= 80 % ∗200 кг100 %=160 кг = 160 000 г. М(Ca. C2) = Мr(Ca. C2) =Ar(Ca)*n(Ca) + Ar(C)*n(C) = 40*1 + 12*2 = 64 г/моль3. Записуємо рівняння реакції, підписуємо величини, що нам відомі, над сполуками в рівнянні: 160 000 г х л Са. С2 + 2 Н2 О → Са(ОН)2↓ + С2 Н2↑ 64 г/моль 22,4 л/моль 4. Знаходимо об’єм ацетилену, який виражено х:𝑥= 160000 г ∗ 22,4 л/моль64 г/моль=56 000 л=56000∗0,001=56 м3 Відповідь: V(C2 H2) = 56 м3 V(C2 H2) - ?{2 D5 ABB26-0587-4 C30-8999-92 F81 FD0307 C}Дано:w(домішки) = 20 %m(Ca. C2 технічний) = 200 кг. V(C2 H2) - ?
Загальний алгоритм розв’язку: Прочитати умову задачі та записати «Дано»;Написати рівняння задачі, за яким буде йти розв’язок, урівняти його;Підписати маси, кількість, об’єм сполук, що відомі з умови, над ними; Підрахувати молярну масу сполук: М(сполуки) = Мr(сполуки) =Ar1(Е)*n1(Е) + Ar2(Е)*n2(Е)+…+Arn(Е)*nn(Е) та записати молярний об’єм під реагентами рівняння; Позначити речовину, що потрібно знайти за х; Розрахувати кількість речовини кожної сполуки, що вступила в реакцію: nречовини= 𝑚(речовини)𝑀(речовини) , nречовини= 𝑉(речовини)𝑉𝑚 ; Визначити, яка зі сполук, що вступили в реакцію у надлишку, а яка в нестачі. Розв’язувати тільки за нестачею;8. Знайти х за рівнянням реакції.
{2 D5 ABB26-0587-4 C30-8999-92 F81 FD0307 C}Дано:m(P) = 9,3 г. V(O2) = 5,6 л. Розв’язання: Записуємо рівняння реакції, підписуємо маси, об’єм сполук над ними; рахуємо молярну масу сполук та молярний об’єм, записуємо під реагентами рівняння; позначаємо речовину, що потрібно знайти за х: 9,3 г 5,6 л х г 4 P + 5 O2 → 2 Р2 О5 31 г/моль 22,4 л/моль 142 г/моль М(Р) = Мr(Р) =Ar(Р)*n(Р) = 31*1 = 31 г/моль. М(Р2 О5) = Мr(Р2 О5) =Ar1(Р)*n1(Р) + Ar2(О)*n2(О) = 31*2 +16*5 = 142 г/моль2. Розраховуємо кількість речовини кожної сполуки, що вступила в реакцію; визначаємо хто в надлишку, хто в нестачі: nречовини= 𝑚(речовини)𝑀(речовини); nречовини= 𝑉(речовини)𝑉𝑚 n. Р= 𝑚(Р)𝑀(Р)=9,3 г31 г/моль=0,3 моль; 𝑛O2= 𝑉O2𝑉𝑚 =5,6 л22,4 л/моль=0,25 моль; n(P) > n(O2), тому кількість фосфору буде в надлишку, а кількість кисня в нестачі, тому за нею і рахуємо.3. Знаходимо х, враховуючи коефіцієнти перед сполуками:х=5,6 л ∗142гмоль∗222,4лмоль ∗5=14,2 г Відповідь: m(Р2 О5) = 14,2 гm(Р2 О5) - ?{2 D5 ABB26-0587-4 C30-8999-92 F81 FD0307 C}Дано:m(P) = 9,3 г. V(O2) = 5,6 лm(Р2 О5) - ?Задача 1 Обчисліть масу Р2 О5, що утвориться під час спалювання фосфору масою 9,3 г в кисні об’ємом 5,6 л за н.у.
Загальний алгоритм розв’язку для задач, де всі коефіцієнти дорівнюють 1: Прочитати умову задачі та записати «Дано»;Написати рівняння задачі, за яким буде йти розв’язок;Підписати маси, що відомі з умови, над ними; Підрахувати молярну масу сполук: М(сполуки) = Мr(сполуки) =Ar1(Е)*n1(Е) + Ar2(Е)*n2(Е)+…+Arn(Е)*nn(Е) та записати молярний об’єм під реагентами рівняння; Позначити речовину, що потрібно знайти за х; Розрахувати кількість речовини кожної сполуки, що вступила в реакцію: nречовини= 𝑚(речовини)𝑀(речовини) ;Визначити, яка зі сполук, що вступили в реакцію у надлишку, а яка в нестачі. Розв’язувати тільки за нестачею;При коефіцієнтах 1 при сполуках у рівнянні кількості речовини, що в нестачі, та сполуки, що потрібно знайти, рівні;8. Знайти х за рівнянням реакції.
Задача 2 Яка маса ферум (ІІ) сульфіду утвориться при взаємодії 8 г заліза і 8 г сірки?{2 D5 ABB26-0587-4 C30-8999-92 F81 FD0307 C}Дано: m(Fe) = 8 гm(O) = 8 г. Розв’язування: Записуємо рівняння реакції, підписуємо маси сполук над ними; рахуємо молярну масу сполук, записуємо під реагентами рівняння; позначаємо речовину, що потрібно знайти за х: 8 г 8 г х г Fe + S → Fe. S 56 г/моль 32 г/моль 88 г/моль. М(Fe) = Мr(Fe) =Ar(Fe)*n(Fe) = 56*1 = 56 г/моль. М(S) = Мr(S) =Ar(S)*n(S) =32*1 = 32 г/моль. М(Fe. S) = Мr(Fe. S) =Ar1(Fe)*n1(Fe) + Ar2(S)*n2(S) = 56*1 + 32*1 = 88 г/моль 2. Знаходимо кількості речовин, що реагують, та визначаємо що в надлишку, а що в недостачі:nречовини= 𝑚(речовини)𝑀(речовини)n. Fe= 𝑚(𝐹𝑒)𝑀(𝐹𝑒)=8 г 56 г/моль=0,14 моль; n. S= 𝑚(𝑆)𝑀(𝑆)=8 г32 г/моль=0,25 моль => n(Fe) < n(S), тому кількість ферума в нестачі, а сірки – надлишку.3. Так як коефіцієнти в рівнянні дорівнюють один, то кількість ферум (ІІ) оксид дорівнюватиме кількості заліза: n(Fe. S) = n(Fe) = 0,14 моль4. Знаходимо х, як масу оксиду:х = m(Fe. S) = M(Fe. S) * n(Fe. S) = 88 г/моль * 0,14 моль = 12 г. Відповідь: m(Fe. S) = 12 гm(Fe. S) - ?{2 D5 ABB26-0587-4 C30-8999-92 F81 FD0307 C}Дано: m(Fe) = 8 гm(O) = 8 гm(Fe. S) - ?


про публікацію авторської розробки
Додати розробку












