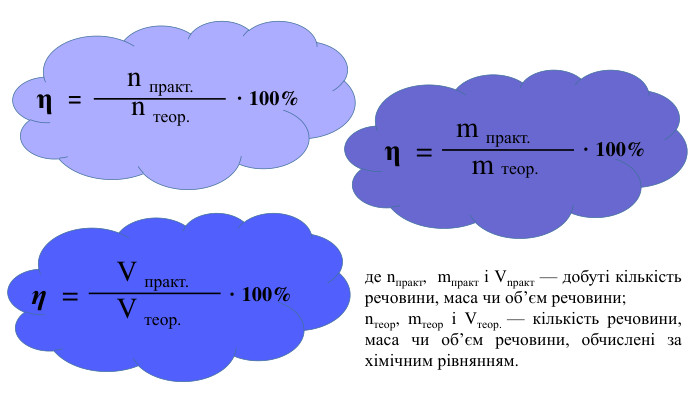
Обчислення за хімічними рівняннями відносного виходу продукту реакції
Про матеріал
Презентація містить: теоретичний матеріал, задачі з розв'язками, задачі для самостійного розв'язання. За підручником Хімія (рівень стандарту) 11 клас/Попель, Крикля. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую
-


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку