Оформлення лабораторної 9 клас "Реакції обміну"
Про матеріал
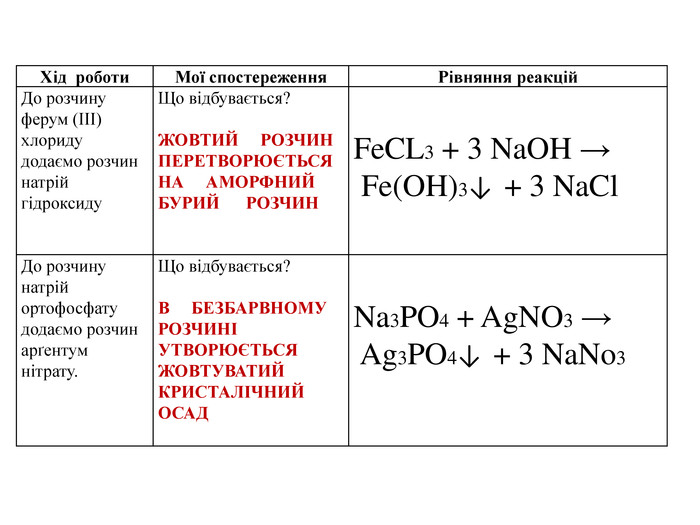
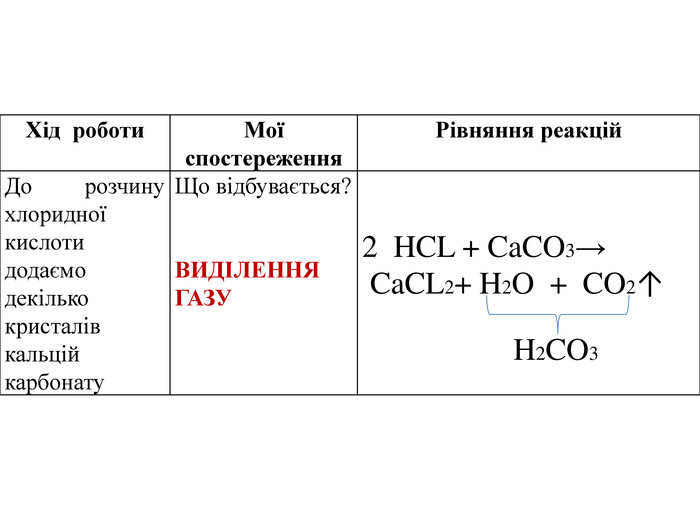
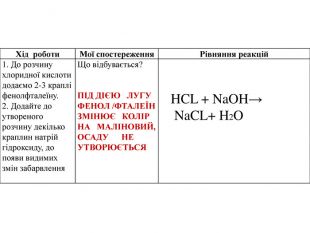
Матеріал містить теми, мету, обладнання та реактиви для проведення лабораторних робіт, складається з таблиць, які необхідно заповнювати після проведення лабораторних дослідів, або після перегляду демонстраційного відео. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку