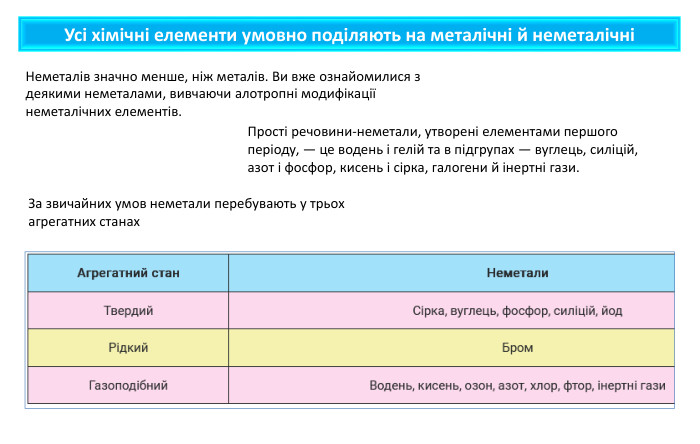
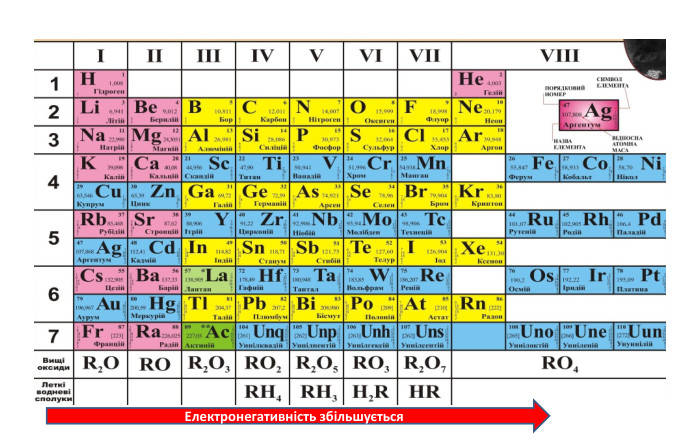
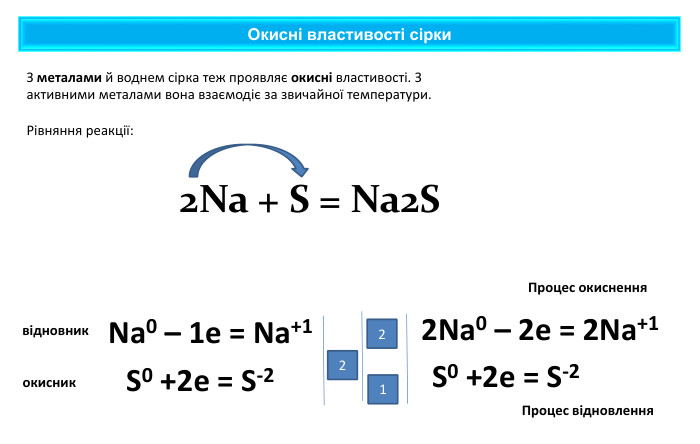
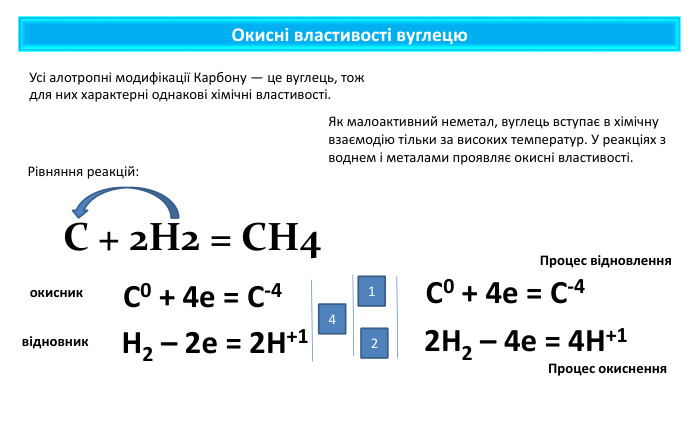
Окисні та відновні властивості неметалів
Про матеріал
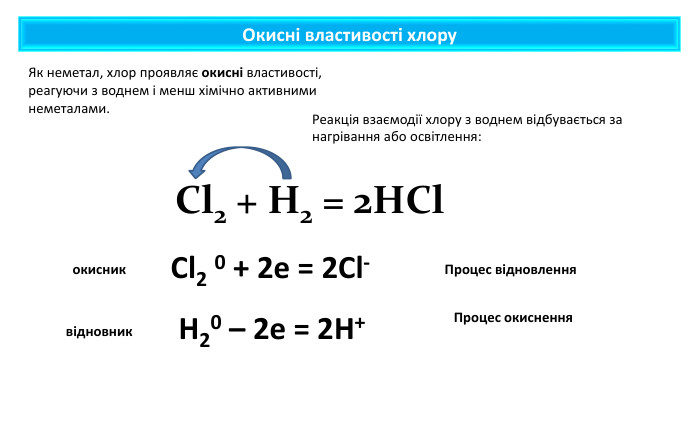
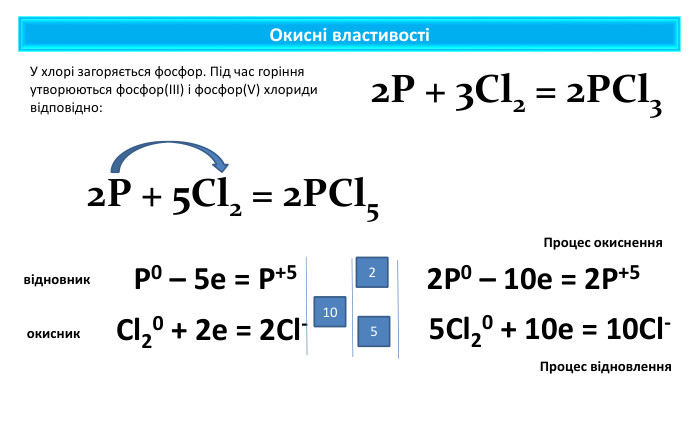
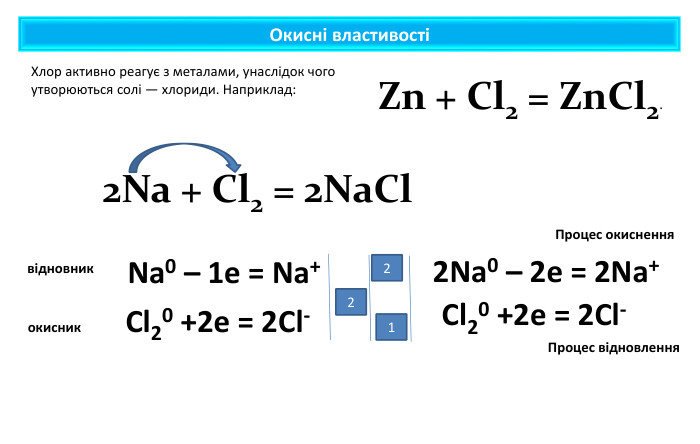
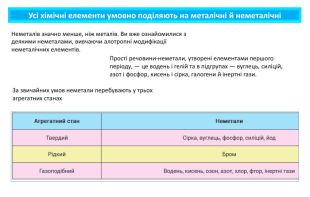
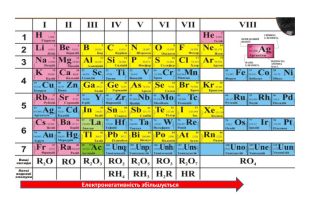
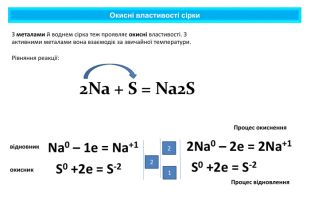
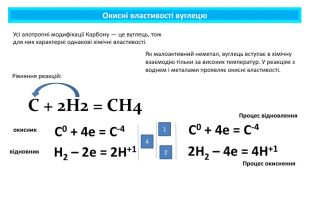
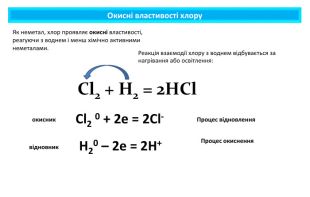
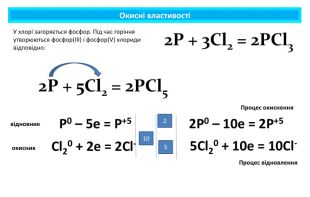
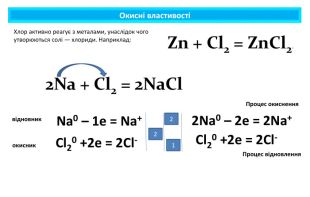
Презентація містить навчальний матеріал за темою "Окисні та відновні властивості неметалів". На основі електронного балансу визначені окисник та відновник у реакціях за участю неметалів. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
дякую
-
Дякую!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку