: Оксиди неметалічних елементів, їх уміст в атмосфері.
11 кл Урок № 32 Дата уроку __________
Тема : Оксиди неметалічних елементів, їх уміст в атмосфері.
Навчально-освітня мета: продовжувати поглиблювати уявлення учнів про неметалічні сполуки, розширити знання учнів про кислотні оксиди ; актуалізувати знання учнів про оксиди, їх класифікацію, фізичні властивості кислотних оксидів ,їх вміст в атмосфері. Сформувати уявлення про вплив кислотних оксидів на здоров’я людини .
Виховна мета : (екологічна компетентність) : сформувати почуття необхідності недопущення забруднення атмосфери кислотними оксидами , усвідомлення наслідків зростання в атмосфері оксидів Сулфуру , Карбону , та інших. .
Обладнання: блок-схеми «Класифікація оксидів».
Тип уроку: урок набуття нових знань.
Хід уроку
І. Організаційний момент
ІІ. Актуалізація опорних знань
Аналіз самостійної роботи.
ІІІ. Вивчення нового навчального матеріалу
Бесіда :
- Що таке оксиди ?
Майже всі неметалічні елементи утворюють оксиди (табл. 7 стор 112).
- Яку ступінь окиснення має Оксиген в оксидах?
- Які ви пам’ятаєте оксиди за класифікацією?
1. Класифікація оксидів :
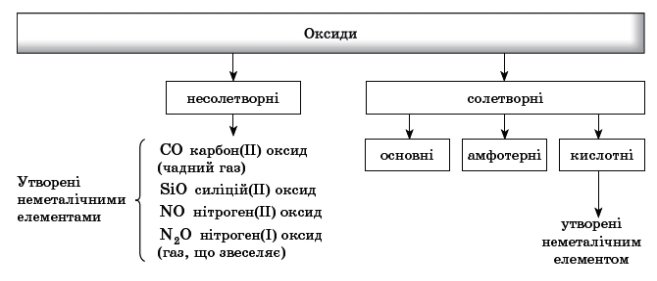
- Що таке основні оксиди ?
- Що таке амфотерні оксиди?
- Що таке кислотні оксиди? Так неметалічні елементи утворюють кислотні оксиди.
- Від чого залежить кількість оксидів одного елемента?
- Як тоді формується назва оксиду ? (Вказується валентність в назві)
Є тривіальні назви ( чадний газ)
- Хто з неметалів не утворює оксиду ? (Винятками є Флуор та інертні елементи — Гелій, Неон, Аргон.)
Завдання : На підставі будови атомів Нітрогену й Фосфору, Cульфуру й Карбону зробіть припущення щодо того, оксиди з яким ступенем окиснення вони можуть утворювати. Назвіть ці оксиди за сучасною номенклатурою.
Відповідь :

|
Р2О3 |
Р2О5 |
2. Будова оксидів неметалічних елементів :
- складаються з молекул
- кристалічна ґратка - молекулярна,
- ковалентні зв’язки між атомами є полярними, а самі молекули можуть бути полярними і неполярними (мал. 48 чтор 114).
3. Фізичні властивості кислотних оксидів .
між молекулами діють слабкі ван-дер-ваальсовські сили міжмолекулярної взаємодії, що обумовлює те, що кислотні оксиди :
- багато представників мають запах.
- можуть перебувати у твердому, рідкому і газоподібному агрегатному станах :
сполуки SO2, NO2, NO, CO2, CO є газами (перші два мають характерні запахи),
оксид N2O4 — рідина,
оксиди P2O5, SiO2 — тверді речовини.
- Розчиняються у воді : SO2, SO3, NO2, CO2, P2O5 і багато інших оксидів неметалічних елементів (мал. 49 стор 114), взаємодіючи з нею й перетворюючись на кислоти.
- мають низькі температури кипіння або плавлення, - неміцні.
4. Поширення кислотних оксидів в атмосфері :
Виступи учнів з повідомленнями на тему :
- Поширеність оксидів неметалів а атмосфері
- Фізіологічна дія деяких кислотних оксидів
- Парніковий ефект : причини і наслідки.
ІV. Закріплення Вправа № 152
|
Відомо: V(CO2)= 3V(CO) Знайти: M(cуміші)-?, DH2(суміші)-? |
Розв'язування V(cуміші)= V(CO2) + V(CO) =1+3 =4 φ(СO2) = V(CO2) V(суміші) = 1/4=0,25 Φ (СO)= V(CO) = 3 V(суміші) 4 = 0,75 Mr (CO2) =44, Mr(CO)=28 |
|
Середня молекулярна маса суміші газів дорівнює сумі добутків об'ємних часток на молекулярні маси окремих газів: Mr (cуміші) = φ (СO2) • Mr(CO2) + φ (СO) • Mr(CO) Mr(суміші) = 0,25•44 + 0,75 •28 = 32, отже, M (cуміші) = 32 г/моль M(H2) =2 г/моль DН2 (суміші) = M(суміші) : M(Н2) = 32 г/моль : 2 г/моль = 16 г/моль Відповідь: M(суміші)=32 г/моль, DН2(суміші)=16 г/моль |
|
VI. Домашнє завдання : Опрацювати матеріал §20 . Завдання № 154 письмово Підготувати повідомлення ( індивідуальне завдання ): «Кислотні дощі: причини появи і екологічні наслідки»


про публікацію авторської розробки
Додати розробку
