Розробка уроку з хімії в 11 класі по темі: "Розв'язання задач за рівняннями реакцій, якщо один із реагентів узято в надлишку" 2 год.
Тема: Розв'язання задач за рівняннями реакцій, якщо один із реагентів узято в надлишку
учні обчислюють кількість (об’єм, масу) продукту реакції за масами (об’ємом, кількістю речовини) реагентів, один з яких узято в надлишку, обґрунтовуючи обраний спосіб розв’язання.
Ключові компетентності:
спілкування державною мовою, математична компетентність, основні компетентності у природничих науках і технологіях, інформаційно-цифрова компетентність.
Хід уроку:
І. Актуалізація опорних знань:
Обчислювати кількість (об’єм, масу) продукту реакції за масами (об’ємом, кількістю речовини) реагентів, один з яких узято в надлишку, потрібно за тією речовиною, яка повністю витратиться внаслідок реакції. Адже друга сполука прореагує лише частково - її надлишок не реагуватиме. Тобто кількість продукту реакції буде прямо пропорційна кількості реагенту, що прореагує повністю. Ці співвідношення змодельовано на рисунку
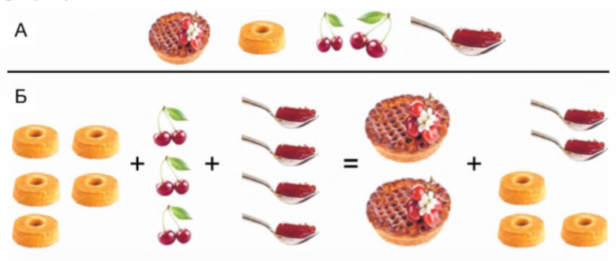
А. Для виготовлення смачної вітамінної канапки знадобляться бісквітна основа (1 штука), свіжі вишні (3 штуки) та малиновий сироп (1 десертна ложка).
Б. З п’яти бісквітних основ, трьох пар вишень та чотирьох ложок сиропу згідно з рецептом можна виготовити лише дві канапки. Тож дві ложки сиропу та три бісквітні основи є надлишком.
Майбутнім кондитерам, наприклад, неважко збагнути: якщо для виготовлення солодкої канапки потрібні бісквітна основа, три вишні та ложка малинового сиропу, то з п’яти бісквітних основ, трьох пар вишень і чотирьох ложок сиропу згідно з рецептом можна виготовити лише дві повноцінні канапки. Дві ложки сиропу та три бісквітні основи залишаться невикористаними.
ІІ. Вивчення нового матеріалу:
З огляду на здобуті уявлення розгляньмо реакцію азоту з воднем. Взаємодію цих речовин описують хімічним рівнянням:
![]()
Відповідно до стехіометричних коефіцієнтів кількість речовини водню втричі більша за кількість речовини азоту. Кількість речовини продукту реакції (амоніаку) удвічі більша за кількість речовини азоту й становить дві третини від кількості речовини водню:
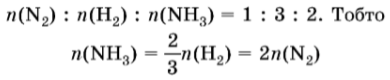
За рисунком нескладно визначити, який з реагентів узято в надлишку. Очевидно, що в одиничному акті реакції бере участь молекула азоту та три молекули водню. Тобто азот витратиться повністю, а три молекули водню є надлишком цього реагенту
За рисунком нескладно визначити, який з реагентів узято в надлишку. Очевидно, що в одиничному акті реакції бере участь молекула азоту та три молекули водню. Тобто азот витратиться повністю, а три молекули водню є надлишком цього реагенту
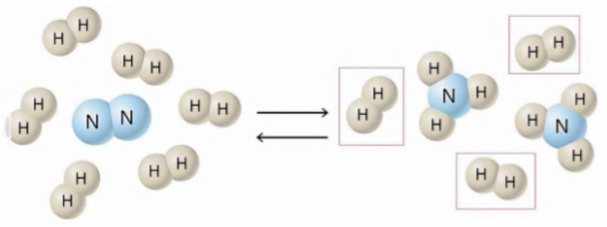
Який з реагентів узято в надлишку?
Оскільки рівні об’єми різних газів за однакових умов містять однакову кількість молекул, можна обґрунтовано стверджувати, що співвідношення між об’ємами реагентів і продукту цієї реакції такі:
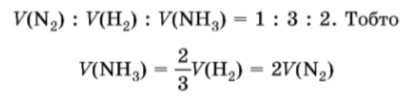
Алгоритм обчислення маси (об’єму, кількості речовини) продукту реакції за масами (об’ємом, кількістю речовини) реагентів, один з яких узято в надлишку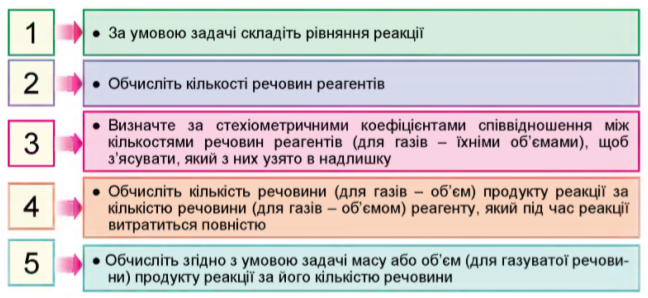
Під час хімічних взаємодій речовини витрачаються тільки в стехіометричних співвідношеннях, тобто в тих співвідношеннях, у яких вони зазначені в рівнянні хімічної реакції. Якщо одного з реагентів взято більше, то він наявний у надлишку і під час реакції витратиться не повністю. Кількісні дані про цей реагент не можна використовувати під час розрахунків за хімічним рівнянням, оскільки в реакцію вступає тільки певна частина цього реагенту. Тому перед розрахунками за рівнянням реакції необхідно визначити, який із реагентів подається в надлишку, а який — у нестачі. Такий тип задач (часто їх називають «задачі на надлишок та нестачу») досить просто виявити: в умові зазначено масу, кількість речовини або об’єм для обох реагентів, хоча зазвичай для розрахунків за хімічним рівнянням достатньо знати відомості лише про один реагент. Для того щоб визначити, який із реагентів узято в надлишку, можна скористатися простим правилом. Як вам відомо, відношення кількості речовини реагентів до їхніх стехіометричних коефіцієнтів дорівнюють одне одному. Отже, для реакції:
![]()
справедливим є співвідношення
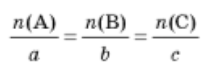
Якщо речовина В наявна в надлишку щодо речовини А, то:
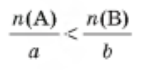
Отже, щоб визначити, який із реагентів узято в надлишку, необхідно обчислити кількість речовини обох реагентів і розділити їх на стехіометричні коефіцієнти з рівняння реакції. Для реагенту, що наявний у надлишку, це відношення буде більшим.
• Якщо в умові задачі дано кількісні дані про два реагенти, необхідно перевірити, який із реагентів узято в надлишку.
• Для визначення необхідно порівняти відношення кількості речовини реагентів А та В до їхніх стехіометричних коефіцієнтів a i b:
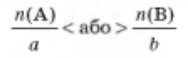
• Для обчислення за хімічними рівняннями потрібно використовувати кількісні дані про реагент, який узято в нестачі.
Задача 1. Цинк масою 32,5 г помістили в хлоридну кислоту, у якій маса НСl дорівнює 109,5 г. Визначте об’єм водню (н. у.), що виділиться під час реакції.

Задача 2. Змішали два розчини з однаковими масами: хлоридну кислоту та розчин калій гідроксиду, у яких масові частки обох реагентів також однакові. Визначте, яке середовище (кислотне чи лужне) буде в розчині після зливання двох реактивів.


ІІІ. Узагальнення й систематизація знань:
Речовини вступають у хімічні взаємодії лише в стехіометричних співвідношеннях відповідно до рівняння реакції. Такі співвідношення дозволяють визначити, яку речовину взято в надлишку, а яку — у нестачі.
1. Для одержання гідроген хлориду змішали хлор масою 14,2 г та водень масою 6 г. Обчисліть об'єм одержаного гідроген хлориду (н. у.) і масу реагенту, що залишиться.
2. До цинку масою 6,5 г додали хлоридну кислоту масою 150 г із масовою часткою гідроген хлориду 20 %. Обчисліть об'єм виділеного газу (н. у.).
3. До розчину натрій хлориду масою 100 г із масовою часткою солі 2 % долили розчин аргентум(І) нітрату такої самої маси з масовою часткою солі 1 %. Обчисліть масу осаду, що утвориться.
4. Кальцій карбонат масою 150 г залили розчином хлоридної кислоти масою 1 кг із масовою часткою кислоти 5 %. Обчисліть масову частку солі в отриманому розчині.
5. Цинк масою 13 г сплавили із сіркою масою 7 г. Продукт реакції обробили надлишком хлоридної кислоти. Обчисліть об'єм газу (н. у.), що виділився.
6. Обчисліть об'єм газуватого сульфур(VІ) оксиду, який можна добути із сульфур(ІV) оксиду об'ємом 150 л та кисню об'ємом 100 л.
7. Обчисліть масу гідроген сульфіду, що утвориться під час взаємодії сірки масою 5,6 г і водню об'ємом 5,6 л (н. у.).
8. Змішали розчини сульфатної кислоти і барій хлориду масою по 500 г. Масова частка кислоти в початковому розчині становить 10,4 %, а барій хлориду — 20,8 %. Обчисліть масу утвореного осаду.
9. До розчину, що містить 14 г сульфатної кислоти, додали купрум(ІІ) гідроксид масою 12 г. Обчисліть масу утвореної солі та масу надлишкової речовини, що не прореагувала.
10. Обчисліть масу амоніаку, яку можна добути, використовуючи азот масою 98 кг та водень масою 10 кг. Завдання з розвитку критичного мислення
11. Як ви вважаєте, з якою метою під час проведення експериментів у лабораторіях і промисловості ту чи іншу речовину беруть у надлишку? Чи будь-яку речовину можна брати в надлишку?
12. Обчисліть масу (г) води, яка утвориться внаслідок вибуху газової суміші, що складається з водню об’ємом 0,56 л (н. у.) і кисню такого самого об’єму (н. у.).
13. Обчисліть масу (г) плюмбум(ІІ) йодиду, який утвориться внаслідок змішування двох водних розчинів, один з яких містить плюмбум(ІІ) нітрат масою 66,2 г, а другий - калій йодид масою 33,2 г.
14. Обчисліть масу (г) солі, яка утвориться внаслідок додавання до водного розчину масою 100 г з масовою часткою натрій гідроксиду 0,2 водного розчину нітратної кислоти масою 126 г з масовою часткою розчиненої речовини 10 %. Визначте колір лакмусу в розчині, який утвориться внаслідок реакції.
15. Обчисліть: а) об’єм (л) гідроген хлориду, який утвориться внаслідок реакції, для проведення якої взято водень об’ємом 1,2 л і хлор об’ємом 2,4 л (об’єми всіх газів виміряно за однакових умов); б) масу (г) осаду, який утвориться внаслідок змішування двох водних розчинів, один з яких містить аргентум(І) нітрат масою 17 г, а другий - натрій хлорид кількістю 0,2 моль; в) масу (г) натрій хлориду, для добування якого взято натрій масою 0,46 г і хлор об’ємом (н. у.) 1,12 л.; г) масу (г) осаду, який утвориться внаслідок змішування водного розчину масою 800 г з масовою часткою натрій сульфату 0,142 з водним розчином масою 400 г з масовою часткою барій нітрату 26,1 %.
16. Для здійснення реакції взяли 0,92 г натрію і 3,55 г хлору. Обчислити масу натрій хлориду, що утвориться.
17. Чи достатньо взяти 20 г алюмінію для реакції з киснем, щоб добути алюміній оксид масою 25,5 г?
18. Магній масою 9,6 г спалили в кисні масою 12 г. Яка маса магній оксиду утворилася? Чи залишилася після реакції одна з вихідних речовин? Якщо так, то яка саме? Обчисліть масу її залишку.
19. Яка маса осаду утвориться, якщо до розчину, що містить 0,08 моль ферум(ІІ) хлориду, додати 50 г розчину натрій гідроксиду з масовою часткою лугу 16 %?
20. У результаті реакції деякої маси алюмінію з хлором масою 7,1 г утворилося 8,9 г алюміній хлориду. Чи весь хлор прореагував?
21. Під час нагрівання оксиду NО2 об’ємом 4 л утворився оксид NО об’ємом 2 л і кисень. Обчисліть об’єм кисню. Чи відбулося повне перетворення нітроген(ІV) оксиду? Якщо ні, то знайдіть об’єм його залишку.
22. Після змішування зразка негашеного вапна масою 12,5 г з водою масою 10 г утворився кальцій гідроксид масою 14,8 г. Яка масова частка кальцій оксиду в зразку негашеного вапна?
23. У результаті реакції амоніаку з киснем за наявності каталізатора об’єм газової суміші збільшився на 100 мл і було виявлено 600 мл кисню, що не прореагував. Обчисліть масові частки газів у вихідній суміші.
24. До літій гідроксиду масою 6 г додали 60 г 10 %-го розчину гідроген фториду. В результаті експерименту добуто 5,2 г солі. Який відносний вихід продукту реакції?
ІV. Домашнє завдання:


про публікацію авторської розробки
Додати розробку

-

Арват Лариса Семенівна
08.04.2022 в 23:46
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Фесенко Ольга Сергіївна
09.12.2021 в 06:49
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Зубчик Віта Олександрівна
14.05.2021 в 05:55
Щиро дякую)
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Фурсова Олена Володимирівна
28.02.2021 в 14:51
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Паливода Анна Василівна
27.01.2021 в 19:56
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Потапова Галина Іванівна
23.01.2021 в 18:31
Дуже дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Закуренко Антоніна Аксентіївна
17.01.2021 в 19:35
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 4 відгука