Презентація по темі: "Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування."


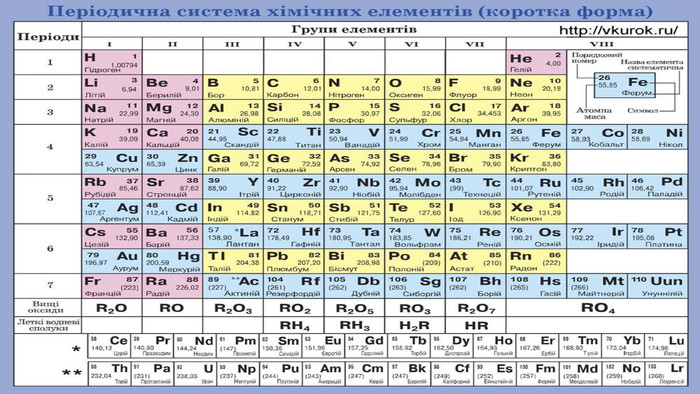

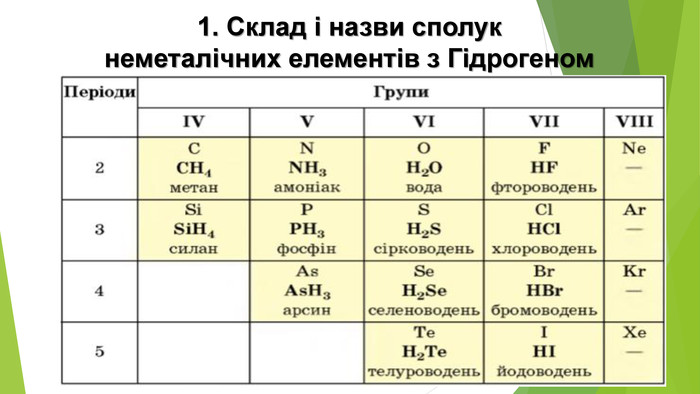
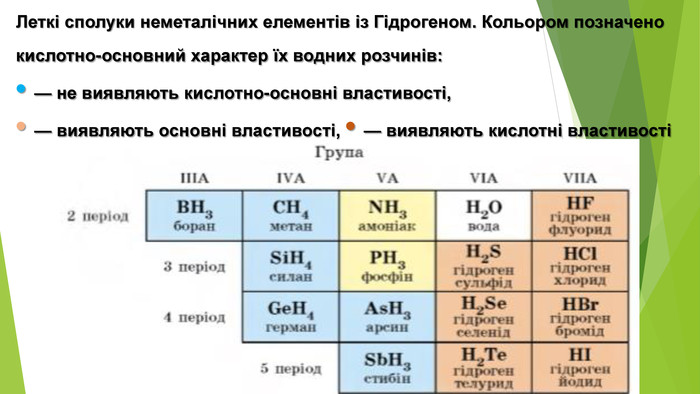


















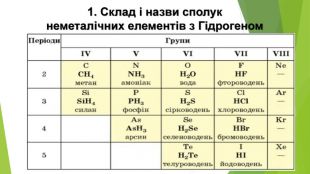
Особливості розчинення у воді гідроген хлориду й амоніаку. Сполуки неметалічних елементів із Гідрогеном мають молекулярну будову. Галогеноводні та амоніак дуже добре розчиняються у воді. На підставі електронної будови атомів Хлору й Нітрогену, розглянемо електронні та структурні формули продуктів їхньої взаємодії з Гідрогеном. Атому Хлору достатньо утворити одну спільну електронну пару з одним атомом Гідрогену, щоб зовнішній енергетичний рівень обох атомів став завершеним: Атом Нітрогену за рахунок трьох неспарених електронів зовнішнього енергетичного рівня утворює три спільні електронні пари з трьома атомами Гідрогену, і зовнішній енергетичний рівень кожного з атомів стає завершеним: Вид хімічного зв’язку в обох сполуках — ковалентний полярний. Спільні електронні пари зміщені в бік більш електронегативних атомів Хлору та Нітрогену.
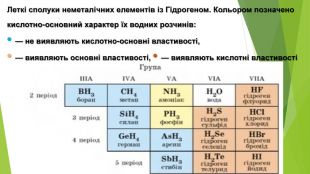
1. Хімічні властивості водних розчинів гідроген хлориду і гідроген сульфіду. Водний розчин НСl поводиться як сильна одноосновна кислота (ступінь дисоціації сполуки в розбавленому розчині перевищує 90 %), а розчин H2 S — як слабка двохосновна кислота. Хімічні назви цих розчинів — хлоридна кислота, сульфідна кислота.
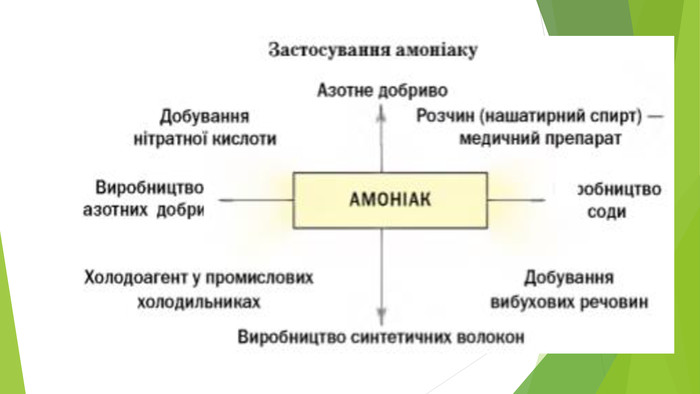
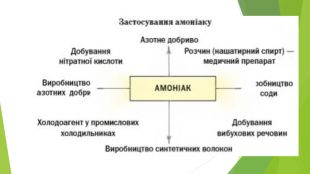
2. Хімічні властивості водного розчину амоніаку. Водний розчин амоніаку поводиться в хімічних реакціях як дуже розбавлений розчин лугу. У розчині амоніаку між його молекулами і молекулами води утворюються водневі зв’язки. Частина таких зв’язків спричиняє відокремлення катіонів Н+ від молекул води, які сполучаються з атомами Нітрогену молекул амоніаку ковалентним зв’язком за донорно-акцепторним механізмом: Аніони ОН- залишаються в розчині, створюючи в ньому лужне середовище. Реакція амоніаку з водою є оборотною:
За звичайних умов перетворення зазнає менше 1 % розчиненого амоніаку. Частина газу постійно виділяється з розчину і зумовлює його характерний запах. Розчин амоніаку іноді називають розчином амонійної основи. Її формулу правильно записувати так: Однак у хімічних рівняннях використовуватимемо іншу формулу — NH4 OH. Цей запис указує на схожість водного розчину амоніаку з розчинами лугів за хімічними властивостями. Крім формули NH4 OH, вживають і назву гіпотетичної сполуки — амоній гідроксид. Завдяки основним властивостям розчин амоніаку взаємодіє майже з усіма кислотами. Це — реакції нейтралізації, у результаті яких утворюються солі амонію:
Амоніак може взаємодіяти з хлороводнем і за відсутності води. Часто виконують відповідний дослід, відомий під назвою «Дим без вогню». Одну скляну паличку занурюють у концентрований розчин амоніаку, іншу — в концентровану хлоридну кислоту. Потім палички зближують. З’являється білий дим. Його утворюють дуже дрібні кристалики амоній хлориду — продукту реакції між газами (амоніак і хлороводень постійно виділяються із крапель розчинів, які залишилися на паличках): NH3 + НСІ = NH4 CI. Такий самий ефект можна спостерігати, якщо поставити склянки із вказаними розчинами поряд. Амоніак у водному розчині взаємодіє з багатьма солями. Реакції відбуваються з утворенням нерозчинної у воді основи або амфотерного гідроксиду:
3. Реакції сірководню й амоніаку з киснем. Сполуки неметалічних елементів з Гідрогеном (крім галогеноводнів) здатні горіти на повітрі або в атмосфері кисню. Це — окисно-відновні реакції. Вам відомо, що при горінні вуглеводнів залежно від кількості кисню можуть утворюватися вуглець, чадний або вуглекислий газ. Аналогічна особливість притаманна горінню сірководню: Амоніак горить в атмосфері кисню (але не на повітрі) з утворенням азоту і водяної пари: Якщо реакція відбувається за наявності каталізатора (платини), то замість азоту утворюється нітроген(ІІ) оксид:
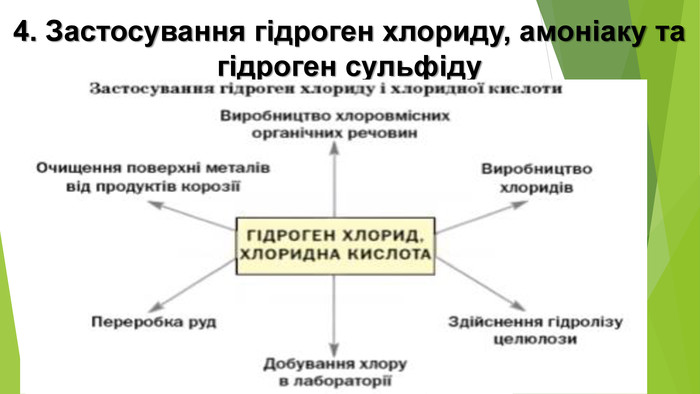
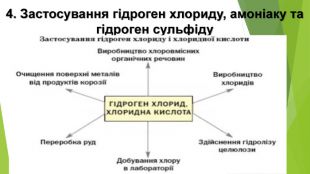
Гідроген сульфід - дуже токсична сполука, що обмежує його застосування. В аналітичній хімії його та сульфідну кислоту використовують для осадження важких металів, сульфіди яких малорозчинні. У медицині - у складі природних і штучних сірководневих ванн, а також деяких мінеральних вод. Також його застосовують для добування сульфатної кислоти, сірки, сульфідів. Головним лікувальним чинником курорту «Синяк» (Закарпаття) є Синяцька сірководнева вода, синюватий відтінок якої й зумовив назву санаторію
1. Поясніть, чому хлоридна і сульфідна кислоти істотно різняться за силою. 2. У розчині гідроген хлориду на кожну молекулу сполуки припадає 14 йонів. Обчисліть ступінь дисоціації гідроген хлориду в цьому розчині.3. Напишіть рівняння таких реакцій:4. Чому молекула амоніаку сполучається з катіоном Гідрогену? 5. Складіть молекулярні та йонно-молекулярні рівняння реакцій між водними розчинами: а) сірководню і барій гідроксиду; б) амоніаку і ферум(ІІІ) сульфату. 6. Яку масу 10 %-го розчину хлороводню потрібно взяти для реакції з магній оксидом масою 4г? 7. Який об’єм газу (н. у.) виділиться під час взаємодії достатньої кількості хлоридної кислоти з кальцій карбонатом масою 10 г? 8. Обчисліть об’єм розчину амоніаку з масовою часткою NH3 10 % і густиною 0,96г/см3, необхідний для осадження 26 г алюміній гідроксиду з розчину солі Алюмінію.9. Який об'єм амоніаку теоретично можна одержати з водню об'ємом б л та азоту об'ємом 3 л?
13. Обчисліть об'єм нітроген(ІІ) оксиду, який можна одержати шляхом каталітичного окиснення амоніаку об'ємом 100 л. Який об'єм кисню при цьому витратиться? 14. Який об'єм амоніаку (н. у.) потрібний для приготування його розчину масою 50 г із масовою часткою амоніаку 25 %? 15. Обчисліть об'єм амоніаку (н. у.), що утвориться під час нагрівання кальцій гідроксиду масою 9,2 г з амоній хлоридом масою 10,7 г.16. Обчисліть масу натрій нітрату, що можна одержати нейтралізацією розчину натрій гідроксиду масою 200 г із масовою часткою лугу 4% нітратною кислотою. 17. Сплав золота зі сріблом називають електрумом. Зразок такого сплаву масою 1,5 г обробили концентрованою нітратною кислотою. При цьому виділився нітроген(І\/) оксид об'ємом 89,6 мл (н. у.). Обчисліть масову частку золота в цьому зразку електруму. 18. Обчисліть масу нітратної кислоти, яку низкою перетворень можна добути з амоніаку об'ємом 5,6 л (н. у.), якщо відносний вихід продукту реакції становить 78%. 19. Змішали розчин нітратної кислоти масою 48 г із розчином калій гідроксиду масою 56 г, де масові частки розчинених речовин дорівнюють 26,25% і 16%, відповідно. Обчисліть маси розчинених речовин в отриманому розчині.
20. Запишіть рівняння реакцій для здійснення перетворень:21. Складіть рівняння реакцій для здійснення перетворень:22. Поживну цінність фосфатних добрив прийнято визначати, розраховуючи масову частку Р2 О5 у кожному з них. Обчисліть масову частку Р2 О5 у преципітаті. 23. Порівняйте масову частку Нітрогену в сечовині CO(NH2)2, амоніачній селітрі NH4 NО3 та натрієвій селітрі Na. NО3. Яке з цих добрив має найбільшу поживну цінність для рослин? 24. Юним агрономам дали завдання підгодувати яблуню амоніачною селітрою, приготувавши розчин: 1 г солі на 1 л води. Однак амоніачної селітри не було, і вони вирішили замінити її на калійну. Яку масу калійної селітри треба розчинити в 1 л води, щоб одержати розчин із тим самим умістом Нітрогену, що було потрібно? 25. Річну норму внесення в ґрунт фосфатних добрив визначають кількістю Р2 О5. Яка маса преципітату потрібна для обробки поля площею 50 га протягом року, якщо норма внесення фосфатного добрива становить 120 кг Р2 О5 на гектар?


про публікацію авторської розробки
Додати розробку






















-

Смакоуз Тамара Василівна
20.01.2024 в 19:48
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бузницька Ольга Миколаївна
08.12.2023 в 02:31
Дякую, колего!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кичук Світлана
29.10.2023 в 16:26
Дякую!
Загальна:
4.7
Структурованість
4.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

tv Даник
13.04.2023 в 13:06
Материал подготовлен хорошо, дизайн самой презентации отвлекает, должен быть минималистичный для эффективной подачи материала
Загальна:
4.3
Структурованість
3.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
15.12.2022 в 09:50
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ткаченко Руслана
12.12.2022 в 17:53
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Переверзева Інна Євгенівна
11.12.2022 в 21:10
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бурда Тетяна Валеріївна
04.12.2022 в 22:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Авєркіна Світлана Анатоліївна
28.11.2022 в 19:31
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
28.11.2022 в 08:32
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Безсонова Оксана
25.11.2022 в 16:11
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Полуда Тетяна Олександрівна
20.11.2022 в 18:55
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Калиновська Карина
31.03.2022 в 15:57
Загальна:
3.7
Структурованість
3.0
Оригінальність викладу
3.0
Відповідність темі
5.0
-

Maryshev Sergey
03.02.2022 в 18:58
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Повійчук Наталія
09.01.2022 в 21:48
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Bojko Oksana
07.10.2021 в 07:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мовчан Татьяна
25.04.2021 в 21:33
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Бурейко Віта Василівна
11.01.2021 в 02:11
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
Показати ще 15 відгуків