Опорний конспект з теми: "Алюміній. Сполуки алюмінію."
IІІ- A група, головна підгрупа Ф ізичні властивості Al
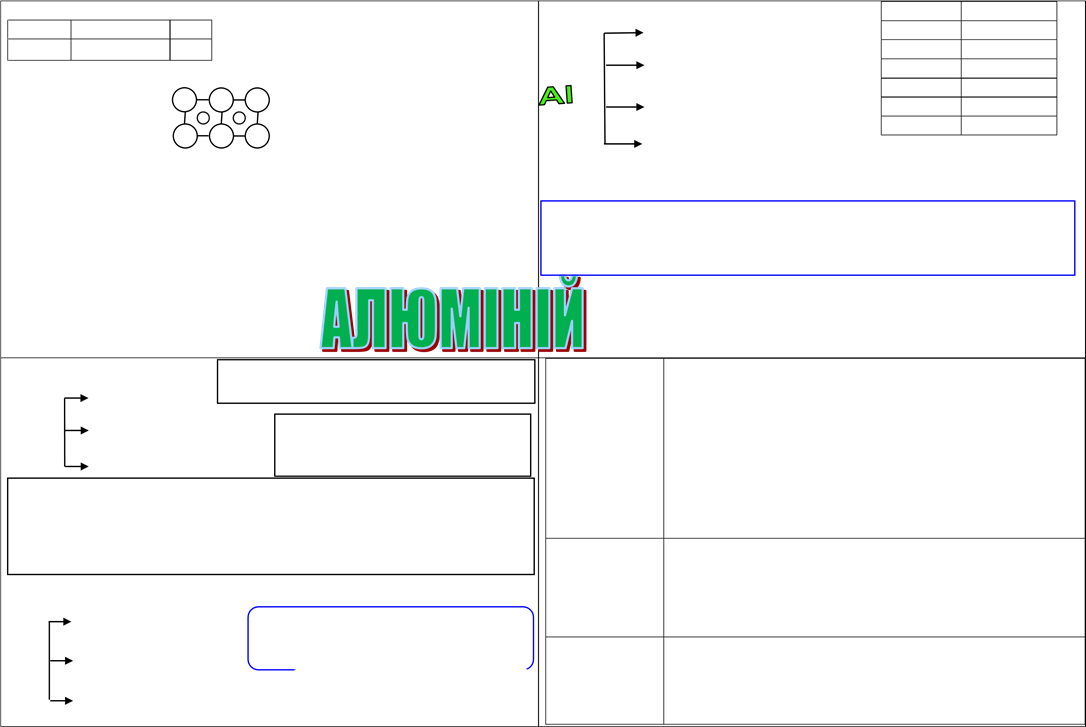 2s1 )) Бор (неМе) В - м’який, легкий, ковкий 3s1))) Алюміній Al - легко піддається обробці Валентність – ΙII, - електропровідний ступень окиснення +3, - теплопровідний Ме0 - 3ê → Ме+3 + + - сріблясто-білий з металевим
2s1 )) Бор (неМе) В - м’який, легкий, ковкий 3s1))) Алюміній Al - легко піддається обробці Валентність – ΙII, - електропровідний ступень окиснення +3, - теплопровідний Ме0 - 3ê → Ме+3 + + - сріблясто-білий з металевим
Металічна кристалічна -- -- блиском, що не втрачається в
ґратка: + порошкоподібному стані
В природі : 4 місце після О, Н та Si; вміст в Добування: земній корі - 8,8%; у вигляді алюмосилікатів : 1.Електроліз расплаву Al2O3 · 2SiO2 · 2H2O– каолін ( складова глини) Al2O3 в кріоліті
Al2O3 · nH2O– боксит 2Al2O3 → 4Al0 + 3O20
K2O · Al2O3 · 6SiO2 – польовий шпат( ортоклаз) 2.Відновленням без Na2O · Al2O3 · 2SiO2 або KNa3[AlSiO4] – доступу повітря
нефелін AlCl3 + 3K→3KCl + Al
Na3[AlF6] -кріоліт
Al2O3 - корунд (прозорі кристали)
Al2O3 + домішки Cr2O3 -червоний - рубін
Al2O3 + дом.TiO2 + Fe2O3 - синій - сапфір
Сполуки алюмінію Фізичні властивості Al2O3
+ МехОу→ сіль Білий,твердий, не розчинний у воді, амфотерний
Al 2О3 + кислотний оксид → сіль Добування Al2O3
4Al + 3O2 → 2 Al2O3
+ кислота → сіль + Н2О 2Al(OH)3→ Al2O3 + 3H2O
З лугами: Al2О3+2NaOH →2NaAlO2 + H2O (cплавляння)
Al2О3 +2NaOH+ 3Н2О →2Na[Al(OH)4]( у розчині)
Al2О3 +6NaOH+ 3Н2О →2Na3[Al(OH)6] ( надлишок лугу)
З солями: Al2О3 + CaCO3 = Ca(AlO2)2 + CO2 ↑ (cплавляння)
Фізичні властивості Al(OH)3
Білий,твердий, не розчинний у воді, амфотерний
→ Al2O3+ Н2О Добування Al(OH)3
AlCl3 + 3KOH→ Al(OH)3 + 3KCl Al( ОН) + кислота → сіль + Н2О Na[Al(OH)4]+ HCl → Al(OH)3 + NaCl + H2O
3333 Al(OH)3 + NaOH →Na[Al(OH)4]
+ NaOH→ NaAlO2 (сплавлення) ( у розчині)
Хімічні властивості Al AlCl3 - хлорид
+ О2→ Al2O3 ( алюміній оксид) Al2S3 -сульфід AlN - нітрид
+ неметал → сіль Al4C3 - карбід
AlР -фосфід
+ Н2О → Al(OH)3 ↓ + Н2 ↑ Al(ОН)3 - гідроксид
Al2(SO4)3 - сульфат
+ кислота→сіль + Н2 ↑( ряд активності Ме)
Al + HNO3 ( k) → не відбувається на холоді
Al + H2SO4 (k) → не відбувається на холоді
З лугами: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 ↑ метаалюмінат
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑ тетрагідроксоалюмінат
2Al + 6NaOH + 6H2O → 2Na3 [Al(OH)6] + 3H2 ↑гексагідроксоалюмінат
Алюмінотермія ( відновлення Ме із їх оксидів)
2Al + Cr2O3 → Al2O3 + 2Cr 8Al + 3Fe3O4 → 9Fe + 4Al2O3 терміт
З солями: 3CuSO4 + 2Al → Al2(SO4)3 + 3 Cu ↓
Застосування Отримують сплави ( дюралюміній-Al + 5% Cu + 2% Mg) -
Al використовують у судно- та машинобудуванні;
• Виготовляють електричні кабелі, дріт, корпуси автобусів, тролейбусів;
• Отримують Cr, Mo, W
• Алюмінієву фольгу для виготовлення конденсаторів, у харчовій промисловості;
• Для виготовлення тари для кислот; Для виробництва дзеркал;
• Виготовляють побутові предмети;
• З порошку – сріблясту фарбу;
• Термітне зварювання металів;
Застосування виготовляють круги для шліфування металевих виробів;
Al2O3 застосовують як адсорбент у хроматографії;
• Офтальмологічні скальпелі, кришталики ока;
• Термічно стійкий хімічний посуд;
• Цегли для мурування скловарних печей;
• Ювелірні вироби
Застосування Алюміній гідроксид - в медицині - для зниження кислотності Al(OH)3 шлункового соку ( алмагель, омез )
• Для очищення води , як адсорбент Алюмокалієвий галун використовують у медицині;
• Алюміній хлорид – як каталізатор в органічній хімії


про публікацію авторської розробки
Додати розробку
