Особливості взаємодії металів з нітратною та сульфатною кислотами
11 клас. Урок № 40. Дата ___________
Тема уроку: Особливості взаємодії металів з нітратною і концентрованою сульфатною кислотами.
|
Навчальна мета:
|
ознайомити учнів із особливостями взаємодії металів з нітратною і концентрованою сульфатною кислотами; показати схеми проходження хімічних реакцій, завдяки яким учні самостійно складатимуть рівняння даних кислот; |
|
Розвиваюча мета: |
розвивати увагу, вміння складати план і користуватись ним; розв'язувати різноманітні вправи та задачі; |
|
Виховна мета: |
виховувати старанність, допитливість, інтерес до предмету, ініціативність. |
|
Тип уроку: |
комбінований |
|
Форми роботи: |
фронтальна бесіда, мозковий штурм |
|
Обладнання: |
ПСХЕ, опорні схеми, презентація |
|
Література: |
|
Хід уроку
1. Організаційна частина (1хв)
1.1. Перевірка наявності учнів;
1.2. Перевірка готовності учнів до уроку;
2. Актуалізація опорних знань (4хв)
2.1. Оголошення теми програми і уроку
2.2. Перевірка домашнього завдання
2.2. Повторювання пройденого матеріалу
Інтерактивний метод «Третій зайвий»
1. Сульфур, Нітроген, Кисень. (Сульфур та Нітроген – хімічні елементи, кисень -речовина)
2.Оксиген, водень, Гідроген. (Оксиген, Гідроген – хімічні елементи, водень – речовина)
3. Золото, молоко, повітря. (Повітря, молоко – суміші, а золото – речовина)
3. Мотивація навчальної діяльності (2хв)
4. Основна частина (36хв)
Особливості взаємодії нітратної кислоти з металами.
Під час взаємодії з нітратною кислотою метали не витискають водень. З цією кислотою реагують активні метали й ті, що у витискувальному ряді металів стоять після водню.

Залежно від концентрації кислоти, крім солей та води утворюються сполуки Нітрогену. Порівняємо, як відбувається взаємодія міді з концентрованою та розведеною нітратною кислотою (замалюємо схему):
Взаємодія нітратної кислоти з міддю
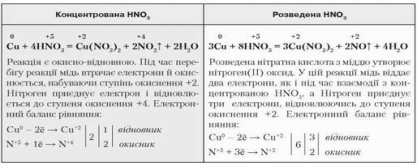
Концентрована нітратна кислота реагує з усіма металами так само, як з міддю. Нітроген відновлюється до ступеня окиснення +4, тобто утворюється нітроген (ІV) оксид. Однак розведена й дуже розведена нітратна кислота по-різному реагує з активними й малоактивними металами (замалюємо схему):
Взаємодія нітратної кислоти різної концентрації з металами
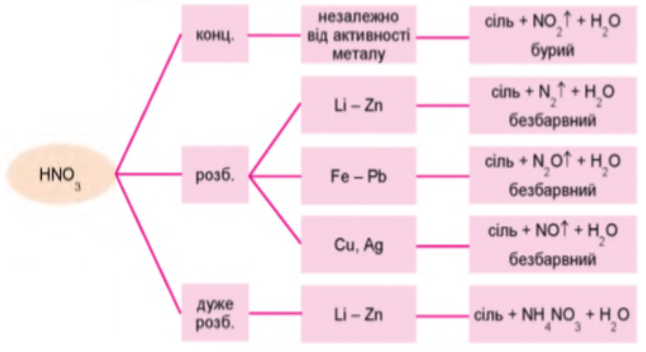
Проаналізувавши схему, дійдемо висновку, що більшість металів реагують з нітратною кислотою. За жодних умов не вступають у хімічну взаємодію платина, золото, родій, тантал та іридій. За звичайних температур (16-25 °С) алюміній, хром і залізо пасивуються під час контакту з нітратною кислотою. Суть процесу пасивування полягає в утворенні на поверхні металів тонких, дуже щільних захисних плівок оксидів алюмінію, хром(ІІІ) і ферум(ІІІ) оксидів, які з холодною нітратною кислотою не реагують.
Завдання для учнів. Складіть самостійно рівняння реакцій взаємодії срібла з концентрованою та розбавленою нітратною кислотою.
Особливості взаємодії сульфатної кислоти з металами
Концентрована сульфатна кислота реагує з металами, що в ряді активності розташовані до водню, і з тими, що після водню, зокрема міддю, ртуттю та сріблом. З металами, що стоять до водню, залежно від умов, Сульфур відновлюється до ступенів окиснення +4, 0 або -2. Під час взаємодії з міддю, ртуттю та сріблом — тільки до +4 (замалюємо схему):
Взаємодії концентрованої сульфатної кислоти з металами
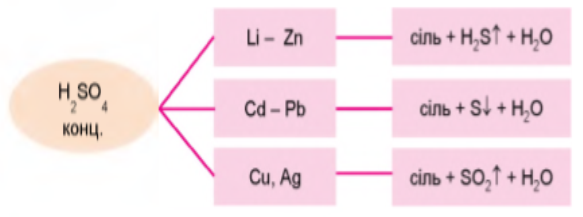
Отже, нітратна й сульфатна кислоти під час взаємодії з металами проявляють специфічні властивості, вони є сильними окисниками.
Узагальнення і систематизація знань, застосування їх у різних ситуаціях
Складіть рівняння реакцій за схемою: N2 → NO → NO2 → HNO3 → Mg(NO3)2.
1) N2+H2= NH3
2) 2NH3+O2=2NO+3H2↑
3) 2NO+O2= 2NO2
4) NO2+ H2O= HNO3
5) 10HNO3 (розв.) + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
Складіть рівняння реакцій між:
а) Ag і HNO3 (конц.);
Ag + 2HNO3 → AgNO3 + NO2 + H2O
б) Ag і HNO3 (розв.);
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
в) Zn і HNO3 (дуже розв.) з відновленням Нітрогену до ступеня окиснення 0;
![]()
г) Са і H2SO4 (конц.) з відновленням Сульфуру до ступеня окиснення -2;
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
Аурум масою 4,5 г повністю прореагував з концентрованою сульфатною кислотою. Обчисліть об'єм газу (н. у.), що виділився. Назвіть газ.
Дано:
m(Au)=4,5 г
Знайти: V(SO2)-?
Розв'язання:
Записуємо рівняння реакції:
4,5 г x л
Au + 2H2SO4 (конц.) = AuSO4 + SO2↑ + 2H2O
197 г 22,4 л
M(Аu)=197 г/моль, маса 1 моль=197 г
За н.у. 1 моль газу займає об'єм 22,4 л
x=V(SO2)=4,5г • 22,4 л : 197 г=0,5л
Відповідь: 0,5 л SO2, сульфур (IV) оксид
5. Підведення підсумків. Рефлексія. (2хв)
Учні разом з учителем перевіряють правильність оформлення опорного конспекту та правильність виконання практичних завдань, виправляють помилки. Рефлексія:
|
|
5.1. Повідомлення та обґрунтування оцінок
5.2. Домашнє завдання
5.3. Підготовка кабінету до наступного заняття.
![]()


про публікацію авторської розробки
Додати розробку
