Пакет лекційного матеріалу з Органічної хімії
Міністерство освіти і науки України Харківський державний автомобільно-дорожній коледж Лозівська філія
Пакет лекційного матеріалу
з дисципліни «Хімія»
Лозова
![]()
Міністерство освіти і науки України Харківський державний автомобільно-дорожній коледж Лозівська філія
Пакет лекційного матеріалу
з дисципліни «Хімія»
РОЗГЛЯНУТО ТА ПОГОДЖЕНО
на засіданні циклової комісії загальноосвітніх дисциплін
протокол №___ від «__» ______ 20__ року голова циклової комісії _______ В.В. Шарий Пакет лекційного матеріалу з дисципліни «Хімія» (органічна хімія) /
Н.І. Жук – Лозова: ЛФ ХДАДК, 2017. – 181 с.
Пакет лекційного матеріалу з дисципліни «Хімія» містить матеріали з таких тем, як «Теорія будови органічних сполук», «Вуглеводні», «Природні джерела вуглеводнів та їх переробка», «Оксигеновмісні сполуки», «Нітрогеновмісні сполуки», «Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі», «Роль хімії в житті суспільства». Матеріали складені відповідно до навчальної програми дисципліни «Хімія».
Для студентів денної форми навчання при вивченні дисципліни «Хімія» за спеціальностями 274 «Автомобільний транспорт», 133 «Галузеве машинобудування», 071 «Облік і оподаткування», 051 «Економіка»,
275 «Транспортні технології (за видами)»
ЗМІСТ
Тема 1. Теорія будови органічних сполук
Заняття 1. Теорія як вища форма наукових знань. Теорія хімічної 7
будови органічних сполук О.Бутлерова. Життя і діяльність О.Бутлерова
Тема 2. Вуглеводні
Заняття 2. Класифікація вуглеводнів. Утворення ковалентних 12
карбон-карбонових зв’язків у органічних сполуках. Види гібридизації
електронних орбіталей атома Карбону. Одинарний, подвійний, потрійний
зв’язки. Основні характеристики ковалентного зв’язку
Заняття 3. Алкани (парафіни). Загальна формула, структурна 20
ізомерія. Поняття про конформації. Систематична номенклатура
Заняття 4. Алкени. Гомологічний ряд етену. Структурна і 33
просторова ізомерія алкенів, номенклатура
Заняття 5. Алкіни. Гомологічний ряд етину. Структурна ізомерія, 40
номенклатура алкінів
Заняття 6. Бензен як представник ароматичних вуглеводнів, його 49
склад, будова молекули
Тема 3. Природні джерела вуглеводнів та їх переробка
Заняття 7. Природний і супутній нафтовий гази, їх склад і 55
використання
Заняття 8. Нафта. Склад, властивості нафти. Основні процеси 62
переробки. Застосування нафтопродуктів. Детонаційна стійкість бензину
Заняття 9. Кам’яне вугілля, продукти коксування кам’яного вугілля, 70
їх застосування
Заняття 10. Охорона довкілля від забруднень при переробці 75
вуглеводневої сировини та використанні продуктів переробки
Тема 4. Оксигеновмісні сполуки
Заняття 11. Спирти. Насичені одноатомні спирти. Ізомерія, 80
номенклатура насичених одноатомних спиртів
Заняття 12. Фенол, його склад, будова, властивості. Взаємний вплив 86
атомів у молекулі фенолу. Застосування фенолу. Охорона довкілля від
промислових відходів, що містять фенол
Заняття 13. Альдегіди. Склад, будова. Функціональна альдегідна 96
група. Ізомерія, номенклатура альдегідів
Заняття 14. Карбонові кислоти. Насичені одноосновні карбонові 101
кислоти. Номенклатура
Заняття 15. Естери. Склад, властивості, добування та застосування 114
естерів
Заняття 16. Жири, їх склад, хімічна будова. Гідроліз, гідрування 119
жирів. Біологічна роль жирів
Заняття 17. Мило, його мийна дія. Відомості про синтетичні мийні 130
засоби, їх значення. Захист природи від забруднення синтетичними
мийними засобами. Поняття про спектральні методи встановлення
структури органічних сполук
Тема 5. Нітрогеновмісні сполуки
Заняття 18. Аміни, їх склад, будова, властивості 140
Заняття 19. Амінокислоти. Ізомерія. Особливості хімічних 147
властивостей. Пептиди. Пептидний зв'язок
Заняття 20. Білки як високомолекулярні сполуки. Рівні структурної 155
організації білків. Властивості білків
Тема 6. Синтетичні високомолекулярні речовини і полімерні
матеріали на їх основі
Заняття 21. Залежність властивостей полімерів від їхньої будови. 166
Термопластичні і термореактивні полімери. Поліетилен, поліпропілен, полівініхлорид
Тема 7. Роль хімії в житті суспільства
Заняття 22. Роль хімії у розв’язувані продовольчої та екологічної 171 проблем. Найважливіші хімічні виробництва в Україні
Заняття 23. Хімія
і здоров’я людини. Шкідливий вплив вживання 176
алкоголю,
наркотичних речовин, куріння на здоров’я людини. Роль хімії у розв’язанні
проблеми ВІЛ/СНІДу та інших захворювань
ТЕМА 1. ТЕОРІЯ БУДОВИ ОРГАНІЧНИХ СПОЛУК
Заняття №1
Дисципліна: «Хімія»
Тема заняття: Теорія як вища форма наукових знань. Теорія будови органічних сполук. Життя і діяльність О. Бутлерова Мета заняття:
навчальна – ознайомити студентів з основними положеннями теорії хімічної будови органічних сполук О. Бутлерова, охарактеризувати сутність сучасної теорії будови органічних сполук, її значення; сприяти формуванню судження про роль теорії в системі наукових знань;
розвиваюча – розвивати вміння порівнювати, робити висновки; виховна – виховувати цілеспрямованість, розширювати світогляд студентів.
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: моделі молекул органічних речовин
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с.
9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань (бесіда) Дайте відповідь на питання:
• Яку інформацію ми можемо отримати, знаючи формулу речовини?
• Пригадайте, які особливості складу і будови органічних речовин?
• Від чого залежать властивості органічних речовин?
ІІІ Мотивація навчальної діяльності
Перед вами невідома речовина органічного походження. Спробуйте її ідентифікувати за такими ознаками (хто швидше здогадається):
ü рідина добре розчинна у воді;
ü має специфічний різкий запах;
ü забарвлює лакмус у рожевий колір;
ü активно реагує з основами, солями, особливо карбонатами (содою).
Яким чином ви визначили, що перед вами за речовина?
Сьогодні ми з’ясуємо, яким чином пов’язані склад та властивості речовин.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Суть теорії будови.
3. Біографія Олександра Михайловича Бутлерова.
4. Закріплення вивченого матеріалу.
5. Підсумки заняття і домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ.
Багато вчених-хіміків вивчали органічні речовини. Але головною метою був пошук шляхів синтезу нових речовин. Для цього була необхідна теорія, що дозволила б пояснити вже відомі факти й нові відкриття. Такою теорією в органічній хімії є теорія хімічної будови, основні положення якої сформулював у своїх наукових працях 0. М. Бутлеров. Створення теорії хімічної будови органічних сполук О. М. Бутлеровим у 60-х роках XIX ст. було найвидатнішою подією в історії розвитку органічної хімії.
19 вересня 1861 року на з’їзді німецьких натуралістів і лікарів О. М. Бутлеров доповідав про нові теорії в органічній хімії. Він висунув нове поняття — «структура», що відбивало послідовність будови атомів у молекулі. Так народилася структурна теорія, або теорія хімічної будови.
2. СУТЬ ТЕОРІЇ БУДОВИ
Суть теорії будови можна звести до таких положень:
1. Атоми у молекулах сполучені один з одним у певній послідовності відповідно до їх валентності.
В органічних сполуках органогенні елементи мають сталу валентність – (Карбон –IV, Гідроген – І, Оксиген – ІІ, Нітроген – ІІІ).
2. Властивості речовин залежать не лише від того, які атоми і в якій кількості входять до складу молекул, а й від того, в якому порядку вони сполучені між собою, тобто від хімічної будови молекул.
Наприклад, дві різні речовини етанол і диметиловий етер мають одну і ту ж саму молекулярну формулу С2Н6О, але послідовність сполучення їх атомів різна, що визначає відмінні властивості:
СН3–СН2–ОН – етанол добре розчинний у воді; СН3–O–СН3 – диметиловий етер не розчинний.
3. Знаючи властивості органічних речовин, можна встановити їх хімічну будову і навпаки за будовою - спрогнозувати властивості.
Передбачте, до якого класу органічних речовин належать:
ü вуглеводень, який знебарвлює бромну воду;
ü летка речовина, що добре розчиняється у воді і горить
блакитним полум’ям.
Спрогнозуйте, які фізичні та хімічні властивості будуть у:
ü бутадієну СН2 = СН – СН = СН2;
ü масляної кислоти C3H7COOH;
4. Атоми або групи атомів, які утворюють молекулу, взаємно впливають один на одного, що й зумовлює реакційну здатність молекули.
СН4 – метан – хімічно інертний насичений вуглеводень.
CH3ОН – спирт метанол, хімічно активна сполука.
Гідроксогрупа підвищує активність вуглеводневого залишку, водночас вуглеводневий залишок послаблює основні властивості гідроксогрупи, тому спирт не є основою.
Таким чином, теорія хімічної будови органічних сполук – це вчення про взаємний зв’язок, розміщення і взаємний вплив атомів у молекулах органічних речовин.
З виникненням теорії хімічної будови органічна хімія вийшла із лабіринту типових формул. Завдяки цій теорії були знайдені шляхи до пізнання внутрішньої будови молекул, з'явилась теоретична основа для розуміння хімічних процесів. Теорія хімічної будови дозволила класифікувати не тільки весь нагромаджений на той час, але й новий експериментальний матеріал. Хіміки, користуючись цією теорією, могли передбачити як нові шляхи синтезу органічних речовин, так і можливу кількість органічних сполук певного складу.
3. БІОГРАФІЯ ОЛЕКСАНДРА МИХАЙЛОВИЧА БУТЛЕРОВА
Олександр Михайлович Бутлеров (1828—1886)
Російський хімік-органік, професор Казанського (1854—1868), а далі до кінця життя професор Петербурзького університетів, академік Петербурзької АН (з 1871). Почесний член Московського і Київського університетів. Засновник великої школи російських хіміків-органіків. Створив і обгрунтував теорію хімічної будови. Добув ізобутен і відкрив реакцію його полімеризації. Синтезував низку органічних сполук, серед яких перший в історії хімії синтез цукристої речовини (1861). Його праці з гідратації етилену покладено в основу одного з сучасних способів добування етилового спирту.
4. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
«Мікрофон»
Якби ви продовжили твердження: «Відкриття О.Бутлерова в органічній хімії можна порівняти з …»?
«Екстрасенси»
ü Невідомі речовини мають склад: С3Н6, С3Н8О, С4Н8О2.
Запропонуйте можливі їх структурні формули, вкажіть клас речовин, до якого вони належать.
Спробуйте передбачити властивості даних речовин.
5. ПІДСУМКИ ЗАНЯТТЯ І ДОМАШНЄ ЗАВДАННЯ
Вивчити матеріал заняття. Підготувати повідомлення на тему «Життя та діяльність О.Бутлерова».
ТЕМА 2. ВУГЛЕВОДНІ
Заняття №2
Дисципліна: «Хімія»
Тема заняття: Класифікація вуглеводнів. Утворення ковалентних С–С зв’язків у органічних сполуках. Види гібридизації електронних орбіталей атома Карбону. Одинарний, подвійний, потрійний зв’язки. Основні характеристики ковалентного зв’язку Мета заняття:
навчальна – розширити і поглибити знання студентів про класи вуглеводнів, види гібридизації атома Карбону, ознайомити студентів з основними характеристиками ковалентного зв’язку, порівняти за цими характеристиками одинарний, подвійний та потрійний зв'язок, показати взаємозв’язок будови та властивостей вуглеводнів;
розвиваюча – розвивати вміння порівнювати речовини, робити висновки
про їх властивості на основі будови і навпаки, формувати навички самостійної роботи;
виховна – виховувати критичність мислення, цілеспрямованість.
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: моделі молекул вуглеводнів різних класів
(метану, етену, етину, бензену)
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с.
9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ І Організаційний момент:
• привітання з групою; перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань (бесіда) Дайте відповідь на питання:
1. Які органічні речовини називають вуглеводнями?
2. Назвіть їх гомологічні ряди?
3. В чому полягає відмінність між ними?
4. Які зв’язки характерні для вуглеводнів?
ІІІ Мотивація навчальної діяльності
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
3. Підсумки заняття і домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Вуглеводні – органічні речовини, до складу яких входять атоми Карбону та Гідрогену.
Пригадайте представників кожного класу, особливості їх будови та властивостей.
Згідно з сучасними уявленнями усі особливості органічних сполук пов’язані з властивостями елемента Карбону: у нього на зовнішньому шарі 4 електрони, тому він не схильний активно приєднувати чи віддавати електрони, займає в цьому проміжне положення між металами та неметалами, здатний утворювати стійкі сполуки з ковалентним зв’язком.
При цьому атом Карбону перебуває у збудженому стані.
|
|
|
|
![]() С* 2s ↑ 2 p
С* 2s ↑ 2 p
За рахунок неспарених електронів Карбон утворює 4 ковалентні зв’язки з неметалічними елементами (С, Н, О). При цьому беруть участь як s, так і p-електрони, отже за силою ці зв’язки мали б бути неоднакові. Проте було доведено, що зв’язки рівноцінні.
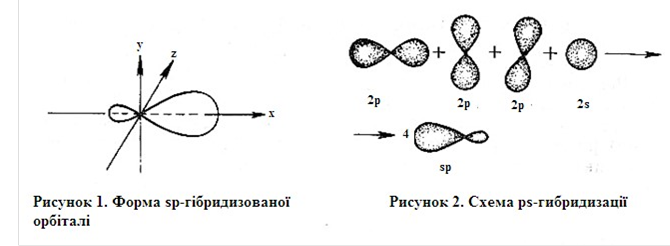
Пояснення цьому дає явище гібридизації – утворення однакових орбіталей внаслідок перерозподілу електронної густини різних за формою та енергією орбіталей.
Гібридизація сприяє повнішому перекриванню орбіталей і збільшенню міцності зв’язку.
Ковалентний зв'язок характеризується такими параметрами:
• енергією – вказує на його міцність (кДж/моль);
• довжиною – визначається відстанню між центрами ядер атомів (1 нм);
• полярністю – зумовлена зміщенням електронної густини до більш електронегативного атома (δ- і δ+);
• просторовою напрямленістю – взаємне розташування зв’язків, кут між ними.
Види зв’язку: σ - зв'язок – перекривання електронних орбіталей у одному місці по лінії,
що з’єднує ядра атомів; π – зв'язок – перекривання електронних орбіталей у двох місцях поза лінією, що з’єднує ядра атомів.
Особливості зв’язків
|
Характеристики зв’язку |
Одинарний |
Подвійний
|
Потрійний
|
|
Довжина
Енергія
Кут
Гібридизація
Види зв’язків
|
0,154 нм
343 кДж/моль
109º
sp3
σ – зв'язок |
0,134 нм
611 кДж/моль
120º
sp2 σ – зв'язок, 1 π – зв'язок |
0,120 нм
837 кДж/моль
180º
sp
σ – зв'язок 2 π – зв'язки |
Просторова будова та гібридизація алканів
• метану
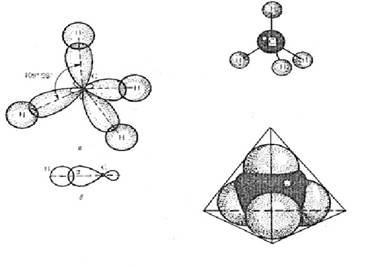
• етану
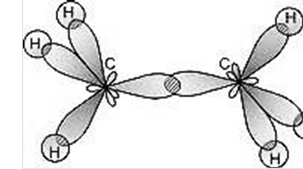
Схема зв’язків у алкенів
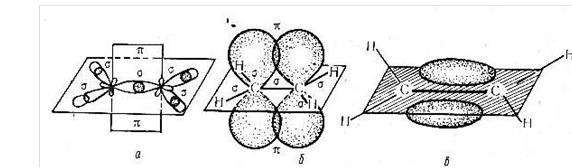
Схема зв’язків у алкінів
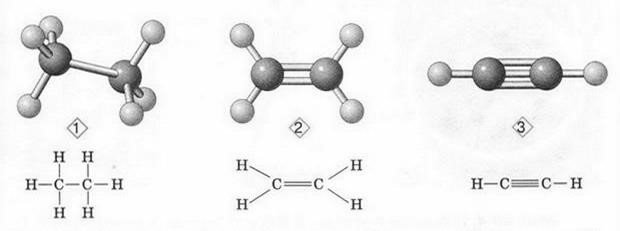
Кулестержневі моделі молекул та їх напіструктурні формули
1 - етану 2 - етену 3 - етину
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Бесіда
ü Чому енергія подвійного зв’язку не у два рази більша, ніж в одинарного?
ü Яким чином пов’язана довжина зв’язку та його енергія?
ü Як впливає тип зв’язку на властивості речовин?
ü Для наступних речовин вкажіть особливості зв’язку: С4Н8, С2Н6, С5Н8.
Скільки σ - і π – зв'язків у них?
Задача.
1. Відносна густина парів алкану за повітрям – 3,93. Яка його формула?
(С8Н18)
2. Відомо, що 1,12 л алкану мають масу 2,9 г. Яка його молекулярна і
структурна формула? (С4Н10)
3. ПІДСУМКИ ЗАНЯТТЯ І ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф, виконати вправи
19
ТЕМА 2. ВУГЛЕВОДНІ
Заняття №3
Дисципліна: «Хімія»
Тема заняття: Алкани (парафіни). Загальна формула, структурна ізомерія.
Поняття про конформації. Систематична номенклатура
Мета заняття:
навчальна – розширити і поглибити знання студентів про будову
алканів, їх ізомерію, cформувати поняття про просторову ізомерія (стереоізомерію), конформери та їх види, сформувати в студентів вміння називати алкани за систематичною номенклатурою та складати структурні формули за їх назвою, продовжувати розвивати навички написання структурних формул ізомерів;
розвиваюча – розвивати логічне мислення, просторову уяву; виховна – виховувати цілеспрямованість, самостійність, критичність мислення.
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: моделі молекул вуглеводнів,
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ:
Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с.
9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань (усне опитування) Письмове опитування (додаток 1) Дайте відповідь на питання:
• Назвіть класи вуглеводнів та коротко їх охарактеризуйте.
• Які особливості зв’язків у органічних сполуках?
• Чим характеризується ковалентний зв'язок?
• Порівняйте одинарний, подвійний та потрійний зв'язок за різними
параметрами.
• Як впливає тип зв’язку на властивості речовини?
• Чим характеризуються алкани?
• Яка їх загальна формула?
• Які особливості будови алканів? Що таке ізомери?
ІІІ Мотивація навчальної діяльності
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Ізомерація алканів.
3. Номенклатура алканів.
4. Закріплення вивченого матеріалу.
5. Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Алкани (парафіни) – насичені вуглеводні з загальною формулою СnН2n+2.
У них атоми Карбону між собою сполучені одинарними зв’язками і максимально насичені атомами Гідрогену, тому більше їх приєднувати не здатні.
Інша їх назва «парафіни» – малодіяльні.
Особливості будови алканів:
ü атоми Карбону сполучені простими σ-звязками, між ними можливе вільне обертання;
ü властива sp3 – гібридизація;
ü ланцюг має зигзагоподібну форму з кутом 109º.
Найпростіший представник – метан. Згідно з однією з теорій, життя виникло тоді коли Земля була оточена атмосферою метану, води, амоніаку та водню. Під дією енергії Сонці ці молекули вступали у взаємодію, утворивши складні органічні сполуки (білки). Цю теорію підтвердили експериментально.
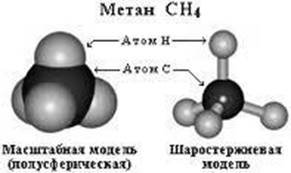
2. ІЗОМЕРІЯ АЛКАНІВ
Ізомерія – явище існування сполук з однаковим складом, але різною будовою та властивостями.

Ізомерія в алканів буває:
1. Структурна – пов’язана з послідовністю атомів алкани з нерозгалуженим ланцюгом називають нормальними, а з розгалуженим – ізобутан, ізопентан);
2. Просторова (стереоізомерія) – пов’язана з взаємним розташуванням атомів у просторі.
Різновидом просторової ізомерії є конформаційна ізомерія.
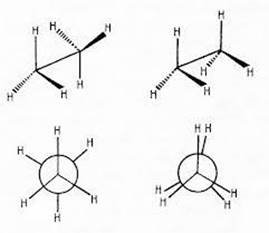
Під час обертання навколо С-С зв’язків атоми Гідрогену займають різне положення: коли вони максимально віддалені, енергія молекули є мінімальною і така структура є стійкою, тому обертання призупиняється, а такі конформери (різновиди) називають загальмованими; у протилежному випадку вони наближені і в проекції затіняють один одного, тому їх називають затіненими. Конформери зручно зображувати за допомогою формул Ньюмена.
Із збільшенням числа атомів Карбону кількість конформерів зростає (в бутану 3).
3. НОМЕНКЛАТУРА АЛКАНІВ
Назви перших 4 представників склалися історично, а решта походить від грецьких числівників.
|
Гомологічний ряд метану |
Число ізомерів |
|
СН4 |
1 |
|
С2Н6 |
1 |
|
С3Н8 |
1 |
|
С4Н10 |
2 |
|
С5Н12 |
3 |
|
С6Н14 |
5 |
|
С7Н16 |
9 |
|
С8Н18 |
18 |
|
С9Н20 |
35 |
|
С10Н22 |
75 |
|
С15Н32 |
4347 |
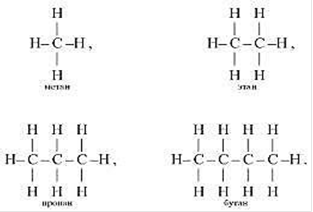
СН4 – метан;
С2Н6 – етан;
С3Н8 – пропан;
С4Н10 – бутан;
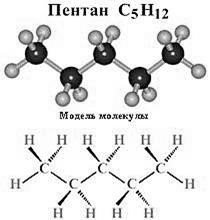
С5Н12 – пентан;
С6Н14 – гексан;
С7Н16 – гептан;
С8Н18 – октан;
С9Н20 – нонан;
С10Н22 – декан; С11Н24 – ундекан;
С20Н42 – ейкозан.
Пригадайте, що таке гомологи?
Що називають гомологічною різницею?
Складіть для перших представників алканів електронні, структурні та напівструктурні формули.
Коли потрібно назвати ізомери з розгалуженою будовою, то застосовують номенклатуру ІЮПАК.
Схема назви: префікси (замісники в алф. пор.) + корінь (головний ланцюг алк-) + суфікс (-ан).
Замісник – залишок, утворений при відщепленні Гідрогену, в його назві замість –ан суфікс – ил.
СН3 – метил С2Н5 – етил С3Н7 – пропіл (ізопропіл) С4Н9 – бутил.
Порядок номенклатури:
1. Вибір найдовшого ланцюга.
2. Його нумерація за принципом найменшого локанта (номер атома Карбону, біля якого розташований замісник), якщо замісники розташовані на однаковій відстані, то враховують алфавітний порядок назв.
3. Визначення замісників та їх локанта в алфавітному порядку, якщо кілька однакових замісників, то використовують префікси ди-, три-, тетра-.
4. Називання головного ланцюга.
2 1
СН2 – СН3
| 3 4 5 6
СН3 – СН – СН – СН2 – СН – СН3
| | 7 8
С2Н5 СН2 – СН3 4-етил-3,6-диметилоктан
Назвіть всі ізомери пентану:
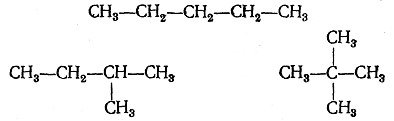
Атоми Карбону в органічних сполуках поділяють на:
1. первинні – сполучені з одним Карбоном;
2. вторинні – сполучені з двома атомами Карбону;
3. третинні – сполучені з трьома атомами Карбону;
4. четвертинні – сполучені з чотирма атомами Карбону.
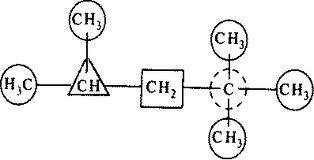
Визначте первинні, вторинні, третинні та четвертинні атоми Карбону у вуглеводні:
I
СН3
I II | III I
СН3 – СН – С(IV) – СН – СН3
I | І |
СН3 СН3
4. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Робота в парах:
1. Напишіть формулу алкану за назвою, вкажіть (I,II,III,IV) – ні атоми Карбону:
• 2,5-диметилгексан;
• 4-бром-2,2-диметилпентан;
• 3-етил-2-метилгептан;
• 2,2,3-триметилпентан.
2. Серед наведених формул знайдіть:
a) Ізомери;
b) Гомологи.
Назвіть їх
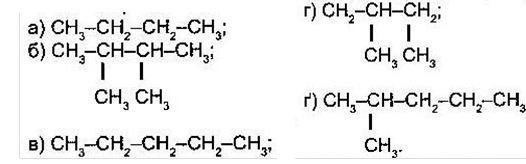
3. Назвіть алкани з такими напівструктурними формулами, знайдіть серед них ізомери:
а
 б
б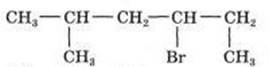
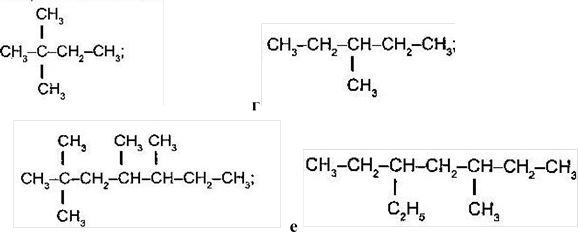 в
в
д
5. ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф, виконати вправи.
Додаток 1
|
Варіант 1 1. Вкажіть формули сполук, що є газами: |
|
|
a) С2Н6; c) С18Н38; b) С8Н16; d) С6Н14;
|
e) С4Н10. |
2. Яка загальна формула алкенів:
а) СnН2n-6; в)СnН2n-2; с) СnН2n+2; d) СnН2 n.
3. У молекулі алкінів містяться:
a) 2 π- зв’язки і решта σ- зв'язки ;
b) всі σ - зв’язки;
c) 1 π і решта σ - зв'язки.
4. Встановіть відповідність між формулою та класом, до якого належить сполука:
|
1. алкін; 2. алкан; 3. алкен;
|
a) С5Н10; b) С8Н18; c) С4Н6; d) С7Н16. |
5.Відносна густина за воднем пари алкену 35. Визначте його формулу.
Варіант 2
1.Продуктами реакції горіння органічних речовин є:
|
a) сажа і вуглекислий газ; b) вода і метан;
2. Виберіть з переліку алкени: |
c) d) |
чадний газ і кисень; вуглекислий газ і вода. |
|
a) С5Н10; b) С7Н12;
|
c) С8Н16; |
d) С4Н10. |
3. В алканів атом Карбону перебуває у гібридизації
а)SP3; b) SP4; с) SP; d) SP2.
4. Встановіть відповідність між формулою та агрегатним станом речовини за нормальних умов:
1. С8Н16;
2. С6Н14; a) газоподібні речовини;
3. С4Н10 b) рідини;
4. С18Н36; c) тверді сполуки.
5. С2Н6;
5.Відносна молекулярна маса алкану становить 86. Знайдіть молекулярну формулу.
Варіант 3
1. Які з вуглеводнів мають ізомери:
|
a) С2Н6; b) С4Н10; c) С6Н14;
2. У молекулі алканів кут між зв’язками становить: |
d) С3Н8. |
|
a) 180º; b) 120º; c) 109º;
3. До алкінів належать: a) С8Н18; d) С6Н14; b) С5Н8; e) С2Н2; c) С7Н12; f) С4Н10.
|
d) 90º. |
4. Встановіть відповідність між речовиною та зв’язками в молекулі:
1. С4Н6; a) всі σ - зв’язки;
2. С2Н6; b) 1 π і решта σ-зв'язки;
3. С3Н6; c) 2 π-зв’язки і решта σ- зв'язки.
5. Відносна густина за воднем пари алкану 57, визначте його формулу.
Варіант 4
1. Для етену властива гібридизація:
а) SP2; b) SP3; с) SP; d) SP4.
2. До алканів належать:
|
a) С8Н18; b) С5Н10;
3. У ізомерів: |
c) С7Н12; d) С2Н4; |
e) С4Н10; f) С6Н14; |
g) С18Н38. |
a) різний склад, але однакова будова та властивості;
b) однаковий склад, будова та властивості;
c) однаковий склад і різна будова та властивості;
d) однаковий склад та будова, але властивості різні.
4. Встановіть відповідність між класом сполук та просторовою будовою молекули:
|
1. піраміда; 2. кутова; 3. лінійна;
|
a) алкани; b) алкени; c) алкіни. |
5. Визначте молекулярну формулу насиченого вуглеводню, густина пари за воднем якого 36. Складіть формули його ізомерів.
ТЕМА 2. ВУГЛЕВОДНІ
Заняття № 4
Дисципліна: «Хімія»
Тема заняття: Алкени. Гомологічний ряд етену. Структурна і просторова ізомерія, номенклатура
Мета заняття:
навчальна – розширити і поглибити знання студентів про будову
алкенів, їх ізомерію, cформувати поняття про просторову ізомерія (геометричну цис- та транс-ізомерію), ознайомити студентів з систематичною номенклатурою алкенів, сформувати вміння називати алкени за систематичною номенклатурою та складати структурні формули алкенів за їх назвою, продовжувати розвивати навички написання структурних формул ізомерів;
розвиваюча – розвивати просторове мислення та уяву, вміння порівнювати, узагальнювати, робити висновки;
виховна – виховувати самостійність, критичність мислення.
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: моделі молекул вуглеводнів, набір для складання кулестержневих моделей молекул
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с.
9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань (бесіда) Дайте відповідь на питання:
• Що таке гомологічний ряд?
• Чим характеризуються алкени? Що відрізняє їх від алканів?
• Яка загальна формула алкенів?
• Які особливості будови алкенів?
ІІІ Мотивація навчальної діяльності
Двоє студентів посперечалися: один стверджував, що речовина складу С4Н8 належить до насичених вуглеводнів, а інший доводив, що до ненасичених.
Хто зі студентів був правий?
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Номенклатура алкенів.
3. Закріплення вивченого матеріалу.
4. Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Алкени (олефіни від лат.oleum – рослинна олія) – ненасичені вуглеводні, у яких відкритий карбоновий ланцюг має один подвійний зв'язок.
Особливості будови алкенів: (демонстрація моделей молекул)
ü властива sp2 – гібридизація;
ü між двома атомами Карбону є подвійний зв'язок (σ - зв'язок, 1 π –
зв'язок);
ü кут між зв’язками 120º;
ü довжина зв’язку С=С 0,134 нм, а енергія – 620 кДж.
1. Чим відрізняються σ – зв'язок і π – зв'язок?
2. Чому кут у алкенів такої величини?
3. Як пов’язана гібридизація та просторова будова молекул?
Загальна формула СnН2n
Найпростіший представник – етен.
С2Н4 - молекулярна формула
СН2=СН2 - напівструктурна формула
Н Н
![]() С=С
С=С
![]()
Н Н – структурна формула
Гомологічний ряд етену:
С2Н4 – етен;
С3Н6 – пропен;
С4Н8 – бутен;
С5Н10 – пентан;
С6Н12 – гексен;
С7Н16 – гептен і т.д.
Складіть структурну і напівструктурну формули пропену та бутену
Ізомерія алкенів обумовлена наявністю подвійного зв’язку і буває кількох видів:
ü структурна – пов’язана з різною будовою карбонового ланцюга (С=С–С–С або С=С–С) і з місцем подвійного зв’язку С–С=С–С або С=С–С–С– С;
ü просторова (геометрична або цис-, транс- ізомерія).
Обертання навколо С=С зв’язків неможливе, оскільки для цього потрібно розірвати зв’язок. Тому в алкенів існує геометрична ізомерія. Вона притаманна сполукам, в яких атоми Карбону з подвійним зв’язком мають замісників. Ці замісники можуть розташовуватися у двох положеннях: по одну сторону від подвійного зв’язку (цис-ізомери) або по-різні сторони (транс-ізомери). Для прикладу розглянемо бутен.

цис-бутен (t плавлення 3,7º) транс-бутен (t плавлення 0,9º)
Обов’язковою умовою існування просторових ізомерів є наявність біля атомів Карбону з подвійним зв’язком різних замісників.
ü Чи мають геометричні ізомери етен, пропен?
ü Зобразіть цис- та транс-ізомери пентену.
ü Зобразіть можливі ізомери бутену.
ü Де більше ізомерів: у алканів чи алкенів?
Із збільшенням числа атомів Карбону кількість ізомерів зростає (в бутену 4).
2. НОМЕНКЛАТУРА АЛКЕНІВ
Схема назви: префікси (замісники в алф. пор.) + корінь (головний ланцюг алк-) + суфікс (-ен)
Порядок номенклатури:
1. вибір найдовшого ланцюга (з подвійним зв’язком)
2. його нумерація з кінця, де ближче подвійний зв’язок
3. визначення замісників та їх локанта в алфавітному порядку
4. назва головного ланцюга, визначення місця подвійного зв’язку +
суфікс -ен.
Приклад
1 2 3 4
СН3 = СН – СН – СН3 – бут-1-ен
1 2 3 4
СН3 – СН = СН – СН3 – бут-2-ен
 2 – метилпропен
2 – метилпропен
4 3 2 1
СН3 – СН = С– СН3 – 2-метилбут-2-ен
|
СН3
1 2 3 4 5
СН3 – СН =СН – СН2 – СН – СН3
| |6 7
СН3 СН2 – СН3 – 4,5-диметилгепт-2-ен
3. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Бесіда:
ü Чому у алкенів більше ізомерів, ніж у алканів?
ü Який клас вуглеводнів є ізомерним до алкенів? (приклад
міжкласової ізомерії)
Завдання (робота в парах)
1. Виберіть з переліку представників ряду алкенів: С5Н10; С8Н18;
С7Н14; С4Н10 С2Н4; С6Н14; С18Н36
2. Для яких сполук можлива цис- транс-ізомерія: пент-1-ен, пент-2-ен, 2-метилбут-2-ен?
3. Напишіть формулу алкану за назвою, вкажіть (I,II,III,IV) – ні атоми Карбону:
• 3-метилпент-1-ен;
• 3-етил-4,4-диметилгекс-1-ен;
• 4-бутил-3,3-диетил-2,5,6-триметилнон-1-ен;
• цис-3-метил-4-хлоргекс-3-ен;
• транс-3,4-диметилгепт-3-ен.
4. Назвіть сполуки:
СН3 СН3
| |
А) СН3 – СН - СН– СН = СН2
Б) СН3 – СН2 – СН – СН2 – С = СН2 В)СН3 – СН = С – СН2 – СН - СН3
| | | |
С2Н5 СН3 С3Н7 С2Н5
5. Задача Густина алкену 2,5 г/л. Визначте його формулу, складіть
формули ізомерів, назвіть їх. (С4Н8)
4. ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф, виконати вправи
ТЕМА 2. ВУГЛЕВОДНІ
Заняття № 5
Дисципліна: «Хімія»
Тема заняття: Алкіни. Гомологічний ряд етину. Структурна ізомерія, номенклатура Мета заняття:
навчальна – розширити і поглибити знання студентів про будову
алкінів, їх ізомерію, ознайомити студентів з систематичною номенклатурою алкінів, сформувати вміння називати алкіни за систематичною номенклатурою та складати структурні формули за їх назвою, продовжувати розвивати навички написання структурних формул ізомерів;
розвиваюча – розвивати просторове мислення та уяву, вміння порівнювати, узагальнювати, робити висновки;
виховна – виховувати критичність мислення.
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: моделі молекул вуглеводнів, набір для складання кулестержневих моделей молекул Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ:
Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія,
2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с.
9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань Комбіноване опитування:
Студент біля дошки пояснює домашні вправи.
Письмові завдання
Скласти рівняння реакцій, які демонструють добування: 1. пропену;
2. бутену.
Усне опитування:
1. Чому алкени трапляються в природі набагато рідше ніж алкани?
2. Які речовини можуть бути сировиною для добування алкенів?
3. За допомогою яких реакцій можна отримати алкени?
Бесіда:
1. Що таке гомологічний ряд?
2. Чим характеризуються алкіни? Що відрізняє їх від алкенів?
3. Яка загальна формула алкінів?
4. Які особливості будови алкінів?
ІІІ Мотивація навчальної діяльності
Відомо, що бутен на відміну від бутану має більше ізомерів.
Як ви гадаєте, скільки ж ізомерів є у бутину – 2, 3, 4, а може ще більше?
Це ми сьогодні з’ясуємо на уроці.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Номенклатура алкенів
3. Закріплення вивченого матеріалу.
4.
Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Алкіни – ненасичені вуглеводні, у яких відкритий карбоновий ланцюг має один потрійний зв'язок.
Особливості будови алкінів: (демонстрація моделей молекул)
ü властива sp – гібридизація;
ü між двома атомами Карбону є потрійний зв'язок (σ - зв'язок, 2 π –
зв'язки);
ü кут між зв’язками 180º;
ü довжина зв’язку -С≡С- 0,120 нм, а енергія – 810 кДж.
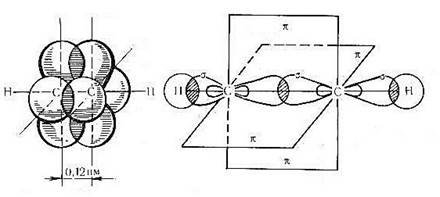
Схеми перекривання електронних орбіталей і утворення σ і π – зв'язків
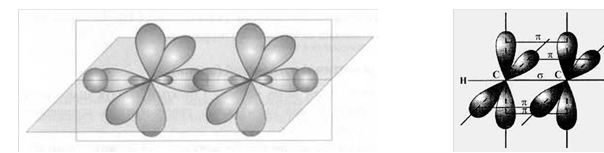
Загальна формула СnН2n-2
1. Чим відрізняються σ – зв'язок і π – зв'язок?
2. Чому кут у алкінів такої величини?
3. Як пов’язана гібридизація та просторова будова молекул?
4. Чому така загальна формула?
Найпростіший представник – етин:
С2Н2 - молекулярна формула;
СН≡СН - напівструктурна формула;
Н – С ≡ С – Н – структурна формула.
Кулестержнева і масштабна моделі молекули етину

Гомологічний ряд етину:
С2Н2 – СН≡СН – етин;
С3Н4 – СН≡С – СН3 – пропін;
С4Н6 – СН≡С – СН2 – СН3 – бутин;
С5Н8 – СН≡С – СН2 – СН2 – СН3 – пентин;
С6Н10 – СН≡С – СН2 – СН2 – СН2 – СН3– гексин;
С7Н12 – СН≡СН – СН2 – СН2– СН2 – СН2 – СН3 – гептин і т.д.
Ізомерія алкінів обумовлена наявністю потрійного зв’язку і буває кількох видів:
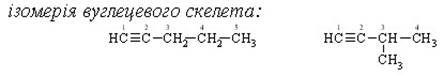
пент-1-ин 3-метилбут-1-ин
Гекс-1-ин гекс-2-ин 4-метилпент-2-ин
1. Зобразіть можливі ізомери бутину.
2. Де більше ізомерів: у алкенів чи алкінів?
3. Чи може бути в алкінів геометрична цис- транс-ізомерія?
Із збільшенням числа атомів Карбону кількість ізомерів зростає (в бутину 2), але дещо обмежена потрійним зв’язком.
Міжкласовими ізомерами для алкінів є алкадієни – вуглеводні з двома подвійними зв’язками.
С4Н6 СН2 = СН - СН = СН2 – бута –1,3-дієн
С5Н8 СН2 = СН – СН2 – СН = СН2 – пента-1,4-дієн
Якщо проаналізувати формулу, то видно, що загальна формула алкадієнів така ж як у алкінів СnН2n-2
2. НОМЕНКЛАТУРА АЛКІНІВ
Схема назви: префікси (замісники в алф. пор.) + корінь (головний ланцюг
алк-) + суфікс (-ін, -ин)
Порядок номенклатури:
1. Вибір найдовшого ланцюга (з потрійним зв’язком);
2. Його нумерація з кінця, де ближче потрійний зв’язок;
3. Визначення замісників та їх локанта в алфавітному порядку;
4. Назва головного ланцюга, визначення місця потрійного зв’язку +
суфікс –ін (-ин).
Приклад
1 2 3 4
СН3 ≡ С - СН – СН3 – бут-1-ин
1 2 3 4
СН3 – С ≡ С – СН3 – бут-2-ин
1 2 3 4
СН ≡ С - СН– СН3 – 3-метилбут-1-ин
|
СН3
![]() 1 2
3 4 5
1 2
3 4 5
СН3 – С≡С– СН – СН – СН3
| |6 7
СН3 СН2 – СН3
– 4,5-диметилгепт-2-ин 3,4-диметилпент-1-ин
3. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Завдання в парах:
1. Визначте представників ряду алкінів: С5Н10; С8Н14; С7Н14; С4Н6, С2Н4;
С6Н10; С18Н34.
2. Назвіть сполуки:
СН3 СН3
| |
А) СН3 – СН – СН– С≡ СН
Б) СН3 – С ≡ С – СН– СН – СН3 В)СН3 – СН – С ≡ С – СН – СН2 – СН3
| | | |
С2Н5 СН3 СН 3 С2Н5
3. Напишіть формулу алкіну за назвою:
ü гепт – 2-ин;
ü 3-метилпент – 1-ин;
ü 4,5-диметилгепт – 1-ин;
ü 3-етил-4,4-диметилгекс – 1-ин;
ü 4-бутил-3,3-диетил-5,5,6-триметилнон-1-ин.
4. Складіть формули ізомерів складу С7Н12, назвіть їх.
5. Задача. Вуглеводень масою 3,24 г згорів, утворивши 10,56 г вуглекислого газу. Визначте формулу вуглеводню, якщо відносна густина його пари за нітроген
(ІІ) оксидом 1,8. (С4Н6)
4. ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф, виконати вправи.
Задача. Вуглеводень кількістю речовини 0,3 моль спалили. Утворився вуглекислий газ масою 66 г і вода кількістю речовини 1,2 моль. Визначте молекулярну формулу сполуки та складіть напівструктурні формули її ізомерів.
(С5Н8)
ТЕМА 2. ВУГЛЕВОДНІ
Заняття № 6
Дисципліна: «Хімія»
Тема заняття: Бензен як представник ароматичних вуглеводнів. Його склад, будова молекули Мета заняття:
навчальна – ознайомити студентів з новим гомологічним рядом вуглеводнів – ароматичними сполуками, їх номенклатурою, сформувати поняття про бензольне ядро, встановити причинно-наслідкові зв’язки між будовою та властивостями бензену, продовжувати формувати вміння складати рівняння хімічних реакцій, в які вступають вуглеводні, а також розв’язувати розрахункові задачі за їх участю;
розвиваюча – розвивати вміння порівнювати, робити висновки, узагальнювати;
виховна – виховувати самостійність, наполегливість.
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: моделі молекул вуглеводнів
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань Бесіда:
1. Пригадайте загальну формулу алкенів.
2. У реакції якого типу вони вступають?
3. Порівняйте їхню активність з активністю алканів: хто більш реакційно здатний?
ІІІ Мотивація навчальної діяльності
У 1825 році Майкл Фарадей у світильному газі відкрив дивну речовину,
вона була безбарвна, летка, з характерним запахом, нерозчинна у воді, але розчинна в органічних розчинниках і дуже отруйна. Це був бензен (бензол).
Спробуйте передбачити її склад.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Ізомерія і номенклатура аренів.
3. Закріплення вивченого матеріалу.
4. Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Назва наступного класу вуглеводнів пов’язана з тим, що раніше ці сполуки добували з природних духмяних смол, проте для більшості з них запах не є характеристичною ознакою.
Складною проблемою виявилося встановлення будови бензену. Вчені припускали, що сполука складу С6Н6 має бути ненасиченою, легко приєднувати і взаємодіяти з бромною водою. Однак бензен в реакції приєднання практично не вступав, а от заміщення відбувалося.
Німецький вчений Кекуле у 1865 р запропонував формулу, яка частково пояснювала властивості бензену.
Арени (ароматичні вуглеводні) – вуглеводні, у молекулі яких міститься бензольне кільце.
Просторова будова бензольного кільця: (демонстрація)
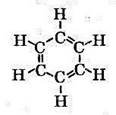
Кути між атомами Карбону 120º, а довжина зв’язку 0,14 нм (0,154 нм – довжина одинарного, 0,134 нм – подвійного).
![]() 2
2
В молекулі немає простих і подвійних зв’язків, всі зв’язки рівноцінні. Таким чином неможливо чітко встановити місце подвійного зв’язку і більш реально відображає будову бензену така формула.
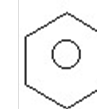
2. ІЗОМЕРІЯ І НОМЕНКЛАТУРА АРЕНІВ
Гомологи бензену відрізняються від нього наявністю замісників у бензольному ядрі.
Найближчим гомологом бензену є метилбензен (толуол).
Яка його молекулярна формула? (С7Н8 або С6Н5 -СН3)
Загальна формула аренів СnН2n-6
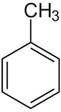
Поясніть, чим обумовлена така формула аренів?
Ізомерія аренів визначається: складом і будовою замісників; положенням замісників.
Наприклад, аренів зі складом С8Н10 може бути аж 4 :
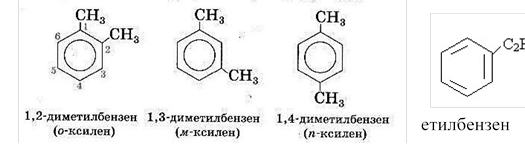
Для того, щоб назвати ароматичну сполуку потрібно:
1. Пронумерувати атоми Карбону бензольного кільця від більшого
замісника.
2. Вказати місце і назву замісників.
3. Додати закінчення бензин.
Залишок С6Н5 – називають фенільним.
3. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Робота в парах:
1. З переліку виберіть формули аренів: С5Н10; С8Н10; С7Н14; С4Н6, С7Н8;
С9Н12; С8Н14.
2. Назвіть сполуки (за напівструктурними формулами).
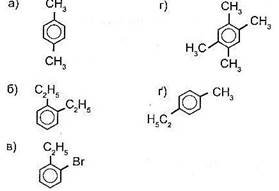
3. Складіть формули:
a. 1,4-діетилбензен;
b. 1-етил-2,3,4-триметилбензен;
c. 1,2-діетил-3-ізопропілбензен;
d. 1,3,5-тринітробензен.
Індивідуальні завдання
• Складіть формули ізомерів, що містять метильний замісник, атом Брому і бензольне кільце, назвіть їх.
• Масова частка Карбону у складі арену – 90,57%. Густина пари
речовини за карбон (IV) оксидом – 2,41. знайдіть молекулярну формулу сполуки, напишіть напівструктурну формулу (С8Н10).
4. ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф, виконати вправи.
Задача. Густина арену 5,36 г/л. Визначте його склад, складіть формули можливих ізомерів, назвіть їх. (С9Н12).
Підготувати повідомлення про вплив пестицидів на організм людини.
ТЕМА 3. ПРИРОДНІ ДЖЕРЕЛА ВУГЛЕВОДНІВ ТА ЇХ ПЕРЕРОБКА Заняття № 7
Дисципліна: «Хімія»
Тема заняття: Природний і супутній нафтовий гази, їх склад і використання Мета заняття:
навчальна – зясувати специфіку природного газу як вуглеводневої сировини, а саме його походження, добування, географічне поширення; вивчити склад, властивості, застосування природного і супутнього нафтових газів; продовжувати формувати вміння розв’язувати задачі екологічного і виробничого змісту;
розвиваюча – розвивати вміння логічно мислити, узагальнювати, порівнювати, розвязувати проблемні завдання;
виховна – виховувати самостійність мислення, екологічну культуру.
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: таблиці «Склад природного і супутнього нафтових газів», «Застосування природного і супутного нафтових газів», зразки природного газу, політична карта світу.
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с.
9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
55
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань Бесіда:
1. Пригадайте, які основні компоненти природного газу?
2. Назвіть відомі вам місця знаходження природного газу.
3. Яким чином він утворюється?
ІІІ Мотивація навчальної діяльності
Послухайте уривок з роману Луї Буссенара «Викрадачі діамантів»
«Намагаючись знайти вихід з вугільної шахти полонений завзято бив киркою по вугіллю, присвічуючи собі свічкою. Раптом кирка провалилася в пустоту, яка приховувалася за тонким вугільним пластом.
Почулося сильне шипіння, немов би звідкись виривалося повітря чи газ. Джеймсу здалося, що кіптяве жовте полум’я його свічки зненацька спалахнуло і забарвилося у дивний блакитний колір. Раптом сліпуча блискавка розірвала темряву, Джеймса оточило полум’я, він почув страшний вибух і відчув, що його з неймовірною силою підкинуло в повітря…».
Поясніть, що відбулося. Про яку речовину йшлося?
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
3. Домашнє завдання.
56
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Протягом тисячоліть людство використовували органічну сировину винятково природного походження. Проте ХХ і ХХІ століття поклали початок новій ері – ері синтетичних органічних речовин. Причиною цього є те, що природні джерела органічних речовин надзвичайно швидко вичерпуються у зв’язку із зростаючими потребами людства у енергії та сировині.
Природний газ
Природний газ міститься в надрах землі і в основному складається з метану, а також є незначні частки етану, пропану, бутану, азоту і вуглекислого газу. Чим вища молекулярна маса вуглеводню, тим менше його міститься в природному газі.
Природний газ зустрічається там, де залягає нафта, або утворює окремі газові родовища. У цих покладах газ перебуває під високим тиском. І якщо пробурити до газового шару свердловину, то він із силою рине на поверхню.
Ймовірно, що природний газ утворився внаслідок розпаду вуглеводнів нафти, завдяки діяльності бактерій.
Це цікаво:
Природні горючі гази, що виділяються з тріщин земної кори, були відомі людині давно. Подекуди ці гази займалися під час грози, тоді їх вважали священними вогнями.
Полум’я природного газу, що пробивається з-під землі, можна спостерігати в наш час на горі Янарташ у Греції.
На Близькому Сході, де тривають воєнні дії, є озеро, на дні якого під шаром мулу накопичилися великі запаси болотного газу.
Яку небезпеку воно становить для оточуючих?
Запаси природного газу знаходяться біля родовищ нафти: у західному Сибіру, Узбекистані, Туркменістані, а також на Україні біля Харкова було родовище Шабелинка, яке на сьогодні вичерпалося.
Для добування газу бурять свердловини до газоносних пластів, а газ передається по газопроводах на великі відстані.
Щороку його видобувають 20 млрд м3, що становить 1/5 від загальної потреби.
(Демонстрація природного газу)
Які властивості метану дозволяють спостерігати його у вигляді бульбашок на поверхні заболочених водойм?
Ви чули, що нафта з родовищ спершу бє фонтаном, а чому? Виявляється у неї є супутник, який її виштовхує. Що це за таємничий супутник?
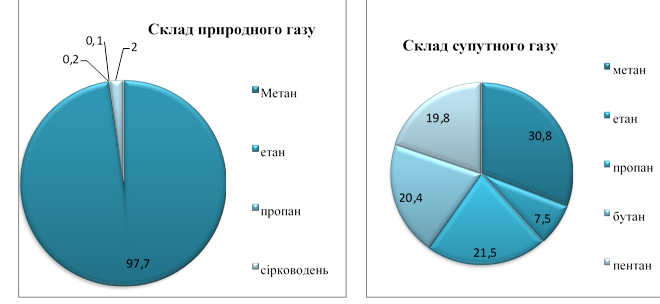
Супутні нафтові гази за своїм походженням теж природні. Окрему назву ці гази дістали тому, що вони є в покладах разом з нафтою – розчинені у ній або містяться над нею, утворюючи газову «шапку». Під тиском цих газів нафта піднімається на поверхню землі по свердловині.
Супутній газ відрізняється за складом від природного: містить менше метану і більше його гомологів (етану, пропану, бутану).
Основне використання природного газу – паливо, яке має ряд переваг:
1) газ легко змішується з повітрям і повність згоряє, не утворюючи
сажі;
2) при згоранні не утворюється шлак;
3) відсутність диму;
4) легко транспортується на великі відстані найдешевшим транспортом – газопроводом.
Природний газ використовують не тільки в котельних установках, а й у промислових печах – скловарних, доменних, у побуті.
Природний газ – джерело сировини для хімічної промисловості, тому що з нього добувають водень, ацетилен, сажу, хлорпохідні
Раніше супутний газ не знаходив застосування. Під час добування нафти його просто спалювали, як відходи. Тепер його вловлюють і, попередньо розділивши, використовують.
Спершу виділяють суміш пентану, гексану та інших рідких вуглеводнів, яку називають газовий бензин. Його додають до звичайного бензину, щоб пришвидшити запалювання.
Потім відокремлюють суміш пропану з бутаном, якою у вигляді зрідженого газу наповнюють балони, ними користуються в побуті.
Залишається так званий сухий газ, що складається з метану і етану. Його використовують як природний газ
Відомо, що пропан і бутан запаху не мають. Чому ж скраплений газ, який в основному складається з них, має такий неприємний запах?
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Робота в групах
Завдання 1. «Знайди помилку»
1. Супутній нафтовий газ в основному складається з метану.
2. В Україні знаходяться значні поклади супутнього газу.
3. Природний газ утворюється в результаті розпаду органічних сполук
за участю бактерій.
4. При спалюванні 1 м3 природного газу виділяється більше тепла, ніж
при спалюванні 1 м3 супутнього газу, але менше ніж при спалюванні вугілля.
5. Природній газ менш економічно і екологічно вигідний ніж вугілля.
6. Болотний і рудниковий газ в основному складаються з метану.
7. Природний газ має різкий специфічний запах
Завдання 2. «Склади рівняння».
Складіть рівняння реакцій добування з метану:
1. Водню;
2. Хлороформу;
3. Сажі;
4. Хлороводню;
5. Етину.
Завдання 3. Проблемне питання:
За підрахунками вчених запасів природного газу залишилося на 30-40 років, що на вашу думку зможе його в майбутньому замінити?
Завдання 4. Задача «Газ у вашому домі»
В середньому за рік мешканці одного будинку спалюють 2400 м3 природного газу, в якому вміст метану 97%. Обчисліть:
1) об’єм кисню і повітря необхідний для цього;
2) об’єм вуглекислого газу, що утвориться. (2328 м3, 11640 м3, 4656 м3)
Завдання 5. Задача «На заводі»
Обчисліть об’єм етину, що можна отримати з 50 л супутнього нафтового газу (вміст метану 30,8%), якщо вихід продукту реакції 90% від теоретично можливого? (693л)
3. ПІДВЕДЕННЯ ПІДСУМКІВ ЗАНЯТТЯ І ПОВІДОМЛЕННЯ
ДОМАШНЬОГО ЗАВДАННЯ
Вивчити параграф, виконати вправи.
Задача. Об’ємна частка етану в супутньому газі 20%. Який об’єм етену можна добути з етану, що міститься в 2240 м3 супутнього газу? (448 м3)
ТЕМА 3. ПРИРОДНІ ДЖЕРЕЛА ВУГЛЕВОДНІВ ТА ЇХ ПЕРЕРОБКА Заняття № 8
Дисципліна: «Хімія»
Тема заняття: Нафта. Склад, властивості нафти. Основні процеси
переробки нафти. Застосування нафтопродуктів.
Детонаційна стійкість бензину Мета заняття:
навчальна – розширити і поглибити знання студентів про органічні сполуки природного походження, з’ясувати склад і властивості нафти, ознайомити студентів з головними процесами переробки нафти, показати значення
нафтопродуктів для життя людини;
розвиваюча – розвивати вміння порівнювати, робити висновки, аналізувати;
виховна – виховувати самостійність мислення, екологічну культуру.
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: модель апаратів нафтопереробки, таблиця
«Перегонка нафти», зразки нафтопродуктів
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань Усне опитування:
1. Порівняйте склад природного та супутнього нафтових газів. Чим
обумовлена відмінність у ньому?
2. Яке походження природного газу і де містяться його поклади?
3. Які переваги природного газу порівняно з іншими видам палива?
4. Які основні галузі застосування природного та супутнього нафтових
газів?
ІІІ Мотивація навчальної діяльності
У США був організований конкурс на найкоротше оповідання. Першу премію було присуджено авторові такого твору: «Джек запалив сірник і хотів поглянути – скільки бензину залишилося в баці...Небіжчику було 22 роки».
Що сталося з Джеком?
Раніше бензин, який став причиною трагедії, був побічним продуктом при добуванні гасу. Як же його навчилися добувати? Це ми сьогодні з’ясуємо.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
3. Домашнє завдання
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Нафта була відома ще в античні часи 5 тис. років тому і використовувалася в основному для освітлення, а також як паливо.
У ХVIII ст. була удосконалена масляна лампа, у ній замість масла почали використовувати гас, який добували з нафти. Гас також застосовували як розчинник і навіть у медицині. Саме гас до 1900 р вважався найціннішим продуктом переробки нафти.
З появою двигунів внутрішнього згорання і автомобілів важливого значення набули інші складові нафти, зокрема бензин, який до цього часу вважали відходом.
У 1920 р розвиток авіації ще збільшив потребу у нафті і бензині. Якщо порівняти, то у 1900р добули 20 млн т нафти, а через 30 р – 190 млн т.
Менделєєв понад 120 р тому вказував на недоцільність використання нафти як палива: ―Палити дешевше облігаціями‖ – писав він. І справді, сьогодні запаси нафти вичерпуються. За останніми прогнозами, їх вистачить років на 100.
Відносно походження нафти є різні версії.
Органічна теорія Ломоносова стверджує, що нафта утворилася із залишків рослин і тварин, які накопичувалися на дні мілководних морів у минулі геологічні епохи. Під впливом діяльності бактерій при підвищеному тискові і температурі відбувалося перетворення білків, жирів і вуглеводів на вуглеводні. Цю теорію доводить те, що у нафті виявлено продукти перетворення хлорофілу рослин і гемоглобіну тварин.
Неорганічна теорія Менделєєва доводить, що нафта могла утворитися з карбідів металів, які знаходяться в надрах землі, і води, що потрапляла туди.
Космічна теорія переконує, що нафта могла утворитися з водню і вуглецю при формуванні нашої планети в умовах високої температури і тиску.
Основні родовища нафти розташовані у Західному Сибіру, Північному Кавказі, Уралі, в Ірані, Румунії, Південній Америці, США.
Відносно невеликі запаси нафти є і в Україні: у Львівській, Сумській, Чернігівській, Полтавській, Івано-Франківській областях.
Найвідомішими нафтовими центрами в Україні були: Дрогобич (з ХІХ ст добували нафту), Борислав (найстаріший центр нафтової промисловості Передкарпаття), Долина (займала перше місце в Україні по добуванню нафти).
На сьогодні більшість запасів нафти у нашому регіоні вичерпано. Щорічно видобуток нафти становить 3 млн т, що становить лише 10% від потреби.
За складом нафта є сумішшю насичених і ароматичних вуглеводнів, найбільше в ній рідких вуглеводнів, однак містяться розчинені гази і тверді вуглеводні, оксигено-, нітрогено-, сульфоровмісні органічні речовини.
Нафта – темна, оліїста рідина з запахом, легша за воду і нерозчинна в ній, немає певної температури кипіння. Чому?
Нафта в окремих родовищах може відрізнятися за складом, тобто вмістом різних типів вуглеводнів. Вона буває:
1. Парафінова – США; 2. Нафтенова – Баку;
3. Ароматична – Урал.
У давні часи нафта траплялася просто на поверхні ґрунту, її можна було легко зібрати. Тепер нафта міститься у порожнинах гірських порід здебільшого глибоко під землею. Для добування нафти бурять свердловини діаметром 15-25 см і глибиною до 5 тис м до нафтоносного пласту. Потім у свердловини опускають сталеві труби, по яких нафта піднімається спершу фонтаном під великим тиском, а потім її витягують насосами.
Переробка нафти спрямована на добування бензину та інших видів пального. Найбільші нафтопереробні підприємства знаходяться в Кременчуку, Лисичанську, Херсоні, Дрогобичі, вони виробляють 50 видів нафтопродуктів.
Переробка нафти може бути:
ü первинна – полягає у розділення нафти на окремі фракції (суміші з близькими температурами кипіння);
ü вторинна – хімічні реакції, під час яких змінюється склад речовин.
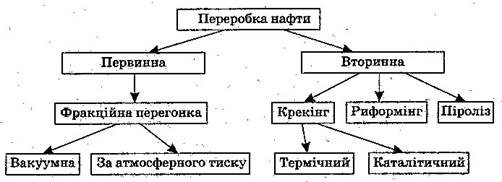
Основним процесом первинної переробки нафти є перегонка в ректифікаційних колонах тарілчастої конструкції. (демонстрація ректифікаційної колони і аналіз таблиці)
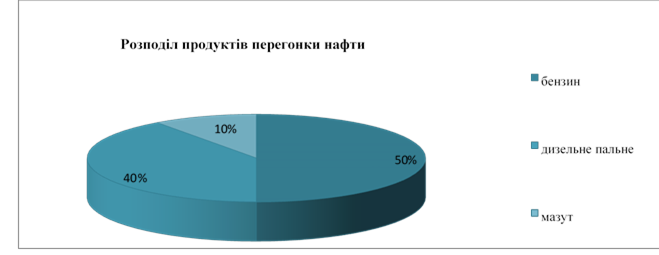
Продукти первинної перегонки та їх використання
|
Фракції |
Кількість атомів карбону в молекулі |
Інтервал температур кипіння, °С |
Галузі застосування |
|
Газова |
С1 – С4 |
40 |
Паливо (опалення газові плитки) |
|
Бензин |
С5 – С10 |
40-180 |
Паливо (літаки, автомобілі та ін.). Розчинники. Сировина для одержання штучних вуглеводнів |
|
Лігроїн |
С8 – С14 |
150-250 |
Дизельне паливо. Розчинники. Стровина для одержання бензину. |
|
Гас |
С11 – С12 |
180-230 |
Паливо для реактивних і тракторних двигунів. Розчинники. |
|
Легкий газойль |
С13 – С17 |
230-305 |
Паливо для дизельних двигунів, масла |
|
Важкий газойль |
С15 – С25 |
305-400 |
|
|
Мазут (залишок перегонки) |
Суміш вищих вуглеводнів |
Понад 350 |
Паливо для парових казанів, сировина для виробництва мастильних матеріалів. Парафін. Вазелін. Гудрон |
Мазут теж переганяють, добуваючи:
• вазелін (медицина);
• парафін (олівці, сірники, свічки);
• мастила (веретенне, машинне, циліндрове);
• гудрон (асфальт).
Основним продуктом переробки нафти є бензин. Його якість визначають стійкістю до детонації (швидкого, вибухового згоряння). Чим більше в бензині розгалужених алканів і аренів, тим він стійкіший до детонації. Детонаційна стійкість характеризується октановим числом (ОЧ), тобто вмістом ізооктану, який важко детонує.
Проте перегонкою можна добути бензин з ОЧ – 40-55. Тому здійснюють вторинну переробку нафти.
Крекінг – термічний розклад важких вуглеводнів на більш легкі.
Термічний крекінг здійснюється при 450-550º і тиску в кілька атмосфер.
С16Н18 = С8Н18 + С8Н16
Такий бензин має ОЧ 65-70, але містить ненасичені вуглеводні, що погіршує його якість. Чому?
Каталітичний крекінг здійснюється при нижчій температурі (до 450º) і тиску в присутності каталізаторів – алюмосилікатів. Бензин, добутий таким чином має ОЧ 75-80 і високу якість.
Риформінг – ароматизація бензину – збільшення вмісту ароматичних вуглеводнів, що веде до підвищення ОЧ.
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Бесіда:
ü Чим відрізняється крекінг від фракційної перегонки нафти?
ü Які способи підвищення октанового числа?
ü Уявіть, вам на святковий одяг потрапила нафта і утворилася пляма.
Чим ви її будете чистити?
Робота в парах:
1. Проаналізуйте застосування нафтопродуктів за малюнком (додаток 1)
2. Яку масу октану можна добути при крекінгу 22,6 кг гексадекану, якщо
вихід продуктів реакції 90%? (10,26 кг)
3. Бак автомобіля заповнений бензином, що містить 80% октану, а решта
гептан. Який об’єм кисню потрібний для спалювання 20 кг бензину? (49 м3)
3. ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф, виконати
вправи.
Додаток 1.
Малюнок 1. Інтер’єр з предметами, виготовленими з нафтопродуктів (а) і без них (б).
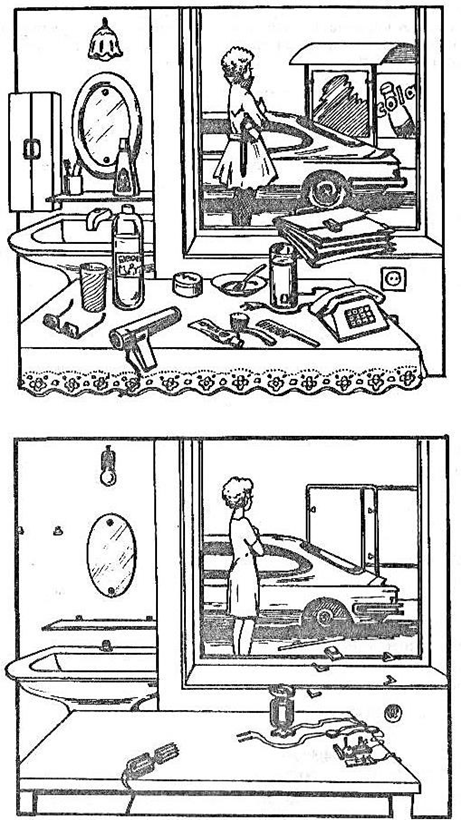
ТЕМА 3. ПРИРОДНІ ДЖЕРЕЛА ВУГЛЕВОДНІВ ТА ЇХ ПЕРЕРОБКА Заняття № 9
Дисципліна: «Хімія»
Тема заняття: Кам’яне вугілля, продукти коксування кам’яного вугілля, їх застосування.
Мета заняття:
навчальна – зясувати роль кам’яного вугілля як вуглеводневої сировини, ознайомити студентів з головними принципами коксування кам’яного вугілля, показати різноманітність застосування продуктів коксування, продовжувати
формувати вміння розв’язувати задачі виробничого змісту;
розвиваюча – розвивати вміння логічно мислити, узагальнювати, порівнювати, вирішувати проблемні завдання;
виховна – виховувати самостійність мислення, екологічну культуру.
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: колекція «Види палива», «Продукти переробки кам’яного вугілля»
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с.
9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань Фронтальна бесіда:
1. Який хімічний склад нафти?
2. Які теорії походження нафти вам відомі?
3. В чому полягає переробка нафти? Що таке фракція?
4. Чим відрізняється первинна переробка від вторинної?
5. Назвіть основні нафтопродукти та їх застосування.
ІІІ Мотивація навчальної діяльності
На сьогодні частина шкіл газифіковані, а деякі опалюються вугіллям. В перспективі в деяких навчальних закладах пропонується використовувати альтернативне паливо (солом’яні, тирсові брикети).
На вашу думку, який вид палива має більше переваг?
На яке паливо доцільніше було б перейти?
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
3. Підведення підсумків заняття і повідомлення домашнього завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Вугілля – тверда горюча корисна копалина органічного походження.
Одну з версій походження вугілля висловив Ломоносов. Він стверджував, що вугілля утворюється із залишків наземних рослин.
Цей процес складається з кількох етапів:
1. Спершу у болотах під водою із залишків рослин утворюється торф,
який нещільний, із помітними стеблами рослин (вік його – 100-1000 років);
2. Потім в надрах землі під впливом високої температури і тиску торф
спікається, утворюючи буре вугілля;
3. При подальшій дії температури і тиску буре вугілля перетворюється у
кам’яне;
4. Закінчується процес формуванням антрациту – найтвердішого і
найдревнішого вугілля.
Схема цього процесу наступна:
Торф буре вугілля (W(C)=70%) кам’яне вугілля (W(C)=80%) антрацит (W(C)=97%)
В ході цього процесу вміст Оксигену і Гідрогену у вугіллі зменшується, а Карбону – зростає.
У світі великі запаси вугілля містяться у Росії та Казахстані.
В Україні центром вугільної промисловості є Донецький вугільний басейн, який включає Донецьку, Дніпропетровську і Луганську області. Запаси вугілля у ньому становлять 241 млрд т.
При неглибокому заляганні вугілля добувають відкритим способом екскаваторами, а при заляганні на глибині – шахтним способом за допомогою вугільних комбайнів. У цьому випадку часто трапляються зриви шахт, що створює велику загрозу для життя робітників.
На сьогодні вважають, що запасів вугілля вистачить років на 200, але при цьому людство може використати лише чверть його запасів.
Переробка вугілля – суха перегонка, полягає в його хімічному розкладанні без доступу повітря. Буває двох видів: напівкоксування - (500-550º) і коксування (900-1000º). Останнім часом набули поширення методи добування газоподібних і рідких вуглеводнів з вугілля з допомогою водяної пари, вуглекислого газу
(газифікація, гідрування).
Схема переробки кам’яного вугілля
Коксування – (суха Газифікація – перегонка) розклад при перетворення на горючі
відсутності повітря (t=1000º) кисню, вуглекислогогази (дією водяної пари, газу)
Кокс - (98% С) – відновник чавуну, Чадний газ
паливо, 2С + О2 = 2CO
Коксовий газ – (H2, CH4, CO, NH3, Водень
![]() C 6H6) – паливо, виробництво добрив С + Н2О=СО + Кам’яновугільна смола – (500 речовин Н2 - бензен, толуол, фенол, нафталін, пек)- Метан
добування аренів, виготовлення толю, С + 2Н2 = СН4
асфальту, лаків.
C 6H6) – паливо, виробництво добрив С + Н2О=СО + Кам’яновугільна смола – (500 речовин Н2 - бензен, толуол, фенол, нафталін, пек)- Метан
добування аренів, виготовлення толю, С + 2Н2 = СН4
асфальту, лаків.
Надсмольна вода – (амоніак, сірководень, хлороводень) – мінеральні
добрива, кислоти
Гідрування – перетворення на
горючі вуглеводні (t=500º, p, k)
Синтетичне рідке пальне:
nС + (n+1)Н2 =
СnН2n+2
8С + 9Н2 = С8Н18
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Бесіда:
1. Чим відрізняється буре вугілля від антрациту?
2. Що економічно вигідніше, на вашу думку, спалювати вугілля як паливо
чи переробляти на інші види сировини? Чому?
Задача. Добування вугілля із 4000 шахт у різних країнах світу супроводжується викидами в атмосферу 27 млрд. кубометрів метану й 17 млрд. кубометрів вуглекислого газу. При згоранні 1 моль метану виділяється 880 кДж енергії. Обчисліть теплоту, що виділилась би при згоранні шахтних викидів метану. (1056*1012 кДж)
3. ПІДВЕДЕННЯ ПІДСУМКІВ ЗАНЯТТЯ І ПОВІДОМЛЕННЯ
ДОМАШНЬОГО ЗАВДАННЯ
Вивчити параграф, виконати вправи
Підготувати повідомлення на тему «Екологічні наслідки застосування та переробки:
ü вугілля;
ü природного газу;
ü нафти і нафтопродуктів.
ТЕМА 3. ПРИРОДНІ ДЖЕРЕЛА ВУГЛЕВОДНІВ ТА ЇХ ПЕРЕРОБКА Заняття № 10
Дисципліна: «Хімія»
Тема заняття: Охорона довкілля від забруднень при переробці вуглеводневої сировини та використанні продуктів переробки Мета заняття:
навчальна – ознайомити студентів з проблемами забруднення навколишнього середовища продуктами переробки газу, нафти, вугілля, продовжувати формувати вміння розв’язувати задачі екологічного і виробничого змісту;
розвиваюча – розвивати вміння логічно мислити, узагальнювати, порівнювати, вирішувати проблемні завдання;
виховна – виховувати самостійність мислення, екологічну культуру.
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія» Дидактичне забезпечення: колекція «Види палива», «Продукти переробки кам’яного вугілля», «Нафта та продукти її переробки»
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань Фронтальна бесіда:
1. Який хімічний склад нафти?
2. Які теорії походження нафти вам відомі?
3. В чому полягає переробка нафти? Що таке фракція?
4. Чим відрізняється первинна переробка від вторинної?
5. Назвіть основні нафтопродукти та їх застосування.
ІІІ Мотивація навчальної діяльності Чи відомо вам, що:
• у світі щорічно спалюється 2,5 млрд т нафтопродуктів і понад 20 млрд т кам’яного вугілля;
• за останні 50 років було використано стільки кисню, скільки за всю попередню історію людства.
Якими можуть бути наслідки цього для планети?
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
4. Підведення підсумків заняття і повідомлення домашнього завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Величезну кількість енергії, яка її необхідна, людина черпає із земних надр у вигляді вугілля, нафти, газу, проте разом з енергією отримає ряд продуктів, які ставлять під загрозу існування живої частини планети і людства в тому числі.
У результаті спалювання органічного палива лише на теплових електростанціях (ТЕС), не рахуючи роботу автомобільних двигунів і металургійних підприємств, в атмосферу планети щорічно надходить понад 5 млрд т вуглекислого газу (25% техногенних викидів діоксиду вуглецю в атмосферу дають США і країни Євросоюзу, 11% – Китай, 9% – Росія).
При добуванні і перевезенні нафти часто трапляються її виливи у навколишнє середовище. Потрапляння нафти у ґрунт є згубним для рослин, які там зростають.
Витік нафти у водойму спричиняє появу на поверхні води плівки, що припиняє доступ кисню до води. А краплини нафти отруюють рибу й інших водних тварин. Наприклад, концентрація нафти 0,5 мг/л води спричиняє появу у риби запаху нафти, а вищі дози викликають загибель.
Відомо, що при виливанні 1т нафти у водойму, вона утворює плівку
2 площею 12 км , а ще при цьому непридатною для пиття, використання,
життя водних тварин стає вода обємом 1 км3.
Часто для покращення якості бензину додають антидетонатор – тетраетилсвинець (ТЕС), який спричиняє викиди свинцю в навколишнє середовище.
Це безбарвна надзвичайно отруйна речовина. Під час Другої світової війни вояки одного з підрозділів вермахту знайшли металеву діжку без напису з густою оліїстою рідтною. Вони помилково прийняли її за оліфу і «пофарбували» нею деревяні стіни і стелі в казармі. Того ж дня розмістилися у цьому приміщенні. До ранку 21 солдат загинув у страшних муках, а решта дістали психічні розлади.
«Оліфа» виявилася тетраетилсвинцем.
Яка формула сполуки? Обчисліть масову частку Плюмбуму у ній.
З однієї коксової печі при переробці вугілля в атмосферу надходить:
1) 3-5 кг вугільного пилу;
2) 2,2 кг чадного газу;
3) 1,6 кг кам’яновугільної смоли;
4) 0,57 кг вуглеводнів.
Повідомлення струдентів:
Екологічні наслідки застосування та переробки:
1) вугілля;
2) природного газу;
3) нафти і нафтопродуктів.
(Студенти самостійно заповнюють порівняльну таблицю)
Вплив різних видів вуглеводневої сировини на довкілля та способи його зменшення
|
|
Шкідливі речовини, що утворюються при переробці |
Їх вплив на довкілля |
Способи зменшення негативного впливу |
|
Природний газ |
карбон (ІV) оксид, чадний газ, сірководень Н2S, залишки метану |
посилення парникового ефекту, виникнення кислотних дощів |
вловлення шкідливих газів фільтрами |
|
Нафта |
вуглекислий та чадний газ, оксиди Сульфуру, нерозчинні у воді вуглеводні |
нафтова плівка на водоймах, загибель тварин, забруднення грунтів, парниковий ефект |
використання сорбентів, які вбирають нафту при розливі, використання каталізаторів, що доокиснюють продукти згорання палива |
|
Вугілля |
вугільний пил, сажа, чадний газ, отруйні сполуки Нітрогену, Сульфуру, парникові гази. |
парниковий ефект, кислотні дощі, утворення териконів, забруднення грунтів та водойм |
вловлення шкідливих газів фільтрами (сірководень, амоніак), очищення стічних вод (від фенолу), повторне використання відходів |
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Завдання 1.
Розташуйте різні види вуглеводневої сировини в порядку зростання негативного впливу на стан довкілля, обгрунтуйте свою думку.
Задача 1. Обчисліть, яка площа води буде покрито плівкою нафти і який об’єм її стане непридатним для використання, якщо у Чорному морі з танкера потрапить у воду 24 т нафти. Масова частка неорганічних домішок у ній – 20 %.
(230,4 км2, 19,2 км3).
Задача 2. Яка маса свинцю потрапить в атмосферу під час проїзду від Львова до Тернополя (135 км), якщо 1 л бензину вистачає на 15 км, а вміст ТЕС в 1 л бензину 0,8 г? (4,6 г).
3. ПІДВЕДЕННЯ ПІДСУМКІВ ЗАНЯТТЯ І ПОВІДОМЛЕННЯ
ДОМАШНЬОГО ЗАВДАННЯ
Вивчити параграф, виконати вправи
ТЕМА 4. ОКСИГЕНОВМІСНІ СПОЛУКИ
Заняття № 11
Дисципліна: «Хімія»
Тема заняття: Спирти. Насичені одноатомні спирти. Ізомерія, номенклатура насичених одноатомних спиртів Мета заняття:
навчальна – сформувати у студентів уявлення про різноманітність оксигеновмісних органічних сполук, розширити поняття «функціональна група» на прикладі функціональної групи спиртів, сформувати знання студентів про гомологічний ряд спиртів, ознайомити з їх номенклатурою та ізомерією; сформувати вміння називати спирти за систематичною номенклатурою та складати структурні формули за їх назвою;
розвиваюча – розвивати логічне мислення, просторову уяву; виховна – виховувати наполегливість.
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: таблиця «Типи хімічного зв’язку», набір для складання кулестержневих моделей молекул.
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань Усне опитування:
1. Порівняйте хімічний склад вугілля різних видів.
2. В чому переваги і недоліки вугілля як вуглеводневої сировини?
3. Які методи хімічної переробки вугілля вам відомі?
4. На основі яких процесів: фізичних чи хімічних ці методи ґрунтуються?
ІІІ Мотивація навчальної діяльності
У вас на столі три предмети: спиртівка, розчин йоду, парфуми. Що спільного у них? (розчинник – спирт).
Яке значення має дана речовина у кожному випадку? На яких властивостях ґрунтується її використання?
На ці та багато інших питань ми знайдемо відповідь протягом заняття.
ІV Сприйняття й засвоєння нових знань:
План
3. Вивчення нового матеріалу.
4. Закріплення вивченого матеріалу.
5. Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Розгляньте схему в підручнику «Оксигеновмісні речовини» і пригадайте, які з них ми вивчали у 9 класі.
Чим вони відрізнялися?
Така їх послідовність не випадкова: ці речовини саме в такому порядку можуть перетворюватися одні в одних. Першою ж ланкою є спирти.
Склад спиртів було з’ясовано значно раніше, ніж виведено структурну формулу: С2Н6О, але цій молекулярній формулі відповідає дві структурних:
СН3-О-СН3 і СН3-СН2-ОН.
Проведені експерименти довели, що у хімічних реакціях бере участь лише один атом Гідрогену, відповідно він не є рівноцінним, тому саме друга формула є вірною.
Спирти – органічні речовини, молекули яких складаються з вуглеводневого залишку та однієї чи кількох гідроксильних груп – ОН
В залежності від кількості гідроксильних груп спирти бувають:
• одноатомні (R-ОН);
• багатоатомні (R-(ОН)2, R-(ОН)3).
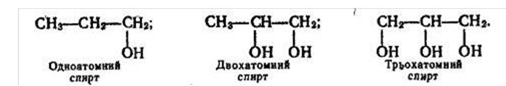
За типом хімічних зв’язків:
• насичені; ненасичені;
• ароматичні.
Загальна формула насичених одноатомних спиртів:
СnН2n+1ОН або R-ОН
вуглеводневий залишок гідроксильна група
Будова функціональної групи
δ- δ+
СН3-СН2 →О←Н зв'язок поляризується, стає більш слабкий, тому атом
Гідрогену гідроксильної групи легко відривається.
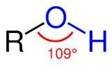
На вашу думку, спирти активніші, ніж алкани чи менш активні?
За номенклатурою ІЮПАК спирти називають алканоли або алкоголі.
Гомологічний ряд спиртів:
• СН3ОН – метанол;
• С2Н5ОН – етанол;
• С3Н7ОН – пропанол і т. д.
Ізомерія спиртів обумовлена:
1) будовою карбонового скелету СН3–СН2–СН2–СН2– ОН (бутан-1-ол)
СН3
|
чи СН3–СН– СН2– ОН (2-метилпропан-1-ол);
2) місцем гідроксильної групи СН2–СН2–СН2–ОН СН3–СН(ОН)–СН3
пропан-1-ол пропан-2-ол
Спрогнозуйте, яка буде кількість ізомерів у спиртів порівняно з алканами: більша чи менша?
У бутану – 2 ізомери, у бутанолу аж 4. Чому?
Назви їх складають як у алканів з уточненнями:
1) нумерацію починають з кінця, до якого ближча група – ОН;
2) називаючи головний ланцюг, вказують місце групи – ОН;
3) додають закінчення – ол.
Назвіть спирт
![]()
2,3-диметилбутан-1-ол
В залежності від того, з скількома вуглеводневими залишками сполучений атом Карбону, що містить гідроксильну групу, спирти поділяють на:
Ø первинні;
Ø вторинні;
Ø третинні.
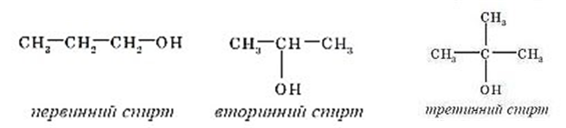
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
1. Назвіть спирти і прокласифікуйте їх:
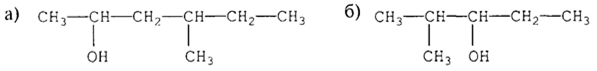
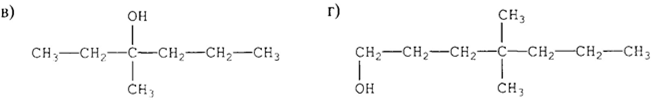
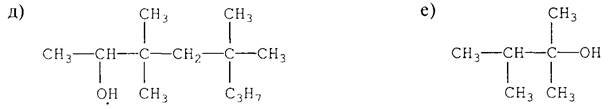
1) СН3 – СН – СН – СН2 – СН – СН3
| | |
ОН С2Н5 СН3
2) СН3 – СН – СН – СН2 –СН2
| | |
СН3 СН3 ОН
3) СН3 –– СН – СН(ОН) – СН – СН - СН2 – СН3
| | |
СН3 – СН2 С3Н7 С2Н5
2. Напишіть напівструктурні формули спиртів за назвами:
ü 2-метилбутан-1-ол; ü 3,3-диетилпентан-2-ол;
ü 2,3,4-триметилгексан -3-ол.
3. Виведіть формулу насиченого одноатомного спирту, в якому масова частка Оксигену 15,7% (С6Н13ОН)
3. ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф. Виконати вправи.
Задача. Яка сполука має відносну густину пари за повітрям 1,1 і масові частки Карбону, Оксигену і Гідрогену відповідно 37,5%, 50%, 12,5%? (СН3ОН) ТЕМА 4. ОКСИГЕНОВМІСНІ СПОЛУКИ
Заняття № 12
Дисципліна: «Хімія»
Тема заняття: Фенол, його склад, будова, властивості. Взаємний вплив
атомів у молекулі фенолу. Охорона довкілля від
промислових відходів, що містять фенол Мета заняття:
навчальна – розглянути склад, будову, властивості фенолу, пояснити взаємний вплив атомів на прикладі фенолу, розширити знання студентів про номенклатуру органічних сполук, дати уявлення про охорону навколишнього середовища від
відходів, що містять фенол;
розвиваюча – розвивати вміння порівнювати, узагальнювати; виховна – виховувати відповідальне ставлення свого здоров’я, бережливе ставлення до природи.
Тип заняття: вивчення новго матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: модель молекули фенолу.
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань
Письмове опитування за різними варіантами (додаток 1.) Усне опитування:
1. Порівняйте одноатомні та багатоатомні спирти: що подібного та
відмінного у будові та властивостях?
2. Яким чином експериментально розрізнити воду, етанол, гліцерин?
3. Які властивості: кислотні чи основні, виявляють спирти?
ІІІ Мотивація навчальної діяльності
Речовина, про яку ми сьогодні поговоримо, може бути і другом, лікуючи та будучи сировиною для пластмас, фарб, і водночас страшним ворогом, отруюючи все живе. Що ж це?
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
3. Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Феноли – органічні речовини, в молекулах яких гідроксильні групи сполучені з бензольним кільцем.
Як і спирти, феноли залежно від кількості гідроксогруп бувають:
1. одноатомні;
2. двоатомні;
3. багатоатомні.
Одноатомний фенол або гідроксибензол:
ü С6Н5ОН – молекулярна формула;
ü ![]() напівструктурна
формула.
напівструктурна
формула.
В молекулі фенолу відбувається втягування електрону Оксигену у спільну π-електронну хмару бензенового кільця, за рахунок чого зв'язок С-О стає міцніший. Водночас атом Оксигену, компенсуючи цю втрату електрона, сильніше притягує до себе електронну пару від Гідрогену, тому зв'язок О-Н стає більш полярним і може розриватися. Цим можна пояснити прояв слабких кислотних властивостей, через які розчин фенолу ще називають карболовою кислотою.
Гідроксильна група, в свою чергу, змінює бензенове кільце, підвищуючи його електронну густину в орто- і пара-положеннях, де легше відбуваються реакції заміщення.

Фізичні властивості фенолу:
спрогнозуйте самі:
• агрегатний стан;
• розчинність у воді;
• температури плавлення і кипіння (+41º і +182º).
Фенол дуже отруйний
Спричиняє опіки шкіри, органів дихання, ураження травного тракту, нервової системи, особливо чутливі печінка та нирки.
Як ви гадаєте, яким чином вплине будова фенолу на його властивості?
З ким фенол виявлятиме подібність у хімічних властивостях?
Хімічні властивості фенолу
|
Реакції за участю гідроксогрупи |
Реакції бензольного кільця |
|
1. Взаємодія з металами С6Н5ОН + Na = С6Н5ОNa + H2 – натрій фенолят 2. Взаємодія з лугами С6Н5ОН + NaОН = С6Н5ОNa + H2О 3. Якісна реакція 3С6Н5ОН + FeCl3 = (С6Н5О)3Fe + 3HCl фіолетовий ферум (ІІІ) фенолят |
1. Взаємодія з бромною водою (якісна реакція)
(С6Н5ОН + 3Br2 =С6Н2Br3ОН↓ + 3HBr) (білий осад) |
|
|
2. Нітрування:
С6Н5ОН+3НО-NO2=С6Н2(NO2)3ОН↓+ 3H2O) – 2,4,6 – тринітрофенол – пікринова кислота, вибухонебезпечна |
Добування фенолу:
1 етап: хлорування бензену ( FeCl3)
С6Н6 + Cl2 = С6Н5Cl + HCl;
2 етап: реакція з концентрованим розчином лугу при тиску і нагріванні С6Н5Cl + NaОН(конц) = С6Н5ОН + NaCl.
Застосування фенолу:
1) виробництво пластмас;
2) лікарських засобів (дезинфікатори – 5% – розчин – карболова кислота);
3) синтетичних волокон;
4) барвників;
5) вибухових речовин.
Широке використання фенолу призводить до його викидів у довкілля, а отже до отруєння тваринного і рослинного світу.
Заходи щодо зменшення впливу фенолу на довкілля:
Ø біохімічний метод – процес розкладу за участю мікроорганізмів
Ø адсорбційний метод – використовується активоване вугілля
Ø нейтралізація лугами
Ø окиснення в нешкідливі речовини
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Фронтальна бесіда:
• Які відмінності у властивостях фенолу і спиртів, фенолу і бензену?
• Поясніть взаємозв’язок будови та властивостей фенолу. Чому його назва карболова кислота?
• Яким чином відрізнити речовини: гліцерин, фенол, метанол?
Самостійна робота Задачі
1) На фенол масою 47 г подіяли розчином, що містив 245 г брому. Яка маса утвореного осаду? (165,5 г);
2) На фенол масою 23,5 г подіяли розчином натрій гідроксиду об’ємом 24,85 мл (ρ =1,38г/мл) з масовою часткою речовини 0,32. Яка маса натрій феноляту утвориться? (29 г).
3. ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф, виконати вправи
Додаток 1
Варіант 1.
1. Напишіть формулу спирту:
a) 3,3 – диетилпентан-2-ол;
b) бутан–1,3-діол.
2. Закінчіть рівняння, назвіть продукти реакції:
|
a) С2Н5ОН + О2 = b) СН3ОН + С2Н5СООН = |
c) С4Н9ОН + К = d) С3Н7ОН = |
3. При взаємодії 40,8 г насиченого одноатомного спирту з натрієм виділилось
4,48 л водню, визначте формулу спирту
Варіант 2.
1. Напишіть формулу спирту:
a) 4-етил-2-метилгексан-3-ол;
b) пропан–1,2 –діол.
2. Закінчіть рівняння:
a) СН3ОН + О2 = c) С4Н9ОН =
b) С2Н5ОН + Na = d) С3Н7ОН + С2Н5СООН =
3. При взаємодії 0,46 г насиченого одноатомного спирту з натрієм виділилось
0,112л водню, визначте формулу спирту.
Варіант 3.
1. Напишіть формулу спирту:
a) 2,3 – диметилпентан-1,2-діол;
b) 2,2 – диетил-3-пропілгексан–1-ол.
2. Напишіть рівняння реакцій:
a) етанол + оцтова кислота =
b) бутанол + хлороводень=
c) гліцерин + калій =
d) внутрішньомолекулярна дегідратація пентан-2-олу
3. При взаємодії насиченого одноатомного спирту масою 59,2 г з металічним калієм утворилося 8,96 л водню. Визначте формулу спирту та обчисліть, яку масу алкену можна добути при його дегідратації.
Варіант 4.
1. Напишіть формулу спирту:
a) 4,4 – диетил-3-метилгептантан-2-ол;
b) 3-пропілгексан–1,2,4-тріол.
2. Напишіть рівняння реакцій:
a) гліцерин + натрій=
b) оцтова кислота + бутанол =
c) міжмолекулярна дегідратація бутанолу
d) пропанол + хлороводень =
3. При взаємодії 7,4 г насиченого одноатомного спирту з натрієм виділилось 1 л водню, причому вихід продукту реакції становив 89% від теоретично можливого. Визначте формулу спирту, складіть формули його ізомерів, назвіть їх.
ТЕМА 4. ОКСИГЕНОВМІСНІ СПОЛУКИ
Заняття № 13
Дисципліна: «Хімія» Тема заняття: Альдегіди. Склад, будова. Функціональна альдегідна група. Ізомерія, номенклатура альдегідів Мета заняття:
навчальна – сформувати у студентів уявлення про розмаїтість оксигеновмісних органічних сполук на прикладі альдегідів, розширити поняття «функціональна група» на прикладі карбонільної функціональної групи, розглянути склад, електронну і структурну формулу альдегідів, сформувати у студентів знання про гомологічний ряд альдегідів, ознайомити їх з номенклатурою, розглянути основні методи добування альдегідів, сформувати вміння називати альдегіди за систематичною номенклатурою та складати структурні формули за їх назвою;
розвиваюча – розвивати логічне мислення, вміння порівнювати, узагальнювати;
виховна – виховувати цілеспрямованість, наполегливість.
Тип заняття: вивчння нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: набір для складання кулеcтержневих моделей молекул.
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань Бесіда:
• Які особливості спиртів порівняно з вуглеводнями?
• Чим це обумовлено?
• Що таке функціональна група?
ІІІ Мотивація навчальної діяльності
Вам відомо, що багато вологих біологічних об’єктів зберігають законсервованими. У чому ж їх зберігають? Чому вони не псуються? Відповідь криється у речовинах, які ми сьогодні розпочнемо вивчати.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
3. Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Сама назва «альдегіди» означає «алкоголь дегідрований», тобто без кількох атомів Гідрогену.
Наприклад,
СН3-СН2-ОН → СН3-СОН
спирт альдегід
Альдегіди – органічні речовини, в яких карбонільна група – СОН сполучена з вуглеводневим радикалом.
СН3-СОН
вуглеводневий радикал карбонільна група
R-СОН, СnH2n+1COH – загальні формули альдегідів
Будова карбонільної групи:
δ+ δ-
Н – С=О Які зв’язки π чи σ присутні в молекулі альдегідів? Яка гібридизація?
|
Н
За місцем подвійного С=О зв’язку є π-зв'язок, а всі інші – σ. Всі σ- зв’язки розташовані у одній площині, а π-зв'язок – перпендикулярно до неї.
• Який зв'язок слабший?
• Чим відрізняється подвійний зв'язок у алкенів і альдегідів?
Подвійний зв'язок у альдегідів розміщений нерівномірно, електронна густина зміщена до атома Оксигену, атом Карбону набуває позитивного заряду, саме це обумовлює підвищену активність карбонільної групи.
Гомологічний ряд альдегідів
Назви альдегідів походять від назв насичених вуглеводнів + аль, перші представники мають також історичні назви.
Метаналь – НСОН – мурашиний альдегід (формальдегід, 40%-й розчин – формалін).
Етаналь – СН3СОН – оцтовий альдегід.
Пропаналь – С2Н5СОН – пропіоновий альдегід.
Бутаналь – С3Н7СОН – масляний альдегід.
Пентаналь – С4Н9СОН – валеріановий.
Гексаналь – С5Н11СОН.
Гептаналь – С6Н13СОН.
Октаналь – С7Н15СОН.
Нонаналь – С8Н17СОН.
Деканаль – С9Н19СОН.
Зверніть увагу: назва альдегідів включає в себе також атоми Карбону карбонільної групи.
Ізомерія в альдегідів буває лише за будовою карбонового скелету :
СН3 |
СН3–СН2–СН2–СОН або СН3 – СН– СОН. Чому?
Номенклатура альдегідів
Назви альдегідів складають як у спиртів з уточненнями:
1) нумерацію починають з кінця, до якого ближча група –СОН, і цей атом
Карбону нумерують першим;
2) перелічують локанти (місця) і назви замісників в алфавітному порядку; 3) при назві головного ланцюга додають закінчення – аль.
![]() 2 - метилпропаналь
2 - метилпропаналь
Чи потрібно вказувати місце групи – СОН?
Більше чи менше ізомерів буде в альдегідів, порівняно з спиртами?
Доведіть.
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Фронтальна робота:
1. Які особливості в будові альдегідів порівняно з спиртами?
2. Назвіть речовини:
а)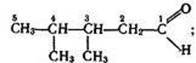 б)
б) 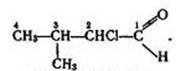
в)СН3 – СН – СН – СН2 – СН – СОН
| | |
СН3 С2Н5 СН3
г)СН3 –– СН – СН – СН – СН - СН2 – СОН
| | | |
СН3 – СН2 СН3 С3Н7 С2Н5
3. Напишіть напівструктурні формули за назвами:
a) 2,3,3-триметилбутаналь
b) 3,3-диетилпентаналь
c) 2,3,3-триетил-4,4-дипропілоктаналь
4. Зобразіть можливі ізомери, склад яких С5Н10О. До якого класу
належить дана сполука?
3. ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф, виконати вправи.
ТЕМА 4. ОКСИГЕНОВМІСНІ СПОЛУКИ
Заняття № 14
Дисципліна: «Хімія»
Тема заняття: Карбонові кислоти. Насичені одноосновні карбонові кислоти. Номенклатура.
Мета заняття:
навчальна – ознайомити зі складом, будовою номенклатурою нового класу органічних речовин – карбоновими кислотами, з’ясувати будову карбоксильної групи, розкрити взаємний вплив карбоксильної та вуглеводневої групи, сформувати у студентів знання про гомологічний ряд насичених одноосновних карбонових кислот, ознайомити їх з номенклатурою;
розвиваюча – розвивати логічне мислення, вміння порівнювати; виховна – виховувати самостійність студентів.
Тип заняття: вивчння нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: зразки продуктів, що містять органічні кислоти
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань Письмове опитування (додаток 1).
Бесіда:
• Пригадайте вивчені класи оксигеновмісних сполук.
• Назвіть їх функціональні групи.
• Як вони впливають на властивості речовин?
ІІІ Мотивація навчальної діяльності
Сьогодні ми розпочинаємо вивчення речовин, яких можна назвати «Знайомі незнайомці».
Здогадайтесь про кого мова.
Для цього перед вами набір продуктів: лимон, столовий оцет, кефір, яблуко.
Що в них спільного?
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Будова карбоксильної групи.
3. Гомологічний ряд карбонових кислот. Номенклатура та ізомерія.
4. Закріплення вивченого матеріалу.
4. Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Карбоновими кислотами називаються органічні речовини, молекули яких
містять одну або
кілька карбоксильних груп ![]() , сполучених з вуглеводневим
радикалом.
, сполучених з вуглеводневим
радикалом.
Назва карбоксил походить від двох слів: «карбоніл» і «гідроксил» так як кислотну групу можна розглядати як поєднання цих двох груп.
карбоніл- -карбоксил -гідроксил
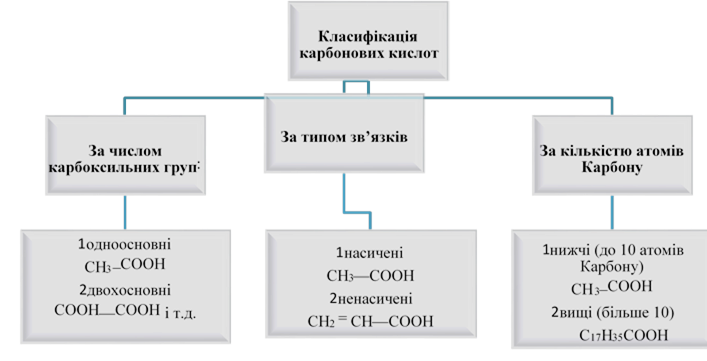
Основність кислот визначається числом в них карбоксильних груп. Так, наприклад, одноосновні кислоти містять одну карбоксильну групу, двохосновні - дві карбоксильні групи.
Ми розглянемо карбонові кислоти, у молекулах яких міститься одна карбоксильна група і насичений вуглеводневий радикал. Такі кислоти називаються насиченими одноосновними.
CnH2n+1COOH або R–COOH – загальна формула
![]() насичених
одноосновних кислот
насичених
одноосновних кислот
Склад насичених одноосновних карбонових кислот можна ще виразити так: CnH2nO2
2. БУДОВА КАРБОКСИЛЬНОЇ ГРУПИ
![]() Порівняйте електронегативність елементів, що утворюють
карбоксильну групу: як відбудеться перерозподіл електронної густини?
Порівняйте електронегативність елементів, що утворюють
карбоксильну групу: як відбудеться перерозподіл електронної густини?
![]() В
карбоксильній групі електронна густина зміщена до ─ С δ+ = Оδ- атома
Оксигену у зв’язку –С=О, за рахунок цього на атомі ↑ Карбону виникає надлишок позитивного заряду,
тому сюди
В
карбоксильній групі електронна густина зміщена до ─ С δ+ = Оδ- атома
Оксигену у зв’язку –С=О, за рахунок цього на атомі ↑ Карбону виникає надлишок позитивного заряду,
тому сюди
Оδ-←Нδ+ зміщується послідовно електронна густина атома Оксигену і
Гідрогену групи –ОН. В результаті зв'язок –ОН стає більш полярний і легко відривається, що визначає кислотні властивості карбоксильної групи.
3. ГОМОЛОГІЧНИЙ РЯД КАРБОНОВИХ КИСЛОТ. НОМЕНКЛАТУРА ТА ІЗОМЕРІЯ.
Для найпоширеніших карбонових кислот часто використовують такі історичні назви як мурашина, масляна, валеріанова тощо. Ці назви пов’язані переважно з тими джерелами, з яких була виділена та чи інша кислота: мурина – з мурашок, оцтова – з оцту, масляна – з масла. За систематичною номенклатурою, назву кислот утворюють із назв відповідних насичених вуглеводнів, додаючи до них суфікс і закінчення -ова і слово кислота.
Зверніть увагу: назва кислот включає в себе також атоми Карбону карбоксильної групи.
НСООН
– мурашина (метанова кислота); ![]()
СН3СООН – оцтова (етанова кислота);
![]() С2Н5СООН
– пропіонова (пропанова кислота);
С2Н5СООН
– пропіонова (пропанова кислота);
![]() С3Н 7
СООН – масляна (бутанова кислота) і т .д.
С3Н 7
СООН – масляна (бутанова кислота) і т .д.
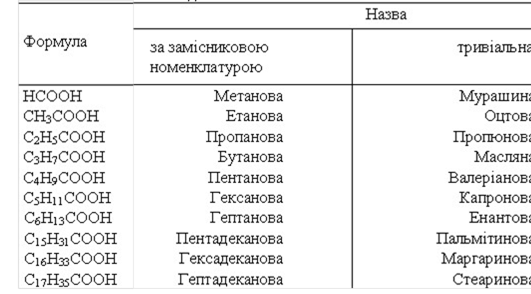
Ізомерія карбонових кислот, як і у випадку альдегідів, обумовлена ізомерією вуглеводневих радикалів.
![]() 2-метилпентанова кислота
2-метилпентанова кислота
![]() 4-етилгептановая
кислота
4-етилгептановая
кислота
Чому у кислот немає ізомерії розташування функціональної групи?
4. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Індивідуальна робота
1. Назвіть речовини:
a) СН3 – СН(СН3)– СН2 – СООН
b) СН3 – СН – СН – СН2 – СН – СООН
| | |
СН3 С2Н5 СН3
c) СН3 –– СН – СН – СН – СН - СН2 – СООН
| | | |
СН3 – СН2 СН3 С3Н7 С2Н5
2. Напишіть напівструктурні формули за назвами:
a) 2,3,3-триметилбутанова кислота;
b) 3,3-диетилпентанова кислота;
c) 2,3,3-триетил-4,4-дипропілоктанова кислота.
3. Зобразіть можливі ізомери, склад яких С5Н10О2. До якого класу
належить дана сполука?
4. Задача.
Виведіть формулу одноосновної насиченої кислоти, в якій:
а) масова частка Оксигену 31,37%. (С4Н9СООН);
б) відносна густина парів за киснем 3,625 (С5Н11СООН).
Якщо можливо, складіть формули її ізомерів.
5. ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф, виконати вправи.
Задача Органічна сполука має відносну густину пари за метаном 2,875 і масові частки Карбону, Гідрогену відповідно 26,09%, 4,35 %, а також містить Оксиген. Визначте її формулу. (СН3СООН).
Додаток 1
Варіант 1
1. Вкажіть формулу пропаналю:
a) С3Н8О;
b) С2Н5СОН;
c) НСОН;
d) С3Н7СОН.
2. Яка функціональна група альдегідів:
a) – СООН;
b) – ОН;
c) – СОН;
d) – NH2.
3. Альдегіди складаються з:
a) вуглеводневого радикалу і карбонільної групи;
b) вуглеводневого радикалу і гідроксильної групи;
c) гідроксильної і карбонільної групи;
d) вуглеводневого радикалу і карбоксильної групи.
4. Метаналь використовують :
a) для виготовлення вибухівки;
b) для консервування біологічних препаратів;
c) для дезінфекції медичних інструментів;
d) для виготовлення поліетилену.
5. Розташуйте речовини із зростанням їх розчинності у воді:
a) пропаналь;
b) метаналь;
c) бутаналь;
d) пентанал.
Складіть формули сполук за назвою:
a) 2-метил-3-хлорбутаналь;
b) 3,3-диметилбутаналь.
7. Відносна густина альдегіду за
киснем 3,125. Визначте його формулу.
Варіант 2
1. Які з перелічених сполук добре розчинні у воді:
a) етанол;
b) етаналь;
c) метаналь;
d) октаналь;
e) гептаналь.
2. Загальна формула альдегідів:
a) R– ОН;
b) R- СООН;
c) R– СОН;
d) R- СООR.
3. Альдегіди застосовують
a) як паливо;
b) у медицині;
c) для добування спиртів, кислот;
d) для виготовлення меблів;
e) для виготовлення штучного волокна.
4. Як називається функціональна група альдегідів:
a) гідроксильна;
b) карбонільна;
c) карбоксильна;
d) альдегідна.
5. Розташуйте сполуки їх збільшенням їх температури кипіння:
a) пентаналь;
b) етаналь;
c) метаналь;
d) гексаналь.
Напишіть формули сполук за назвою:
a) 4-етил-3-метилгексаналь;
b) 2,3,3-трихлорбутаналь.
7. Відносна густина альдегіду за воднем 57. Визначте його формулу.
Варіант 3
1. Для альдегідів властиві реакції:
a) окиснення;
b) дегідратації;
c) розкладу;
d) гідрування;
e) горіння.
2. Речовина, якою можна виявити альдегід, це:
a) Бром;
b) Водень;
c) Натрій;
d) Купрум;
e) (ІІ) гідроксид.
3. З якими речовинами реагуватимуть альдегіди:
a) Na;
b) Ag2O;
c) Сu(OH)2;
d) CH3OH;
e) Н2.
4. Розташуйте альдегіди із зростанням їх відносних молекулярних мас:
a) октаналь;
b) гептаналь;
c) пентаналь;
d) пропаналь.
5. Напишіть формули сполук за назвами:
a) 3-етил-4,4-диметилгептаналь;
b) 4-бром-3,3-диметилпентаналь.
Закінчіть рівняння реакцій:
a) CH3COH + H2 =;
b) C2H5COH + Аg2O=;
c) CH3COH + O2.
7. Відносна густина за воднем альдегіду 29. Визначте його формулу.
Варіант 4
1. Виберіть формулу бутаналю:
a) C3H7OH;
b) C3H7COOH;
c) С3Н7СОН;
d) CH3COH.
2. З якими речовинами реагуватиме оцтовий альдегід:
a) сульфур (VI) оксид; a) кисень;
b) арґентум (І) оксид; b) нітратна кислота;
c) метиловий спирт; c) водень.
3. Яким чином можна відрізнити мурашиний альдегід, етанол, гліцерин?
4. Розташуйте речовини в генетичний ланцюжок для добування альдегіду: a) етен;
b) етаналь;
c) етанол;
d) етан.
5. Напишіть формули сполук за назвою:
a) 2,4-диетил-2-хлорпентаналь;
b) 4,4 – диетил-2,3,5-триметилгексаналь.
6. Закінчіть рівняння реакцій:
a) CH3COH + Ag2O =;
b) C2H5COH + О2 =;
c) HCOH + H2 =.
7. Відносна густина альдегіду за киснем 2,6875. Визначте його формулу.
ТЕМА 4. ОКСИГЕНОВМІСНІ СПОЛУКИ
Заняття № 15
Дисципліна: «Хімія»
Тема заняття: Естери. Склад, властивості, добування та застосування естерів Мета заняття:
навчальна – сформувати у студентів поняття про естери, розширити і поглибити знання студентів про хімічні властивості кислот та спиртів на прикладі реакції естерифікації, показати значення цієї реакції, розглянути практичне значення естерів та їх поширення в природі, продовжувати формувати вміння називати естери, а також розв’язувати розрахункові задачі за їх участю; на прикладі естерів розглянути міжкласову ізомерію органічних речовин;
розвиваюча – розвивати вміння порівнювати, робити висновки, узагальнювати;
виховна – виховувати критичність мислення, розширювати світогляд студентів.
Тип заняття: вивчння нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія» Дидактичне забезпечення: зразки продуктів, отриманих з естерів (парфуми, харчові ароматизатори).
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань Бесіда:
• В чому суть реакції естерифікації?
• За яких умов вона відбувається?
• Які функціональні групи беруть у ній участь?
ІІІ Мотивація навчальної діяльності
Всі з нас полюбляють парфуми. Вважають, що саме їх запах визначає те, як нас сприймають оточуючі. На сьогодні відкрито чимало речовин афродизіаків – ароматичних сполук, запах яких приваблює, хвилює, спокушає. Наприклад, запах жасмину, троянд, бузку, м’яти, лаванди діє на гіпофіз і сприяє виробленню ендорфінів – гормонів щастя.
Про ці чарівні речовини ми сьогодні й поговоримо.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
3. Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Естери – похідні органічних кислот, в яких атом Гідрогену карбоксильної групи заміщений вуглеводневим залишком: R1 – COO – R2 – загальна формула естерів;
СnH2nO2 – в молекулярному вигляді.
Зверніть увагу, така ж загальна формула насичених карбонових кислот, наприклад, СН3СООН і НСООСН3 – приклади міжкласової ізомерії;
COO – функціональна група естерів.
Добування естерів (вихідні речовини – кислота та спирт)
СН3СООН + НО-С2Н5 = СН3СООС2Н5 + Н2О (в присутності конц. сульфатної кислоти) етиловий естер оцтової кислоти, етилацетат, етилетаноат НСООН + НО-С2Н5 = НСООС2Н5 + Н2О – етилформіат, етилметаноат
С2Н5СООН + НО-СН3 = С2Н5СООСН3 + Н2О – метилпропаноат.
Номенклатура естерів: замісник + алкан + оат (метил +пропан+оат).
Властивості естерів Бесіда:
Спробуйте спрогнозувати фізичні властивості естерів: - агрегатний стан (леткі рідини, С більше 10 – тверді); - запах.
Етилформіат – ром;
Метилбутаноат – яблуко;
Етилбутаноат – ананас;
Бензилацетат – жасмин;
Ізобутилбутаноат – абрикос;
Бутилбутаноат – банан;
Ізобутилацетат – груша;
А також мед, троянди, хризантеми.
Чому сильний запах має велика кількість естерів, а серед кислот лише оцтова?
ü розчинність (нерозчинні у воді).
ü температури плавлення і кипіння (нижчі, ніж у відповідних
кислот).
Проблемне питання:
ü Чому при однаковій загальній формулі спостерігається значна
відмінність у фізичних властивостях кислот та естерів? (відсутність водневого зв’язку)
ü Яким чином це відображається на властивостях естерів?
(розчинність, нижчі температури плавлення кипіння, запах, агрегатний стан)
Хімічні властивості естерів
1. Окиснення (спалахують легко) НСООСН3 + 2О2 → 2СО2 + 2Н2О
2. Реакція гідролізу – взаємодія з водою (в лужному середовищі):
СН3СООС2Н5 + Н2О = СН3СООН + НО-С2Н5;
СН3СООС2Н5 + NaОH = СН3СООNa + НО-С2Н5 – необоротна реакція
Застосування естерів:
(демонстрація зразків продукції з естерів)
1. В парфумерії;
2. Харчова промисловість; 3. Виробництво ліків, вітамінів;
4. Розчинники, клей.
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Робота в парах:
1. Назвати сполуки, скласти рівняння реакцій їх добування:
ü СН3СООС2Н5;
ü С3Н7СООСН3;
ü С2Н5СООС3Н7;
2. Напишіть формули: метилетаноат, пропілметаноат, етилпропаноат.
3. Напишіть формули можливих ізомерів складу С5Н10О2, назвіть їх.
«Практикум»
Знайдіть у продукті естер, складіть його формулу (студентам видано лак
для нігтів, освіжувач повітря, парфуми)
Задача
Яку масу етанолу потрібно взяти для добування етилацетату масою 396 г,
якщо втрати 10%? (230 г)
3. ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф, виконати вправи.
ТЕМА 4. ОКСИГЕНОВМІСНІ СПОЛУКИ
Заняття № 16
Дисципліна: «Хімія»
Тема заняття: Жири, їх склад, хімічна будова. Гідроліг, гідрування жирів. Біологічна роль жирів.
Мета заняття:
навчальна – сформувати знання студентів про жири як естери гліцерину і вищих карбонових кислот, розглянути будову, номенклатуру та властивості жирів, ознайомити студентів з практичним значенням реакцій гідролізу та гідрування жирів, з’ясувати їх біологічну роль та галузі застосування;
розвиваюча – розвивати вміння порівнювати, продовжувати розвивати навички роботи з лабораторним обладнанням;
виховна – виховувати бережне ставлення до свого здоров’я, розширювати світогляд студентів;
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: зразки жирів
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с.
9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань
Письмова робота за кількома варіантами (додаток 1).
Бесіда:
• Які речовини називаються багатоатомними спиртами? Приведіть
приклади спиртів.
• Які речовини називаються карбоновими кислотами? Приведіть
приклади вищих карбонових кислот.
• Які речовини називаються естерами?
• Що таке естерифікація?
ІІІ Мотивація навчальної діяльності
Уявіть ситуацію: ви вирушаєте у важкий похід і запасаєтеся продуктами. Виберіть лише один продукт, який візьмете з собою: картопля, сало, хліб, цукор, молоко.
Який продукт і чому варто було обрати, з’ясуємо сьогодні на уроці.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
3. Підсумки заняття і повідомлення домашнього завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Історичні дати.
У 1779 р. шведський хімік Карл Вільгельм Шеєле виявив: один з продуктів гідролізу (розкладання під дією води) жирів – гліцерин
1817 р. його співвітчизник Шеврель добув з жирів уже відому «солодку олію Шеєле», яку назвав гліцерином. Непересічне значення мало також відкриття ним у продуктах дії водних розчинів лугів і кислот на різноманітні жири раніше невідомих сполук. Ними виявилися вищі карбонові кислоти – стеаринова, пальмітинова, олеїнова
Тобто за результатами аналізу продуктів гідролізу Шеврель зміг зробити певні висновки про склад жирів. Сорок років потому Марселен Бертло встановив структуру гліцерину і з нього та вищих карбонових кислот синтезував жир. Отже, склад і структуру природних жирів було доведено експериментально.
Жири - природна сировина, з якої шляхом хімічних перетворень вперше добули вищі карбонові кислоти. Найвідоміші поміж них - насичені пальмітинова С15Н31СООН та стеаринова С17Н35СООН кислоти й ненасичена олеїнова кислота С17Н33СООН. Вони входять до складу стеарину, косметичних засобів. За стандартних умов пальмітинова й стеаринова кислоти перебувають у твердому агрегатному стані й зовні нагадують парафін. Олеїнова кислота - рідина.
2. Утворення жиру
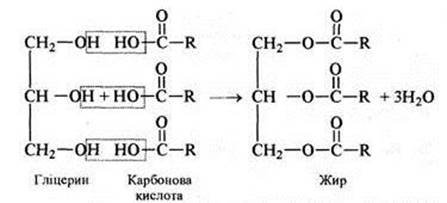
3. Фізичні властивості жирів.
Деякі жири при звичайній температурі – тверді речовини, бараняче, свиняче; Інші рідкі, так звані олії(соняшникова, кукурудзяна, лляна…). Жири в яких переважають насичені кислоти – тверді; Олеїнова кислота – основний компонент оливкової олії при звичайних температурах є рідкою, бо її температура плавлення – 13,4 градуси цельсія. Тоді як пальмітинова і стеаринова відповідно – 63,1 і 69,6 градусів. Жири погано розчиняються у воді, але добре розчинні у бензині, спирті і інших розчинниках.
Чи мають жири смак, запах, колір?
Температури плавлення і кипіння різні. Жири утворені гліцерином і насиченими кислотами мають вищі температури плавлення.
4. Класифікація жирів
|
Жири |
|||
|
Рослинні (ненасичені) |
Тваринні (насичені) |
||
|
Тверді (пальмова олія) |
Рідкі (більшість – соняшникова, оливкова, лляна) |
Тверді (більшість – свинячий жир, масло) |
Рідкі (рибячий жир) |
1. Знаючи, що жири - це естери, скажіть, якою основною
властивістю вони повинні володіти? (гідроліз)
2. Що таке гідроліз? (обмін речовин з водою)
3. Процес гідролізу жирів відбувається й в організмі людини. Як і де це
відбувається? (Жири під дією ферменту ліпази розщеплюються в 12-перстной кишці й тонкому кишечнику).
5. Хімічні властивості жирів:
Гідроліз
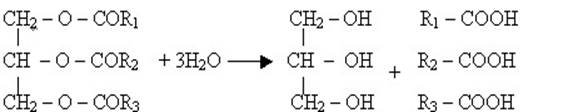
У шлунково-кишковому тракті тваринних організмів відбувається гідроліз спожитих жирів. З утвореного гліцерину й вищих карбонових кислот організм синтезує специфічні для нього жири.
Лужний гідроліз:
Унаслідок лужного гідролізу жирів добувають гліцерин і мила - натрієві та калієві солі вищих карбонових кислот
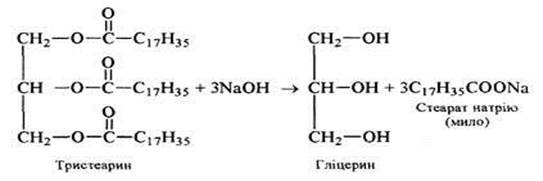
Тепер зрозуміло, що свого часу Жоффруа дією сильної кислоти на мило - сіль слабкої органічної кислоти - добув суміш вищих карбонових кислот:
Для жирів рослинного походження, крім гідролізу, характерні також реакції ненасичених карбонових кислот. Які специфічні реакції цих речовин ви знаєте?
Гідрування жирів
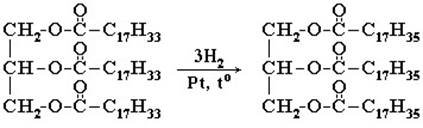
Бромування (якісна реакція на ненасичені жири)
|
СН2 –О–СО–С17Н33 |
| СН2 –О–СО–С17Н33 |
|
СН2 –О–СО–С17Н33Br2 | СН – О–СО–С17Н33Br2 |
|
6. Добування жирів у промисловості.
Синтез жирів на даний час економічно не вигідний. Практично жири одержують із природних джерел. При цьому використовують такі способи:
a) втоплювання – нагрівання тваринних тканин;
b) відтискання – пресування нагрітих рослинних насінин під тиским; тобто олію виготовляють з подрібненого насіння, з якого попередньо вилучили значну частину твердої оболонки. Процес проводять при нагріванні. потім олію фільтрують Це нерафінована олія. Якщо олію обробляють лугом, то вона – рафінована. Її використовують для обсмажування.
c) екстрагування – розчинення жиру у хімічних розчинниках з наступним його витягом. Це низка послідовних операцій: очищення, сущіння, видалення оболонки, подрібнення насіння, витягування з нього за допомогою спеціальних розчинників олії та наступного видалення розчинника.
7. Застосування жирів
(презентації та розповіді студентів)
|
o харчова промисловість; o маргарин; o у домашніх умовах; o мило; |
o гліцерин; o медицина; o оліфа; o косметичні засоби. |
8. Біологічна роль жирів
У рослинах жири утворюються з вуглеводів. Цей процес найінтенсивніше відбувається в насінні дозріваючих олійних культур і плодах. Під час проростання насіння жири, навпаки, розщеплюються (за участю ферментів) на вищі карбонові кислоти і гліцерин, з якого утворюються вуглеводи.
Жири входять до складу тканин тварин, рослин. Вегетативнi частини рослин накопичують не бiльше 5% лiпiдiв, насiння – до 50% i бiльше. В органiзмi людини в нормi мiститься 10-20% жиру, але при наявностi деяких порушень жирового обмiну його кiлькiсть може змiнюватися.
9. Функції жирів:
1. Енергетична – окиснення 1г жиру спричиняє виділенню 39 кДж
енергії;
2. Запасаюча – жири – резервні речовини (нормальної комплекції доросла людина має у своєму організмі 9 – 12 кг жиру, що відповідає 251000 – 377000 кДж (60000-90000 ккал) і становить запас енергії на цілий місяць);
3. Теплоізоляційна – охороняють організм від теплових втрат, тому що є поганим провідником тепла (у китів, які живуть у холодних морях, шар підшкірного жиру досягає 1 м)
4. Є джерелом води – 100 г жиру при окисненні дає 110-140 г води, завдяки чому верблюди можуть у не пити у пустині 10-12 діб.
5. Захисна – жир захищає органи (печінку, нирки) від механічних впливів, завдяки пружності.
6. Регуляторна – жири беруть участь в утворенні гормонів і засвоєнні вітамінів D, A, E.
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Завдання в групах
1. Скласти формулу жиру:
ü Олеїнодистеарат, триолеат, дипальмітостеарат.
ü Вказати його агрегатний стан і тип (простий, змішаний).
2. Назвіть жир:
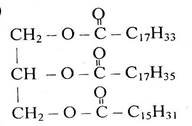
3. Заповнити пропуски в твердженнях
1. Жири утворюються з … і …;
2. Жири за агрегатним станом поділяються на: … і …, а за походженням на … і …;
3. Змішані жири містять залишки ……… вищих карбонових кислот;
4. Гідролізом називають реакцію жиру з ……, внаслідок якої утворюються…… і …;
5. Гідроліз відбувається при температурі …….;
6. Якщо гідроліз здійснювати за наявності лугу, то крім гліцерину утворюються ..….;
7. Якщо рідкі жири приєднують…….., то вони перетворюються на …… Цей процес називається…;
8. Маргарин – це……….. Його виробляють із…….; 9. Внаслідок окиснення жирів на повітрі утворюються …..;
10. Повне окиснення жирів – це…….
Фронтальна робота з групою:
Закінчіть твердження («Слабка ланка»):
1. Функції жирів - …;
2. Жири бувають ….. ;
3. Тверді жири утворені……., олії утворені……;
4. Жири належать до класу…;
5. Для жирів характерні реакції …..;
6. У повсякденному житті протікають реакції …..;
7. Жири – джерело ……;
8. Жири застосовують у ….. ;
У світі літератури:
«Височенні хвилі здіймались перед судном, обминути їх здавалося неможливим. І раптом Джон вигукнув до матросів: - Хлопці, біжіть по лій.
Мерщій.
Команда вмить зрозуміла капітана. Матроси перевернули барила з лоєм, масна пелена немов скувала поверхню моря і судно проскочило над втихомиреними хвилями, які за мить знову розбушувалися…». Поясніть дії капітана.
Про який хімічний процес йде мова? Впізнайте всі речовини:
«Наб і Пенкрофт зрізали весь жир з туші дюгоня, склали у великі посудини, потім додали попіл спалених водоростей і деякий час варили…». В результаті отримали два корисних на безлюдному острові продукти, один став основою вибухівки, а інший пригодився в побуті. Назвіть їх.
3. ПІДСУМКИ ЗАНЯТТЯ І ПОВІДОМЛЕННЯ ДОМАШНЬОГО
ЗАВДАННЯ
Саморефлексія: (так - не дуже – ні)
1. Чи сподобалося вам заняття?
2. Вам тема зрозуміла?
3. Чи активно ви працювали?
4. Як ви гадаєте, пригодиться вивчене сьогодні вам у житті?
Вивчити параграф, вправа.
Творче завдання: скласти сенкан, де ключове слово жири.
Додаток 1.
Варіант 1.
1. Розташуйте речовини за збільшенням числа атомів Карбону в них:
a) утилацетат;
b) ропілметаноат;
c) утилпропаноат;
d) етилацетат.
2. Встановіть відповідність:
|
a) HCOOC4H9; |
1. метилацетат; |
|
b) C2H5COO C3H7; |
2. пропілбутаноат; |
|
c) CH3COOC2H5; |
3. пропілпропаноат; |
|
d) С3Н7СОО C3H7; |
4. етилацетат; |
|
e) CH3COOCH3.
|
5. бутилформіат. |
3. Складіть формули естерів, що мають запах:
a) етилформіат – ром;
b) метилбутаноат – яблуко;
c) бутилбутаноат – абрикос;
4. Закінчіть рівняння реакцій
a) C2H5COOH+CH3OH =;
b) HCOOC3H7 + H2O =;
c) С4Н9COOCH3 + NaOH=.
5. Відносна густина за воднем естеру 51. Визначте його склад і можливі ізомери.
Варіант 2.
1. Розташуйте естери із збільшенням температур їх кипіння:
a) етилацетат;
b) пропілбутаноа;
c) бутилацетат;
d) метилформіат.
2. Встановіть відповідність між естерами і продуктами гідролізу
|
a) метилпропаноат; b) етилацетат; c) метилформіат; d) пропілбутаноат.
|
1. метиловий спирт, мурашина кислота; 2. пропіловий спирт, бутанова кислота; 3. етиловий спирт, оцтова кислота; 4. метиловий спирт, пропанова кислота. |
3. Складіть формули естерів, що мають запах:
a) етилбутаноат – ананас;
b) бутилбутаноат – банан;
c) бутилацетат – груша.
4. Закінчіть рівняння реакцій:
a) CH3COOC2H5 + H2O;
b) C3H7COOCH3 + H2O;
c) НСООН + С3Н7ОН =.
5. Масова частка Оксигену в естері 36,36%. Визначте його склад і можливі ізомери.
ТЕМА 4. ОКСИГЕНОВМІСНІ СПОЛУКИ
Заняття № 17
Дисципліна: «Хімія»
Тема заняття: Мило, його мийна дія. Відомості про синтетичні мийні засоби, їх значення. Захист природи від забруднення синтетичними мийими засобами. Поняття про спектральні методи встановлення структури органічних речовин Мета заняття:
навчальна – продовжувати формувати у студентів знання про карбонові кислоти та їх солі, ознайомити студентів із складом молекул мила, показати їх хімічну природу як солей вищих карбонових кислот, пояснити принцип дії мила та синтетичних миючих засобів, з’ясувати переваги та недоліки кожного, показати екологічний аспект раціонального використання миючих засобів, їхню роль у забрудненні навколишнього середовища, основні принципи очищення стічних вод;
розвиваюча – розвивати вміння порівнювати, узагальнювати; виховна – виховувати екологічну культуру студентів.
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія» Дидактичне забезпечення: зразки мила та синтетичних миючих засобів
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань Тестові завдання (додаток 1).
Письмові завдання .
1. Скласти формули:
• три олеат;
• олеїнодипальміта;
• олеїнопальмітиностеарат гліцерину.
2. Здійснити гідрування дипальмітоолеату.
3. Здійснити лужний гідроліз стеародипальмітату.
4. Задача. Яку масу тристеарину можна отримати з 442 кг триолеїну
(втрати 5%)?
Усне опитування
• Які речовини належать до жирів? Якими кислотами жири утворені?
• Які бувають жири? Порівняйте тверді та рідкі жири (склад,
властивості, значення).
• Яке значення жирів для організмів рослин та тварин?
• Навіщо проводять гідрування жирів?
• В чому полягає шкода окиснення жирів?
ІІІ Мотивація навчальної діяльності
Всі ми розпочинаємо день з гігієнічних процедур, які неможливо уявити без мила, гелю для душу, інших миючих засобів. Не обійтися і без великого прання.
Як ви гадаєте, якими засобами краще при цьому користуватися: милом чи іншими миючими засобами (пральними порошками)?
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
3.
Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Мило було відоме людству ще у VІ до н.е., коли фінікійці навчилися варити його з козячого жиру і деревного попелу. Про його цінність як очищувального засобу висловлювався ще Гален. Пройшли тисячоліття, а спосіб виготовлення мила не змінився.
При нагрівання жиру в присутності лугів відбувається лужний гідроліз, або омилення жирів.
Спробуйте скласти рівняння омилення тристеарату.
Щоб це мило відокремити в розчин додають сіль і мило спливає на поверхню у вигляді щільного шару – ядра, з якого готують ядрове (господарське) мило. У туалетне мило додають барвники, ароматизатори, гліцерин.
Мила, що утворюються при омиленні жирів є солями вищих карбонових кислот:
ü С17Н35СООNа – тверде мило; ü С17Н35СООК – рідке мило.
Умовно мило складається з двох частин: гідрофільної – СОО –, яка розчинна у воді і гідрофобної С17Н35 –, яка притягується до органічних забруднюючих частинок. Миюча дія мила полягає в тому, що воно оточує бруд, відриває його від поверхні, а потім бруд змивається водою.
Якщо вода тверда, тобто містить хлориди, сульфати, карбонати, то мило втрачає мийну дію.
2С17Н35СООNа + СаСl2 = (С17Н35СОО)2Са↓ + 2NаСl
Чи можна у морській воді милом випрати речі?
Саме тому на зміну милу прийшли СМЗ, які, крім того,одержують з нехарчової сировини.
Виготовлення СМЗ:
R-CH2-OH + HO-SO3H= R-CH2-O-SO3H + H2O – естер сульфатної кислоти; R-CH2-O-SO3H + NaOH = R-CH2-O-SO3Na + H2O – натрієва сіль естеру сульфатної кислоти.
За будовою така сіль подібна до звичайного мила, але вона не втрачає своїх миючих властивостей у твердій воді.
2R-CH2-O-SO3Na + СаСl2 = (R-CH2-O-SO3)2Са + 2NaСl – розчинні солі
Миючі засоби при їхньому використанні не руйнуються, а потрапляють зі стічними водами у водойми. Тому тепер намагаються створити такі СМЗ, які б руйнувалися мікроорганізмами у природі.
Ще одним недоліком СМЗ є фосфати (30%), які потрапляючи у воду, стають сприятливим середовищем для розростання зелених водоростей, в результаті чого кількість кисню зменшується й інші організми гинуть.
Поняття про спектральні методи встановлення структури органічних речовин.
За весь час існування органічної хімії як науки важливим завданням було точно визначити структуру органічних сполук. Тобто встановити, які атоми входять до складу сполуки, у якому порядку ці атоми зв'язані між собою і як розташовані в просторі.
За допомогою елементного аналізу неможливо встановити порядок зв'язків між атомами. З цією метою використовують спектральні методи аналізу.
Здатність випромінювати і поглинати електромагнітне випромінювання є загальною властивістю всіх атомів і молекул. Випромінювання ( або поглинання) вельми вибіркове, тобто даною молекулою інтенсивно поглинається випромінювання тільки певної довжини хвилі, тоді як випромінювання інших довжин хвиль поглинається слабо або зовсім не поглинається. Крива залежності поглинання від довжини випромінюваної хвилі (або частоти випромінювання) називається спектром поглинання речовини, який є специфічною характеристикою даної речовини. Характеристикою спектра поглинання є положення максимумів (мінімумів) поглинання, а також інтенсивність поглинання.
Метод дослідження спектрів випромінювання чи поглинання речовин – спектроскопія. В залежності від досліджуваних спектрів розрізняють інфрачервону спектроскопію (ІЧ), спектроскопію в ультрафіолетовій (УФ) та видимій області.
![]() Вивчення спектрів
поглинання хімічних речовин з різною структурою дало
можливість встановити, що основними факторами, які обумовлюють поглинання
Вивчення спектрів
поглинання хімічних речовин з різною структурою дало
можливість встановити, що основними факторами, які обумовлюють поглинання
світла, є наступні особливості будови: наявність кратних (подвійних, потрійних) зв’язків, карбонільної, карбоксильної, амідної, нітро- та інших функціональних груп. Кожна функціональна група характеризується поглинанням в певній області спектру. Таким чином наявність в ІЧ спектрах тих чи інших полос поглинання дозволяє розшифрувати структуру речовини.
Для ідентифікації речовини за її спектром застосовують метод порівняння з спектром вже відомої сполуки, отриманої в тих же умовах.
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Бесіда:
• Які миючі засоби є більш безпечними для вмивання? Чому?
• Для чого волосся після миття шампунем рекомендують споліскувати оцтом?
• Яке значення спектральних методів аналізу речовин?
• Які сполуки частіше досліджують з їх допомогою: органічні чи
неорганічні? Чому?
Практикум. За етикетками проаналізуйте склад мила і СМЗ.
Задача. Яку масу калій гідроксиду і тристеарату потрібно взяти для добування 500 кг мила, якщо втрати становлять 20%? (108,7кг, 576 кг).
3. ДОМАШНЄ ЗАВДАННЯ.
Вивчити параграф, виконати
вправи.
Додаток 1
ТЕСТ ПО ТЕМІ: «ЖИРИ»
1. Жири - це...
а) багатоатомні спирти;
б) складні естери гліцерину та карбонових кислот;
в) карбонові кислоти.
2. Які речовини входять до складу тваринних жирів:
а) гліцерин;
б) етанол;
в) пальмітинова кислота;
г) стеаринова кислота;
д) лінолева кислота.
3. Які реакції не характерні для рослинних жирів:
а) гідроліз;
б) заміщення;
в) гідрування;
г) дегідрування.
4. Які речовини можуть утворитися при гідролізі рослинних масел:
а) лінолева кислота;
б) гліцерин;
в) мурашина кислота;
г) олеїнова кислота;
д) стеаринова кислота.
5. Які реакції характерні для тваринних жирів:
а) водний гідроліз;
б) гідрування;
в) приєднання;
г) омилення;
д) окиснення.
6. Хто з перерахованих учених уперше синтезував жири:
а) Бутлеров;
б) Бертло;
в) Шеелє;
г) Шеврель.
7. Як називаються процес розщеплення жирів на гліцерин і вищі карбонові кислоти:
а) горіння;
б) гідроліз;
в) гідрування;
г) омилення.
8. Які з наведених жирів є змішаними:
а) триолеїн;
б) пальмітодиолеїн;
в) диолеїностеарин;
г) трипальмітин.
9. Як називається процес перетворення рідких жирів у тверді:
а) омилення;
б) гідроліз;
в) гідрування;
г) окиснення;
д) горіння.
10. Як називається наведений жир?
|
а) СН2–ОСОС17Н31; б) СН–ОСОС17Н31; в) СН2ОСОС17Н31. |
1) триолеїн; 2) тристеарин; 3) трипальмітин. |
11. Назвіть жир

ТЕМА 5. НІТРОГЕНОВМІСНІ СПОЛУКИ
Заняття № 18
Дисципліна: «Хімія»
Тема заняття: Аміни, їх склад, будова, властивості Мета заняття:
навчальна – розширити знання студентів про органічні сполуки на прикладі нітрогеновмісних речовин, сформувати поняття про аміни як органічні основи, ознайомити з їх класифікацією, властивостями, дати уявлення про будову молекул амінів, їх ізомерію, гомологію, номенклатуру, показати поширення в природі амінів, їх біологічну роль, продовжувати формувати вміння складати структурні формули на прикладі гомологів та ізомерів амінів;
розвиваюча – розвивати вміння порівнювати, узагальнювати; виховна – розширювати науковий світогляд студентів.
Тип заняття: вивчння нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: моделі молекул
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою; перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань Бесіда:
1. Які групи органічних речовин вам відомі?
2. Які особливості у будові та властивостях характерні для них?
3. Пригадайте основні відмінності між ними?
ІІІ Мотивація навчальної діяльності
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
3. Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Сьогодні ми починаємо вивчати групу органічних речовин, які, як вважають, стали основою життя на землі, а саме нітрогеновмісні речовини.

Ці речовини саме таким чином ускладнювалися в процесі еволюції світу і виникненні життя на Землі.
2. Найпростішими сполуками цієї групи органічних речовин є аміни.
Аміни – похідні амоніаку, в яких один чи кілька атомів Гідрогену заміщений на вуглеводневий залишок.
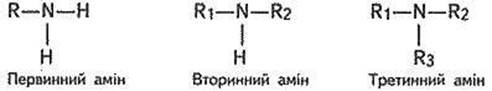
Н – N – Н
|
N
Амоніак
R-NH2 R-NH-R R-N(R)-R
Визначте, які з амінів первинні, вторинні, третинні:
СН3–NH–СН3, (СН3)3–N, СН3–NH2, С2Н5–N –(СН3)2.
За особливостями будови вуглеводневого залишку аміни класифікують на:
• насичені (СН3-NH2);
• ненасичені СН3-СН=СН - NH2;
• ароматичні (С6Н5- NH2).
Загальна формула насичених амінів:
R-NH2 або СnH2n+1NH2
![]()
![]()
вуглеводневий залишок аміногрупа
Ізомерія амінів обумовлена:
1. Ізомерією карбонового ланцюга (починаючи з С4)
СН3–СН2–СН2–СН2– NH2 або СН3 – СН–СН2– NH2
|
СН3
2. Місцем аміногрупи (починаючи з С3) СН3–СН2–СН2–NH2 СН3–СН–СН3
|
NH2
3. Кількістю залишків, сполучених з аміногрупою:
С3Н7–NH2, СН3–СН2–NH–СН3, (СН3)3–N
Як бачимо, виникає проблема у розрізненні цих ізомерів.
Номенклатура амінів Первинні аміни:
СН3–NH2 – метиламін (метанамін);
С2Н5–NH2 – етиламін (етанамін);
СН3–СН2–СН2– NH2 пропан–1–амін;
СН3–СН( NH2) –СН3 пропан–2–амін;
СН3–СН (СН3) –СН2– NH2 2 – метилпропан–1–амін.
Вторинні і третинні аміни: СН3–NH–СН3 –диметиламін;
(СН3)3–N – триметиламін;
С2Н5 – N – (СН3)2 – етилдиметиламін.
![]() Будова
молекули метиламіну
Будова
молекули метиламіну
Н
| δ- δ+
Н – С – N – Н , до атома Нітрогену зміщується | | електронна густина, тому молекула
Н Н полярна.
Фізичні властивості амінів:
С1-С3 – газоподібні, решта рідини або тверді.
Газоподібні і рідкі мають неприємний запах.
Перші представники розчинні у воді.
Температури кипіння у амінів вищі ніж у вуглеводнів через утворення водневого зв’язку.
Хімічні властивості
Оскільки атом Нітрогену має неподілену пару електронів, аміни, як і амоніак проявляють властивості основ, проте вони є сильнішими основами.
Основні властивості посилюються в ряду:
Амоніак< первинні аміни <вторинні аміни <третинні аміни
1. Взаємодія з водою
СН3-NH2 + НОН = СН3-NH3ОН ↔ СН3-NH3+ + ОН- йон метил амонію.
2. З кислотами:
СН3NH2 + НCl = СН3NH3Cl –метиламоній хлорид
Солі амінів, як і солі амоніаку реагують з лугами:
СН3NH3Cl + NaOH = СН3NH2 + NaCl + H2O.
3. Горіння:
4СН3-NH2 + 9О2 = 4СО2 + 2N2 + 10H2О
Добування амінів:
Взаємодія спиртів з амоніаком:
СН3ОН + NH3 = СН3NH2 + Н2О, при подальшій дії спирту утворюється вторинний і третинний амін.
Застосування:
o виробництво полімерів; o синтетичних волокон; o барвників; o лікарських препаратів; o компонент ракетного палива.
Вплив на організм
Аміни, як правило отруйні, токсичні, мають подразнюючу дію на організм, спричиняють порушення дихання, негативно впливають на нервову систему.
Утворюються в природі при гнитті органічних решток.
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Робота в парах:
1. Напишіть формули речовин:
a) триетиламін;
b) бутан–2–амін;
c) діетилметиламін;
d) 2–метилгексан–3–амін.
2. Які з них первинні, вторинні, третинні?
3. Зобразіть напівструктурні формули амінів складу С4Н11N.
4. Обчисліть об’єм метиламіну, що містить 4% домішок, який згорів,
якщо при цьому утворилося 4,9 л азоту. (10,2 л)
Індивідуальні завдання:
При спалюванні аміну масою 11,8 г утворився вуглекислий газ масою 26,4 г, 16,2 г води і азот. Густина речовини за гелієм 14,75. Визначте формулу аміну, складіть формули його ізомерів. (С3Н7NH2)
3. ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф, виконати вправи.
Задача. Знайдіть формулу вторинного насиченого аміну, який у 1,551 раза важчий від повітря. (СН3-NH–СН3).
ТЕМА 5. НІТРОГЕНОВМІСНІ СПОЛУКИ
Заняття № 19
Дисципліна: «Хімія»
Тема заняття: Амінокислоти. Ізомерія. Особливості хімічних властивостей. Пептиди. Пептидний зв'язок Мета заняття:
навчальна – сформувати знання про амінокислоти як біфункціональні органічні сполуки, розглянути їх склад, будову, показати амфотерний характер амінокислот, як необхідну передумову їх поліконденсації, cформувати вмінні і навички складати рівняння хімічних реакцій властивих амінокислотам, з’ясувати біологічну роль амінокислот та їх поширення у природі;
розвиваюча – розвивати вміння порівнювати, узагальнювати; виховна – виховувати самостійність.
Тип заняття: вивчння нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: зразки амінокислот Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань Завдання біля дошки:
1. Скласти рівняння реакцій, в які вступає анілін.
2. Розташувати речовини за посиленням основних властивостей:
• метиламін;
• анілін;
• амоніак; диметиламін;
• триметиламін.
Усне опитування:
ü Порівняйте анілін з амінами та бензином: що подібного, а в чому
відмінність?
ü Як впливає будова аніліну на його властивості?
ü З чим пов’язане застосування аніліну?
ü Сформулюйте правила безпечної поведінки з ним.
ІІІ Мотивація навчальної діяльності
Вважають, що життя на землі зародилось тоді, коли виникли білки. На сьогодні відомо 2*1018 білків, лише в людському організмі їх є 5 млн. Проте всі ці білки побудовані лише з 20 амінокислот. Як таке можливо? Сьогодні ми це і з’ясуємо.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
3.
Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
З яких частин, судячи з назви, повинні складатися амінокислоти?
Амінокислоти – похідні вуглеводнів, що містять одночасно карбоксильну та аміногрупу.
Аміногрупа R
![]() |
|
NH2 - СН - COOH ![]() карбоксильна
група
карбоксильна
група
Часто молекулу амінокислот називають біполярною, тому що аміногрупа проявляє основні властивості, а карбоксильна – кислотні, як результат, амінокислоти амфотерні сполуки.
Ізомерія амінокислот обумовлена:
Ø будовою карбонового ланцюга (СН3-СH(СН3)- СH(NH2) – COOH);
Ø місцем аміногрупи, яке вказують як цифрами, так грецькими літерами
(α, β, γ, δ) -
4 γ 3β 2 α 1
(СН3-СH(СН3)- СH(NH2) – COOH)
Номенклатура амінокислот:
1. Обираємо найдовший ланцюг (обов’язково з аміно – і карбоксильною
групою);
2. Нумеруємо, починаючи з карбоксильної групи (літери з наступного
атома Карбону);
3. Вказуємо місце аміногрупи (цифрою чи літерою);
4. Вказуємо місце і назви інших замісників;
5. Називаємо головний ланцюг:
ü СH2(NH2) – COOH – аміноетанова кислота (амінооцтова) – гліцин;
3 β 2 α 1
ü СН3 – СH(NH2) – COOH – 2–амінопропанова кислота (α-
амінопропанова кислота) – аланін;
3 β 2 α 1
ü СН2(NH2) – СH2– COOH – 3–амінопропанова кислота (β-
амінопропанова кислота);
4 γ 3 β 2 α 1
ü СН3–СH(СН3)–СH(NH2)–COOH – 2–міно–3–метилбутанова кислота
– валін (α – аміно–3 метилбутанова кислота).
Цікавим є те, що в живих організмах є лише α–амінокислоти.
Чому α–атом Карбону не перший, а другий?
1. Фізичні властивості амінокислот: (робота з підручником)
• тверді, кристалічні;
• розчинні у воді;
• деякі мають солодкий смак;
• температури плавлення вищі, ніж у відповідних кислот.
Чому амінокислоти так відрізняються від карбонових кислот?
Хімічні властивості:
З якими класами органічних сполук будуть виявляти подібність амінокислоти?
1. Взаємодія з лугами та оксидами металів:
СH2(NH2) – COOH + NaОН = СH2(NH2) – COONa+ HОН – натрій аміноацетат.
2. З спиртами:
СH2(NH2) – COOH + СН3ОН = СH2(NH2) – COOСН3+ HОН.
3. З купрум (ІІ) гідроксидом (якісна реакція)
2СH2(NH2) – COOH + Сu(ОН)2 = (СH2(NH2) – COO)2Cu+ 2H2О – купрум аміноацетат (синього кольору).
4. З кислотами:
СH2(NH2) – COOH + НCl = [NH3СH2– COOH]Cl – гліциній хлорид.
5. Поліконденсація – взаємодія 2 і більше амінокислот між собою з утворенням полімеру (поліпептиду) і відщепленням води:
пептидна група
![]() H–N–СH2–COOH+H–N–СH2–COOH=H–N–СH2– CO– N- СH2– COOH +
Н2О
H–N–СH2–COOH+H–N–СH2–COOH=H–N–СH2– CO– N- СH2– COOH +
Н2О
| | | Н
Н Н Н пептидний зв’язок дипептид
В такій реакції може брати участь велика кількість амінокислот, утворюючи три–, чотири – і поліпептид. Кількість амінокислот у ньому може досягати кількох сотень, навіть тисяч, формуючи білок. Наприклад, інсулін складається з 51 амінокислоти.
Добування амінокислот:
1. Гідроліз білків (у присутності кислот чи лугів).
2. Дія амоніаку на галогенопохідні кислот:
a) СH3– COOH + Cl2 = ClСH2– COOH + HCl;
b) ClСH2– COOH + 2NH3 = СH2(NH2) – COOH + NH4Cl.
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Бесіда:
§ Чому 2 амінокислоти можуть взаємодіяти між собою, а дві кислоти ні?
§ Чим відрізняється поліконденсація від полімеризації?
§ Яке значення амінокислот для організму?
Робота в парах:
1. У трьох пробірках містяться розчини: оцтової кислоти, амінооцтової кислоти, глюкози. Як їх розрізнити? Напишіть формули речовин:
a. 2– аміно–3–етилпентанова кислота;
b. β–аміно – 2,3,4–триметилгексанова кислота.
2. Складіть формули всіх ізомерів α-амінопентанової кислоти, назвіть їх.
Задача
На нейтралізацію 25 г амінокислоти витратили 45 г 25%-го розчину натрій гідроксиду. Яка формула амінокислоти? (NH2СH2СH2COOH).
3. ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф, виконати вправи.
ТЕМА 5. НІТРОГЕНОВМІСНІ СПОЛУКИ
Заняття № 20
Дисципліна: «Хімія»
Тема заняття: Білки як високомолекулярні сполуки. Рівні структурної організації білків. Властивості білків Мета заняття:
навчальна – розширити і поглибити знання студентів про органічні полімери на прикладі білків, з’ясувати особливості будови білків, їх властивості, ознайомити студентів з характерними реакціями білків, показати взаємозв’язок будови, властивостей та функцій білків, сформувати поняття
«денатурація», «ренатурація»;
розвиваюча – розвивати вміння складати рівняння хімічної реакції
гідролізу білків, розвивати логічне мислення, здатність порівнювати, робити висновки;
виховна – виховувати відповідальне ставлення до свого здоров’я
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: моделі «Структури білків»
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань
Письмова робота (додаток 1).
Письмові завдання біля дошки:
Написати формули: 3-амінопентанової кислоти, 4-аміногексанової кислоти.
• 2-аміно-4,4-етилгексанової кислоти
• β-амінопентанової кислоти
• α-аміно–5-метилгептанової кислоти
Яка з них трапляється в живому організмі?
Закінчити рівняння:
• Амінооцтова кислота + калій оксид =
• Амінооцтова кислота + кальцій карбонат =
• Амінооцтова кислота+літій гідроксид =
• Амінооцтова кислота + метанол =
• Поліконденсація двох амінокислот
Усне опитування:
1. Дайте визначення амінокислотам.
2. З яких функціональних груп вони складаються?
3. Як це впливає на їх властивості?
4. Чому реакції між амінокислотами можливі, а між іншими кислотами
ні?
5. Як називається зв'язок між амінокислотами? Яка група атомів його
утворює?
ІІІ Мотивація навчальної діяльності
Коли дослідники потрапляють на невідому планету і хочуть з’ясувати, чи є на ній життя, вони насамперед перевіряють, чи є на планеті білки. Як вигадаєте, чому?
Виявляється, саме поява білків призвела до появи життя на землі. Про ці речовини ми сьогодні детально поговоримо.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
3. Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
«Життя – це форма існування білкових молекул»
Ф. Енгельс.
Білки ще називають протеїнами, від грец. «протос» – первинний. На білки припадає 50% сухої маси клітини. Білків найбільше міститься в м’язах, вони виконують роль ферментів, гормонів, утворюють слизові оболонки внутрішніх органів, утворюють клітинну оболонку, а також рогові покриви (пір’я, волосся, нігті).
Білки (поліпептиди) – біологічні полімери, що складаються з α – амінокислот сполучених пептидними зв’язками.
Молекулярна маса білків – від кількох тисяч до кількох мільйонів.
Наприклад, інсулін має масу 5700 (складається з 51 амінокислоти), гемоглобін – 68000.
В живих організмах налічується до 5 млн. білків. Кожен з них виконує лише йому властиву функцію. Але всі вони побудовані лише з 20 α – амінокислот. Як таке можливе?
Зміна хоча б однієї амінокислоти у поліпептиді призводить до зміни структури, а, отже, і функцій білка.
Оскільки білки складаються з великої кількості амінокислот, їхня просторова будова досить складна, в ній виокремлюють чотири рівні.
|
Структура |
Просторова будова |
Назва, приклади |
Типи зв’язків |
|
Первинна |
А-А-А-А-А-А- |
Поліпептидний ланцюг |
Пептидні |
|
Вторинна |
|
Спіраль (кератин волосся, нігтів) |
Водневі |
|
Третинна |
|
Глобула (ферменти, гормони) |
Йонні, дисульфідні, водневі, гідрофобні |
|
Четвертинна |
|
Кілька глобул (гемоглобін – 2 по 141 і 2 по146 амінокислот) |
Йонні, дисульфідні, водневі |
Хімічні властивості білків:
1. Гідроліз (відбувається під впливом ферментів або кислот, які руйнують пептидні зв’язки, в такій послідовності: білок – поліпептид – дипептид – амінокислота)
NH2–CH2–CONH–CH2–COOH + HOH = NH2–CH2–COOH + NH2–CH2–COOH
2. Денатурація – руйнування ІІ, ІІІ, IV структури білка, що веде до втрати його функцій. Можливий зворотній процес – ренатурація – відновлення структури білка.
Денатурацію спричиняють:
Ø Температура;
Ø сильні кислоти, луги;
Ø солі важких металів (свинець, ртуть, цинк, мідь);
Ø спирт; Ø струшування;
Ø радіація.
3. Кольорові реакції білків (якісні реакції):
a) ксантопротеїнова (для білків, що містять бензольне кільце): білок +
нітратна кислота(конц.) = жовте забарвлення при нагріванні;
b) біуретова (виявляю пептидні зв’язки): білок + луг + купрум (ІІ)
сульфат = фіолетове забарвлення;
c) цистеїнова ( для сульфуровмісних білків): білок + плюмбум ацетат =
чорне забарвлення при кип’ятінні.
4. Білки бувають:
a) Прості (протеїни) – складаються лише з амінокислот;
b) Складні (протеїди) – містять жири (ліпопротеїни), вуглеводи (глікопротеїни), фосфопротеїни.
Багаті на білок такі харчові продукти: сир та молочні продукти, м'ясо, риба, яйця, горіхи, бобові рослини.
Добова норма людини – 90 г білків.
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Бесіда «Чомучки»:
ü Чому, коли ввести в кров людині яєчний білок, вона гине, а коли
з’їдає його – ні?
ü Чому для людини температури тіла +42ºС є смертельною, а для курей – нормальною?
ü Чому хворі на алкоголізм не мають апетиту? Натомість в них часто
розвивається виразка, гастрит. Чому?
ü В Стародавньому Римі були страшні тортури: людину прив’язували
до стовпа, на сонці і годували лише м’ясом, не даючи води. За три дні вона гинула. Чому?
ü Чому денатуровані білки не можуть виконувати свої функції?
Завдання:
a) Скласти рівняння гідролізу дипептиду, утвореного 2-амінобутановою і 2-амінопропановою вислотою
b) Із скількох амінокислот складається білок, що має 5 пептидних
зв’язків?
3. ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф, виконати вправи.
Задача. Масова частка Нітрогену в амінокислоті 18,7%. Визначте формулу амінокислоти. (NH2СH2COOH)
Підготувати
повідомлення про біологічне значення амінокислот та білків, досягнення сучасної
біотехнології.
Додаток 1.
Варіант 1.
1. До нітрогеновмісних речовин належать:
a) білки;
b) вуглеводи;
c) аміни;
d) жири;
e) естери.
2. Амінокислоти містять одночасно такі функціональні групи:
a) –СООН;
b) –ОН;
c) –СОН;
d) –NH2.
3. Найпростішою амінокислотою є:
a) амінооцтова;
b) амінопропанова;
c) амінометанова;
d) амінобутанова.
4. Амінокислоти мають властивості:
a) кислотні;
b) основні;
c) амфотерні.
5. Амінокислоти сполучаються між собою зв’язком:
a) йонним;
b) пептидним;
c) водневим;
d) металічним.
6. При полімеризації амінокислот утворюється:
a) білок;
b) крохмаль;
c) жир;
d) поліетилен.
7. Як кислоти амінокислоти реагують з …
8. Як основи амінокислоти взаємодіють з …
9. Назвати амінокислоту: СН3–СH(СН3)–СH(NH2)–COOH.
10.
Написати формулу амінокислоти: 3–аміно–2–етилбутанова кислота.
Варіант 2.
1. Амінокислотою з найбільшою молекулярною масою є:
a) амінооцтова;
b) амінопропанова;
c) амінопентанова;
d) амінобутанова.
2. До нітрогеновмісних речовин належать:
a) естери;
b) білки;
c) аміни;
d) жири;
e) вуглеводи.
3. Властивості амінокислот визначаються наявністю в них:
a) гідроксильної групи;
b) аміногрупи;
c) карбоксильної групи;
d) карбонільної групи.
4. Амінокислоти сполучаються між собою зв’язком:
a) металічним;
b) водневим;
c) пептидним;
d) йонним.
5. При полімеризації амінокислот утворюється:
a) поліпептид;
b) крохмаль;
c) жири;
d) поліетилен.
6. Якісною реакцією на амінокислоти є:
a) реакція «срібного дзеркала»;
b) взаємодія з купрум (ІІ) гідроксидом;
c) бромування;
d) реакція з йодом.
7. Загальна формула амінокислот…
8. Ізомерія амінокислот буває …
9. Назвати амінокислоту: СН2NH2–СH(С2Н5) –СH2–COOH.
10. Написати формулу амінокислоти: 2–аміно–4–метилгексанова кислота.
ТЕМА 6. СИНТЕТИЧНІ ВИСОКОМОЛЕКУЛЯРНІ РЕЧОВИНИ І
ПОЛІМЕРНІ МАТЕРІАЛИ НА ЇХ ОСНОВІ
Заняття № 21
Дисципліна: «Хімія»
Тема заняття: Залежність властивостей полімерів від їхньої будови. Термопластичні і термореактивні полімери. Поліетилен, поліпропілен, полівінілхлорид Мета заняття:
навчальна – продовжувати формувати у студентів уявлення про полімери на прикладі синтетичних сполук, ознайомити із складом і застосуванням полімерних матеріалів, їх класифікацією, розширити знання про реакції полімеризації і поліконденсації, ознайомити студентів із складом та будовою деяких полімерних матеріалів, властивостями термопластичних і термореактивних полімерів;
розвиваюча – розвивати вміння порівнювати, систематизувати; виховна – виховувати самостійність
Тип заняття: вивчення новго матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: моделі «Структури білків», інструкція з ОП для
лабораторної роботи, ПК, віртуальна хімічна лабораторія
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с.
9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань Бесіда:
1. Що таке полімери? Які полімери ви знаєте?
2. Що спільного у будові полімерів?
3. Як називається реакція їх утворення?
4. Як називається елементарна частинка полімерів?
5. Які вам відомі синтетичні полімери?
ІІІ Мотивація навчальної діяльності
Уявіть ситуацію: вчені не відкрили реакцію полімеризації і до цього часу не винайшли полімери. Що б змінилося у нашому житті?
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
3. Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Високомолекулярні сполуки (ВМС) – це сполуки з великою відносною молекулярною масою (від тис – до млн.), що складаються з великої кількості однакових мономерних ланок, сполучених між собою.
Природними ВМС є білки, нуклеїнові кислоти, полісахариди. Однак значне місце займають синтетичні ВМС добуті людиною. До них належить поліетилен, поліпропілен та ін.. Саме вони стали основою сучасних полімерних матеріалів.
Будова полімерів: nСН=СН2 → –(СН–СН2–)n – n – ступінь полімеризації
![]() СН3
СН3 ![]()
мономер полімер елементарна (мономерна) ланка Відносна молекулярна маса полімеру обчислюється так:
Мг(полімеру)= n * Мг(мономеру)
Яка відносна молекулярна маса поліпропілену, якщо ступінь полімеризації 2000?
Класифікація полімерів:
ü лінійні (целюлоза, поліетилен);
ü розгалужені (амілопектин);
ü сітчасті (фенолоформальдегідні смоли).
Полімери у твердому стані можуть мати на одних ділянках впорядковане розміщення, а на інших безладне, тому їх характеристикою є ступінь кристалічності – частка речовини з впорядкованим розміщенням макромолекул
(90% - кристалічна будова, 10% аморфна)
Властивості полімерів
Як ви гадаєте, як впливає будова на властивості полімерів?
Властивості полімерів визначаються масою, довжиною, типом будови.
Деякі з полімерів після нагрівання і охолодження не зазнають перетворень і зберігають свої властивості, їх називають термопластичними (поліетилен, поліпропілен).
Термореактивні після нагрівання втрачають пластичність і розчинність в органічних розчинниках, тому що їхня структура змінюється
(фенолоформальдегідні смоли).
Спробуйте передбачити хімічні властивості полімерів
Полімери розкладаються на мономери, реагують з сильними окисниками, концентрованими розчинами кислот і лугів. Виняток - поліетилен, поліпропілен.
Чому?
Добування полімерів
Полімеризація – сполучення великої кількості однакових молекул (мономерів) у полімерний ланцюг.
![]() Поліконденсація –
реакція утворення полімеру, під час якої відщеплюється молекула води чи ін..
Поліконденсація –
реакція утворення полімеру, під час якої відщеплюється молекула води чи ін..
Співполімеризація – реакція утворення полімеру з мономерів двох видів
(фенолоформальдегідні смоли).
Найпоширенішими полімерами є: поліетилен – nСН2=СН2 → (–СН2–СН2–)n – (плівка, тара, ізоляція, труби);
поліпропілен – СН=СН2 + СН=СН2 → –СН–СН2–СН–СН2 – (труби, іграшки,
![]()
СН3 СН3 СН3 СН3
деталі апаратури, волокна, має високу твердість, стійкий до тертя);
![]() полівінілхлорид – СН=СН2
+ СН=СН2 → – СН – СН2 – СН – СН2 –
штучна
полівінілхлорид – СН=СН2
+ СН=СН2 → – СН – СН2 – СН – СН2 –
штучна
![]()
Сl Сl Сl Сl
шкіра, лінолеум, гумові чоботи, рукавички, труби.
політетрафторетилен (тефлон): (–СF2 – CF2–)n – покриття посуду.
Для цих полімерів спільними властивостями є: стійкість до кислот, лугів, хороші ізоляційні властивості, термопластичність, морозостійкість. Однак вони не витримують нагрівання (1000), горять, при цьому розкладаючись.
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Бесіда:
1) Які речовини можуть полімеризуватися?
2) Який полімер: поліетилен чи полівінілхлорид є більш небезпечним?
3) Чим відрізняється мономер і мономерна ланка поліпропілену?
4) Які з сполук можуть вступати в реакцію полімеризації, а які – в
реакцію поліконденсації: пропен, аміноетанова кислота, дибромоетен?
Задача.
Молекула мономера складається з двох атомів Карбону і атомів двох галогенів. Масова частка Карбону 20,6%, а Хлору 30,47%. Визначте формулу мономера. Складіть рівняння його полімеризації. (С2ClF3).
3. ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф, виконати вправи.
Задача.
Середня молекулярна маса зразка поліпропілену 21000. Який ступінь полімеризації полімеру? (500)
ТЕМА 6. РОЛЬ ХІМІЇ В ЖИТТІ СУСПІЛЬСТВА
Заняття № 22
Дисципліна: «Хімія»
Тема заняття: Роль хімії у розв’язанні продовольчої та екологічної проблеми. Найважливіші хімічні виробництва в Україні Мета заняття:
навчальна – показати студентів значення хімії у виготовлення сучасних матеріалів, ознайомити з перспективами біотехнології та нанотехнології, з’ясувати роль хімії у вирішенні сировинної, енергетичної проблем, на основі міжпредметних зв’язків з економікою розглянути особливості розвитку хімічної промисловості в Україні;
розвиваюча – розвивати креативне мислення, вміння самостійного пошуку інформації;
виховна – виховувати самостійність, розширювати науковий світогляд студентів.
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: карта України, колекція «Матеріали»
Література: 11. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань
ІІІ Мотивація навчальної діяльності
Чи відомо вам, що в Україні щорічно утворюється понад 35 мільйонів тонн тільки твердих побутових відходів (ТПВ ), що на 20 – 40% складаються з паперу, 4 – 5% – текстилю, 2 – 5% – металобрухту, 2 – 3% – деревини, 1 – 5%
– полімерних матеріалів, а також харчових та інших відходів.
Час розкладання цього сміття в ґрунті вражає:
ü папір – 3 місяці;
ü газета – 1 рік;
ü сигаретний фільтр – 2 роки;
ü жувальна гумка – 5 років;
ü консервна банка – від 10 до 100 років;
ü підгузки – 500 років;
ü пластикові картки (телефонні, банківські) – 1 000 років;
ü скло – 4 000 років;
ü пластикові відходи розкладаються 300 – 500 років.
Сьогодні ми розглянемо, як людство може вирішити цю, а також інші проблеми, з якими стикнулося під час свого прогресивного розвитку.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
3. Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Повідомлення студентів на тему:
1. Роль хімії у розв’язанні екологічної проблеми.
2. Роль хімії у розв’язанні продовольчої проблеми.
3. Найважливіші хімічні виробництва в Україні.
Основні галузі хімічної промисловості в Україні
Гірнича хімія – займається видобутком природної хімічної сировини:
калійні солі (Калуш, Стебник), кухонні солі (Слов'янськ, Артемівськ, Солотвине, Сиваш), сірка (Яворів, Новий Розділ), фосфорити (Середнє Придністров'я), озокерит (Борислав). Тому можна виділити три райони гірничої хімії: Донбас,
Основна хімія – виробляє кислоти, мінеральні добрива, соду та інше:
ü калійні добрива – виробництво тяжіє до сировини (Калуш, Стебник);
ü азотні – виробництво тяжіє до коксохімічних і металургійних
підприємств, газопроводів. Центри: Сєвєродонецьк, Горлівка, Дніпродзержинськ, Черкаси, Рівне;
ü фосфатні – виробництво тяжіє до споживача. Центри: Вінниця, Суми,
ü сода – виробництво тяжіє до сировини (до кухонної солі) (Донбас, Крим);
ü сірчана кислота – сировиною є сірка Прикарпаття та сірчисті гази металургійних підприємств. Центри: Суми, Вінниця, Сєвєродонецьк, Одеса,
Горлівка.
Хімія органічного синтезу – розвивається на основі переробки нафти, газу, вугілля. Орієнтується на сировину, електроенергію, воду: пластмаси (Донецьк,
Запоріжжя, Сєвєродонецьк, Луцьк), хімічні волокна (Київ, Черкаси, Чернігів), лаки і фарби (Київ, Львів, Одеса, Харків, Чернівці, Дніпропетровськ). Фармацевтична (ліки) і мікробіологічна (вітаміни, добавки) промисловість орієнтуються на споживача, розміщена у таких містах: Київ, Харків, Горлівка, Одеса, Львів. Хімволокно виробляють у Києві, Сєвєродонецьк, Черкасах,
Житомирі. Виробництво кінофотоплівки зосереджено у Шостці.
Продукція хімічної промисловості України:
ü отрутохімікати для сільського господарства.
Більшість підприємств хімічної промисловості зосереджено у трьох районах: Придніпров'ї, Донбасі, Прикарпатті, тому ці райони найбільше екологічно забруднені. Тут необхідне впровадження нових безвідходних технологій, широкий розвиток ефективних очисних споруд тощо.
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
«Мікрофон»
ü Спробуйте передбачити з якими екологічними проблемами
стикаються мешканці регіонів, де найбільш розвинена хімічна промисловість.
ü Які загрози для здоров’я людини становлять дані галузі промисловості?
ü Як зменшити шкоду хімічних виробництв для довкілля та населення?
ü Як можна вирішити проблему побутових відходів?
Чи знаєте ви, що:
ü 1 т. макулатури зберігає від вирубування 17 дерев;
ü 1 т. пластику економить 750 кілограм нафти
Чи можлива ситуація повного переходу людства на синтетичні продукти харчування? А на екологічно чисті харчові продукти?
Задача
На території України та інших європейських країн є підприємства, що забруднюють атмосферу сполуками Сульфуру. Яку масу сульфатної кислоти можна добути, якщо викиди (в перерахунку на Сульфур) становлять: Україна, Росія – 171 тис. тонн, Чехія, Словаччина – 22 тис. тонн, Польша – 68 тис. тонн?
Втрати при виробництві кислоти – 20%.
3. ДОМАШНЄ ЗАВДАННЯ
Вивчити параграф, виконати вправи.
Підготувати повідомлення на теми:
1. Шкідливий вплив вживання алкоголю на здоров’я людини.
2. Наркотичні препарати – біла смерть.
3. Вплив тютюнопаління на організм людини.
4. Роль хімії у розв’язанні проблеми ВІЛ/СНІДу.
ТЕМА 6. РОЛЬ ХІМІЇ В ЖИТТІ СУСПІЛЬСТВА
Заняття № 23
Дисципліна: «Хімія»
Тема заняття: Хімія і здоров’я людини. Шкідливий вплив вживання алкоголю, наркотичних речовин, куріння на здоров’я людини. Роль хімії у розв’язанні проблеми ВІЛ/СНІДу та інших захворювань.
Мета заняття:
навчальна – продовжувати формувати знання студентів про прикладне значення хімії, її позитивний та негативний вплив на життя та здоров’я людини, показати значення хімії у медицині та фармакології, ознайомити студентів з основними
досягненнями хімії у медицині;
розвиваюча – розвивати критичне мислення, вміння порівнювати, робити висновки, узагальнення; виховна – сприяти формуванню здорового способу життя і негативного ставлення до шкідливих звичок
Тип заняття: вивчення нового матеріалу
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: зразки етикеток харчових продуктів, побутових хімічних речовин
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с.
9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ
І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань
Усне опитування
1. Проілюструйте значення хімії у:
ü створенні нових матеріалів;
ü вирішення енергетичної проблеми;
ü продовольчої проблеми; ü екологічної проблеми.
2. Які негативні сторони надмірного хімічного виробництва?
3. Що, на вашу думку, потрібно зробити, щоб «пластикова ера» не
переросла у «еру сміттєзвалищ»?
ІІІ Мотивація навчальної діяльності
Ми з вами закінчуємо вивчення хімії і давайте задумаємося, для чого ми її вивчали? Одне з основних завдань – вміти застосовувати знання з хімії в повсякденному житті, тобто, аналізувати те, чим ми харчуємося, з якими небезпечними хімічними речовинами стикаємося, якими препаратами лікуємося.
Сьогодні ми спробуємо це зробити.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Закріплення вивченого матеріалу.
3. Домашнє завдання.
ХІД ЗАНЯТТЯ
1. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Уникнути впливу хімічних речовин неможливо. Ми щосекунди з ними стикаємося, значна частина з них є безпечними для нас (кисень, вода, сіль), однак чимало мають негативний вплив.
Щоб визначити небезпеку речовини для здоров’я людини і довкілля, хімічна речовина класифікується і спеціально маркується виробником.
Особливу небезпеку становлять хімічні речовини, які залежно від їх практичного використання можна поділити на:
ü промислові отрути, які використовуються у виробництві
(розчинників, барвників), є джерелом небезпеки гострих і хронічних інтоксикацій (ртуть, свинець, ароматичні сполуки тощо);
ü отрутохімікати, що використовуються у сільському господарстві
для боротьби з бур'янами та гризунами (гербіциди, пестициди);
ü лікарські препарати;
ü хімічні речовини побуту (харчові добавки, засоби санітарії та гігієни,
косметичні засоби);
ü хімічна зброя.
Залежно від характеру дії на організм людини хімічні речовини поділяються на:
Токсичні речовини – це речовини, які викликають отруєння усього організму людини або впливають на окремі системи людського організму (кровотворну, центральну нервову) . Ці речовини викликають патологічні зміни певних органів, наприклад, нирок, печінки (чадний газ, селітра, розчини кислот чи лугів).
Подразнюючі речовини викликають подразнення слизових оболонок, дихальних, шляхів, очей, легень, шкіри (пари кислот, лугів, амоніак).
Мутагенні речовини призводять до порушення генетичного коду, зміни спадкової інформації (свинець, радіоактивні речовини тощо).
Канцерогенні речовини викликають, як правило, злоякісні новоутворення - пухлини (ароматичні вуглеводні, циклічні аміни, азбест, нікель, хром)
Наркотичні речовини впливають на центральну нервову систему (спирти, ароматичні вуглеводні)
Задушливі речовини призводять до токсичного набряку легень (оксиди Карбону, оксиди Нітрогену)
Прикладом речовин, що впливають на репродуктивну функцію, можуть бути: радіоактивні ізотопи, ртуть, свинець
Сенсибілізатори – це речовини, що діють як алергени (розчинники, формалін, лаки на основі нітро- та нітрозосполук тощо)
Отруйними називаються речовини, які призводять до ураження всіх живих організмів, особливо людей та тварин
Шляхи проникнення отруйних речовин в організм людини: через шкіру, органи дихання та шлунок.
Ступінь ураження отруйними речовинами залежить від їх токсичності, вибірковості дії, тривалості, а також від їх фізико-хімічних властивостей
За вибірковістю дії шкідливі речовини можна поділити на:
ü серцеві – кардіотоксична дія: ліки, рослинні отрути, солі кобальту;
ü нервові – порушення психічної активності (чадний газ,
фосфорорганічні сполуки, наркотичні засоби, снотворні ліки);
ü печінкові – хлоровані вуглеводні, альдегіди, феноли;
ü ниркові – сполуки важких металів, етиленгліколі, щавлева кислота;
ü кров'яні – анілін, нітрити;
ü легеневі – оксиди Нітрогену, озон, фосген.
За тривалістю дії шкідливі речовини ділять на три групи:
ü летальні, що призводять до смерті (5% випадків) – термін дії до 10
діб;
ü тимчасові, що призводять до нудоти, блювоти, набряку легенів,
болю у грудях – термін дії від 2 до 5 діб;
ü короткочасні – тривалість декілька годин (подразнення у носі,
ротовій порожнині, головний біль, задуха, загальна слабкість).
Для послаблення впливу шкідливих речовин на організм людини, для визначення ступеня забрудненості довкілля та впливу на організм користуються такими поняттями, як гранично допустима концентрація (ГДК) шкідливих речовин та ін.
Поки існують шкідливі види антропогенної діяльності, щоб обмежити їх вплив на природне середовище, потрібно нормувати кількість шкідливих речовин, які викидаються в повітря, ґрунти, води, постійно контролювати викиди об'єктів, прогнозуючи стан довкілля та приймаючи відповідні санкції щодо порушників законів про охорону природи
Повідомлення студентів:
1. Шкідливий вплив вживання алкоголю на здоров’я людини.
2. Наркотичні препарати – біла смерть.
3. Вплив тютюнопаління на організм людини.
4. Роль хімії у розв’язанні проблеми ВІЛ/СНІДу.
2. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Інтерактивна вправа «Мозковий штурм»
Які ваші пропозиції щодо того, як зменшити або взагалі ліквідувати негативний вплив хімічних речовин на організм людини (на локальному і глобальному рівнях)?
Задача.
Чутливість людини до токсичної дії алкоголю залежить від віку. Для дітей смертельною є доза близько 3 г алкоголю на 1 кг маси тіла, для підлітків – 4 – 5 г/кг. На думку вчених, людині, яка вживає понад 180 г. алкоголю на добу, загрожує цироз печінки. У печінці етиловий спирт під впливом ферментів піддається перетворенню. Одним із проміжних продуктів є етаналь (оцтовий альдегід).
Складіть рівняння окиснення етанолу до етаналю й обчисліть масу альдегіду, якщо окиснилося 184 г. спирту. (176 г.).
3. ДОМАШНЄ ЗАВДАННЯ
Вивчити конспект.
Підготувати повідомлення на тему:
1. Засоби побутової хімії: склад, застосування, небезпека.
2. Хімія харчування: природні і синтетичні складові їжі.


про публікацію авторської розробки
Додати розробку