Перегонка як метод розділення рідких сумішей
КУРСОВА РОБОТА
Тема роботи: Перегонка як метод розділення рідких сумішей
Харків – 2020
РЕФЕРАТ
Курсова робота: 33 с., рис. - 8, 10 літературних джерел.
Об’єкт дослідження – перегонка.
Мета роботи – провести аналіз літературних джерел із вказаної теми.
В даній роботі проведений аналіз теоретичного матеріалу, щодо становлення і досягнення найважливішої області фізичної хімії – хімії методів розділення сумішей. Розглянута загальна характеристика і фізико-хімічні параметри перегонки, закони Рауля, закони Коновалова та закони Вревського та їх застосування в науці та виробництві.
ПЕРЕГОНКА, ЗАКОНИ РАУЛЯ, ЗАКОНИ КОНОВАЛОВА, ЗАКОНИ ВРЕВСЬКОГО, РЕКТИФІКАЦІЯ, БІНАРНА СУМІШ, АЗЕОТРОПИ
ЗМІСТ
ВСТУП 3
1 ФІЗИКО-ХІМІЧНІ ОСНОВИ ПРОЦЕСУ ПЕРЕГОНКИ 4
1.1 Загальна характеристика процесу перегонки 4
1.2 Ректифікація 13
2 ЗАКОНИ РАУЛЯ 17
3 ЗАКОНИ КОНОВАЛОВА 24
4 ЗАКОНИ ВРЕВСЬКОГО 26
4.1 Формулювання законів Вревського 26
4.2 Застосування перегонки 28
ВИСНОВКИ 32
ПЕРЕЛІК ПОСИЛАНЬ 33
ВСТУП
У процесах хімічної технології багато процесів складається з компонентів з необмеженою та обмеженою взаємною розчинністю, а також взаємно нерозчинних. Одним із найбільш розповсюджених методів розділення рідких сумішей, які складаються з двох або більшого числа компонентів, є перегонка.
В широкому сенсі перегонка – це процес, який включає часткове випарування суміші, яка розділяється, та подальшу конденсацію утворюваної пари. В результаті конденсації пари отримують рідину, склад якої відрізняється від складу похідної суміші.
Компоненти рідких сумішей, за деяким винятком, мають при однаковому зовнішньому тиску різні температури кипіння, а при однаковій температурі вони киплять при різному зовнішньому тиску. Очевидно, найбільш низькою температурою кипіння (низькокиплячий легколеткий компонент).
Проста перегонка – це процес одноразового випарування рідкої суміші і конденсації утворюваної пари, але великого ступеня розділу цим способом досягти неможливо.
Для розділення суміші на індивідуальні компоненти проводять багаторазове чергування процесів випарування і конденсації, використовуючи при цьому кожного разу теплоту конденсації пари для випарування відповідної кількості рідини. Цей процес називається ректифікацією.
Метою даної курсової роботи є літературний огляд перегонки, описання її фізико-хімічних параметрів та застосування в науці та виробництві.
1 ФІЗИКО-ХІМІЧНІ ОСНОВИ ПРОЦЕСУ ПЕРЕГОНКИ
1.1 Загальна характеристика процесу перегонки
Дистиляція, перегонка — процес розділення твердих або рідких речовин (чи їхньої суміші) на складові частини (компоненти) шляхом випаровування з наступною конденсацією без доступу повітря. Процес дистиляції заснований на різній здатності речовин переходити в пароподібний стан у залежності від температури і тиску.
Дистиляція була відома вже давнім єгиптянам. Вони таким чином виготовляли кедрову олію, необхідну для бальзамування небіжчиків. Про досліди з випаровуванням та конденсацією води згадував і Арістотель. Але перше повідомлення про існування якогось приладу для дистиляції відноситься лише до 4 сторіччя. Його згадує алхімік Зосіма, який жив в цей час в Александрії і за походженням був чи то єгиптянином, чи то єгипетським греком, а може й євреєм — бо напрочуд добре орієнтувався в юдейській символіці. Зосіма стверджував, що просто перемалював зображення приладу, знайдене ним на стіні одного з старовинних храмів. Втім, цілком можливо, що таким чином він намагався додати авторитетності своєму повідомленню — бо жодних давньоєгипетських малюнків чогось, що хоча б віддалено нагадувало перегінний куб, до нашого часу не збереглося.
Хімію і медицину на тогочасному Близькому Сході вивчали не лише в Єгипті, а й в Сирії. А згодом, коли офіційна православна церква звинуватила сирійських вчених в єресі, вони знайшли прихисток в сусідній Персії. Тож чимало істориків впевнені, що про принцип дії перегінного куба став відомий і там. За доби Арабського халіфату, який об'єднав під своєю владою і Єгипет, і Сирію, і Персію, про дистиляцію вже говорили як про щось давно відоме й зрозуміле. Її згадували в своїх працях, зокрема, Джабір ібн Хайян (в Європі відомий як Гебер) і Якуб аль-Кінді (Алькінд). Останній залишив докладний опис перегінного кубу, який з того часу отримав назву аламбік. З його допомогою аль-Кінді отримував ефірні олії, камфору та «трояндову воду».
Перший опис отримання шляхом дистиляції чистого спирту міститься в «Книзі таємниць» Мухаммада ар-Разі (Разеса), який жив на межі IX і X сторіч. Щоправда, він не стверджував, що є винахідником цього процесу. Першим слово алкоголь вжив Гусейн ібн Сіна (Авіценна). Хоча він називав цим словом не спирт, а порошок сурми.
Перший із західноєвропейських рецептів отримання спирту шляхом дистиляції належить одному з засновників медичної школі в італійському місті Салерно — Магістру Салернському і був записаний приблизно в 1150 році. XII сторіччям можна датувати також рецепт виготовлення спирту й у збірці «Маппе Клавікула», вочевидь складеної в Єгипті грецькою мовою. Збереглося кілька списків цієї збірки, проте в найдавніших з них рецепту виготовлення спирту немає, а той рецепт, який зберігся, використовувався при обробці тканин.
В ході дистиляції рідину нагрівають у колбі (перегінному кубі) до температури кипіння, пару пропускають через холодильник, де вона збирається, утворюючи очищений від домішок дистилят (наприклад, дистильована вода). Дробова дистиляція слугує для розділення рідин, що киплять при різній температурі. У міру підвищення температури кипіння суміші змінюють приймач і отримують ряд фракцій дистилляту (рис. 1.1). Повторну дистиляцію для більш досконалого очищення називають ректифікацією [2].
Шляхом дистиляції неможливо розділити азеотропні суміші рідин, тобто суміші рідин, що киплять при певному зовнішньому тиску при постійній температурі без зміни складу. Прикладом такої суміші є 96 % водний розчин етилового спирту, який кипить за температури 78,17 °C.
Дистиляцію у вакуумі при зниженій температурі застосовують для одержання речовин, що розкладаються при високій температурі (наприклад, молочної кислоти). Дистиляцію з водяною парою використовують для відділення речовин, летких разом з водяною парою, від нелетких (виділення ефірних олій).
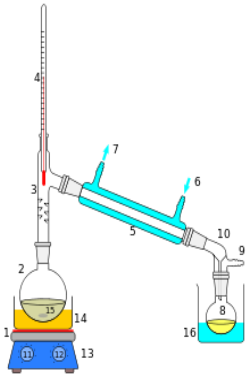
Рис. 1. 1 – Лабораторна перегонна установка:
1 - Нагрівальний елемент;
2 - Перегонний резервуар;
3 - Перегонна трубка (цільнопаяний дефлегматор з насадкою Вюрца);
4 - Термометр;
5 - Конденсатор (прямий (холодильник Лібіха);
6 - Подача холодної води;
7 - Відвід холодної води;
8 - Резервуар для дистиляту (прийомник);
9 - Газовідвідна трубка;
10 - Алонж;
11 - Регулятор температури;
12 - Регулятор швидкості перемішування;
13 - Нагрівальна установка;
14 - Нагрівальна баня;
15 - Магнітний або механічний перемішував;
16 - Охолоджувальна баня.
Проста перегонка може бути використана в тому випадку, коли температури кипіння компонентів значно відрізняються, а також не потрібно високої чистоти отриманих фракцій. Крім того, проста перегонка використовується для відділення от рідини нелетких домішок, а також для грубого розділення рідких сумішей, наприклад, нафти або кам’яновугільної смоли.
Просту перегонку проводять при атмосферному тиску або під вакуумом. При зниженні тиску знижується температура кипіння розчинів. Цю властивість дуже часто використовують при розділенні сумішей нестійких сполук, які легко розкладаються, проводячи процес перегонки при зниженому тиску. В цьому випадку для обігріву куба використовується пара більш низьких параметрів. Для створення вакууму у перегінному апараті до приймачів дистиляту через спеціальні уловлювачі, підключають вакуумнасос.
Просту перегонку можна проводити при атмосферному тиску або під вакуумом (для зниження температури перегонки). Для одержання потрібних фракцій (або різного складу дистиляту) застосовують фракційну або дробову перегонку.
Вихідну суміш завантажують в куб, що має змійовик для нагрівання і кип’ятіння цієї суміші. Пари, що утворюються, конденсуються в теплообміннику-конденсаторі, дистилят в ньому ж охолоджується до заданої температури і поступає в одну із збірок. Після закінчення процесу перегонки залишок зливають з куба і знов завантажують в нього вихідну суміш.
При простій перегонці пара, що утворюється, відводиться з апарата і в кожен даний момент часу знаходиться в рівновазі з рідиною, що залишилася (що приймається при аналізі цього процесу).
Основними термінами і визначеннями є наступні: низькокиплячий компонент – НКК, висококиплячий компонент – ВКК, рідина отримана в результаті конденсації парів – дистилят або ректифікат.
Існує два види перегонки: проста перегонка (дистиляція) та ректифікація. У простому випадку вихідна суміш складається з двох компонентів. Така суміш називається бінарною [1].
Залежно від взаємної розчинності компонентів бінарні суміші можна розділити на групи:
- суміші з необмеженою розчинністю компонентів;
- суміші з взаємно нерозчинними компонентами;
- суміші з частковою розчинністю компонентів один в одному;
Як відомо, під час кипіння суміші вміст більш летючого компонента в парі, а отже, й у дистиляті, що утворюється під час конденсації пари, більший, ніж у рідині. Завдяки цьому в кубі поступово збільшується відносний вміст менш леткого компонента.
Склад рідини в перегінному апараті після випаровування деякої її частини і склад дистиляту, що утворюється. можна визначити з матеріального балансу простої перегонки.
Склад бінарного розчину звичайно виражається багатьма способами, але найбільш зручно в практичних розрахунках користуватися мольною та масовою концентрацією компонентів у складі суміші. Мольну частку компонента А в рідкій фазі звичайно прийнято позначати через Ха, мольну частку цього ж компонента в паровій фазі позначають через Уа.
Мольна частка компонента в суміші показує, яка частина даного компонента, що виражена через його мольну масу, належить саме цьому компоненту, при цьому для багатокомпонентного розчину:
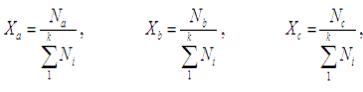 (1.1)
(1.1)
де Ха, Хb, Хс - мольна частка компонентів А, В, С відповідно, які перебувають у складі розчину;
Na, Nb, Nс - число молів компонентів А, В, С, які перебувають у складі розчину;
k - число компонентів, з яких утворений розчин.
Масова частка компонента у складі розчину показує, яка частина загальної маси суміші належить даному компоненту, при цьому:
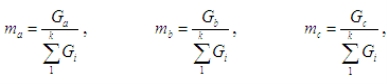 (1.2)
(1.2)
де ma, mb, mс - масова частка компонентів А, В, С відповідно, що перебувають у складі розчину;
Ga, Gb, Gс - маса компонентів А, В, С відповідно, що перебувають у складі всієї суміші, яка складається з k компонентів.
У подальших розрахунках масову частку окремих (індивідуальних) компонентів у складі маси всієї суміші будемо позначати через хi і уi для рідкої або парової фази відповідно.
Між масою компонента і його мольною часткою в складі всієї суміші існує певний зв'язок. Так, число молів окремого певного компонента пов'язане з його масою залежностями [1]:
 (1.3)
(1.3)
де Ма, Мi - молекулярна маса окремого компонента суміші відповідно.
Загальне число молів у складі багатокомпонентної суміші дорівнює:
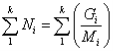 . (1.4)
. (1.4)
На основі рівнянь (1.3) і (1.4) мольна частка індивідуального компонента в суміші пов'язана з масою й молекулярною масою часток індивідуальних компонентів залежностями:
 (1.5)
(1.5)
Масові частки компонентів у розчині пов'язані з мольними частками співвідношеннями:
 (1.6)
(1.6)
Для бінарних сумішей концентрація одного компонента в суміші повністю визначає вміст іншого компонента, тому що ma + mb = 1 і відповідно mb = 1 - ma, тоді рівняння (1.5) і (1.6) записують у спрощеному вигляді, при цьому масова частка компонента А становить:
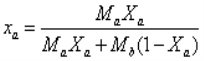 , (1.7)
, (1.7)
відповідно мольна частка цього компонента в суміші дорівнює:
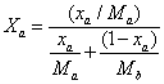 . (1.8)
. (1.8)
Відносною летючістю компонентів називають відношення пружності пари НКК (ЛЛК) до пружності пари ВКК (ВЛК) при однаковій температурі, при цьому αл = РА/РВ. Для розділюваних методами дистиляції розчинів чим більший коефіцієнт відносної летючості пари компонента, тим легше розділяється суміш [3].
Температуру кипіння індивідуальних речовин звичайно визначають за експериментальним даними з урахуванням тиску над рідиною.
Звичайно рідина закипає, коли пружність її насиченої пари відповідає загальному тиску. Температуру кипіння рідин при атмосферному тиску знаходять за таблицями або графіками, але також існують наближені формули для розрахунків температури кипіння.
Густину пари індивідуальних компонентів визначають на основі рівняння Клапейрона - Менделєєва, вважаючи, що пара речовини є складовою газової фази, і отже має такіж властивості, що підкоряються законам ідеального газу:
![]() , (1.9)
, (1.9)
де ρо, ρ - густина пари речовини при нормальних і робочих умовах відповідно;
М - мольна маса речовини, кг/кмоль;
Т0, Т - температура пари при нормальних і робочих умовах відповідно, К;
Р0, Р - тиск пари при нормальних і робочих умовах відповідно, Р0 = 760 мм рт. ст. = 1,013·105 Па = 0,1013 МПа.
Густину суміші пари різних речовин з достатньою точністю визначають відповідно з правилом адитивності, при цьому:
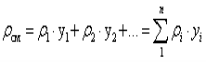 , (1.10)
, (1.10)
де у1, уi - мольні (об'ємні) частки компонентів парової суміші;
r1, ri - густина компонентів суміші відповідно при робочих умовах.
В'язкість пари індивідуальних речовин знаходять за експериментальним даними, що представлені у таблицях, або визначають за допомогою номограм.
Зміну динамічної в'язкості газів (пари) залежно від температури найчастіше враховують формулою Сатерлэнда:
![]() , (1.11)
, (1.11)
де m о - в'язкість пари речовини при нормальних умовах (0 0С і Р = 760 мм рт. ст.);
C - постійна Сатерлэнда, що враховує індивідуальні властивості пари речовини.
1.2 Ректифікація
Використання процесів багаторазової дистиляції є енергетично невигідним і не дозволяє розділити навіть бінарні розчини на практично чисті індивідуальні компоненти. Більш сучасним у багатьох відношеннях (у технологічному, апаратурному, енергетичному та ін.) є метод багаторазової дистиляції в одному апараті, що одержав назву ректифікації.
Ректифікація, як метод розділення складних розчинів на майже чисті індивідуальні компоненти, базується на процесах часткового випару рідких сумішей різного складу та часткової або повної конденсації пари. Ці процеси багаторазово повторюються на контактних пристроях шляхом протитечійного і багаторазового контактування парової і рідкої фаз нерівноважного складу. У результаті таких багаторазово повторюваних процесів, що відбуваються в колонних апаратах - ректифікаційних колонах, висхідна парова фаза по висоті колони поступово збагачується низькокиплячим компонентом і з верхньої частини колони відвояться майже чиста пара НКК. З іншого боку, рідка фаза, що стікає по колоні зверху вниз, збагачується висококиплячим компонентом і знизу ректифікаційної колони виводиться практично чистий ВКК.
Таким чином, фізична сутність процесу ректифікації базується на багаторазовій протитечійній взаємодії парової і рідкої фаз нерівноважних концентрацій, у результаті якої на контактних пристроях відбуваються процеси конденсації і випаровування фаз, а також термодифузійний масообмін речовинами між взаємодіючими фазами.
У нижній кубовій частині колони відбувається процес вилучення (відгону) низькокиплячого компонента в парову фазу з початкової суміші. Цей процес проходить за рахунок тепломасообміну між потоками стікаючої рідини і пари, що утворюється у нижній частині колони при випаровуванні рідини та піднімається вгору. Випаровування частини кубової рідини (ВКК) відбувається у виносному кип'ятильнику - випарнику у результаті подачі в нього гарячого теплоносія. Пари ВКК, що утворилися, подаються під нижню тарілку відгінної частини колони, контактують з рідиною, що стікає зверху, при цьому рідина кипить на тарілці та створює висхідний потік пари ВКК відповідної концентрації при температурі кипіння рідини на тарілці [1].
Отже, ректифікаційна колона являє собою тепломасообміний апарат, у якому по висоті колони знизу вгору на тарілках знижується температура кипіння рідини від максимальної в кубовій частині до мінімальної на верхній тарілці концентраційної колони. Унизу колони температура практично дорівнює температурі кипіння ВКК при відповідному тиску в колоні, на верхній тарілці колони температура практично дорівнює температурі кипіння НКК. На кожній тарілці колони встановлюється відповідна концентрація компонентів у рідині та відповідна температура кипіння рідини.
Схема протитечійної взаємодії потоків пари і рідини на тарілках ректифікаційної колони показана на рис. 1.2.
Якщо в кубову частину колони підвести тепло в кількості Q, то рідина з концентрацією Х1 закипить і виділить парову фазу в кількості Gп складу У1, збагачену НКК. Парова суміш поступає на контактний пристрій - тарілку і барботує через шар рідини, що перебуває на тарілці. При взаємодії пари з рідиною відбувається часткова або повна конденсація пари, при цьому концентрація НКК у рідині підвищується до величини Х2 (при повній конденсації). Одночасно при конденсації пари виділяється теплота конденсації, під дією якої рідина закипає і виділяє нову парову фазу, збагачену НКК. Рідина, що кипить, при цьому збагачується ВКК і по переливному пристрою перетікає вниз. Потік пари, що виділилася, з концентрацією У2 надходить на вище розміщену тарілку і процес конденсації пари - кипіння рідини повторюється.
Після багаторазового повторення процесу по висоті колони з верхньої тарілки виводиться пара з концентрацією НКК, що дорівнює Уд. Пара надходить у холодильник-конденсатор, де конденсується, утворюючи дистилят. Одночасно з нижньої частини колони відводиться кубовий залишок Gw, що представляє собою практично чистий ВКК.
Таким чином, контактні пристрої - тарілки ректифікаційної колони можна розглядати як свого роду тепломасообміні елементи конденсаторів - випарників, у яких одночасно протікають теплообмінні процеси (конденсації парової фази і випаровування рідини), та відбуваються масообміні процеси між взаємодіючими паровою і рідкою фазами.
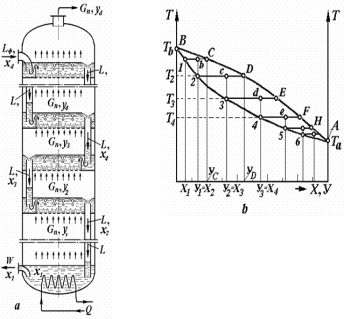
Рис. 1.2 - Ректифікація бінарної суміші:
а - схема процесів конденсації - випарювання на тарілках ректифікаційної колони;
b - хід процесів на тарілках у діаграмі Т - Х - У;
Потоки:
L - рідка фаза;
Gп - парова фаза;
W - кубовий залишок;
Q – теплоносій.
На рис. 1.2 б показаний хід процесів фазового переходу (випаровування і конденсації) на тарілках ректифікаційної колони в координатах діаграми температура - концентрація (Т - Х -У) при певному тиску [3]. Нижня крива Тb -1-2-3-4-5-6- Та відбиває зміну температур кипіння бінарного розчину на тарілках залежно від концентрації розчину. Верхня крива BCDEFHA відбиває температури конденсації та концентрацію компонентів у паровій фазі, що має рівноважний склад з киплячою рідиною. Горизонтальні лінії між кривими відображують процеси фазового переходу, що протікають на тарілках залежно від температури і концентрації речовин у фазах.
2 ЗАКОНИ РАУЛЯ
Для ідеальних розчинів летючість компонента пропорційна мольній концентрації цього компонента в розчині і дорівнює:
![]() , (1.12)
, (1.12)
де ki - коефіцієнт пропорційності, що враховує зміну летючості пари чистого розчинника залежно від мольної частки компонента в розчині за певної температурт і тиску над розчином;
Хi - мольна концентрація компонента в розчині.
Для ідеальних розчинів при невисокому тиску летючість пари компонента звичайно замінюють її парціальним тиском, відповідно коефіцієнт пропорційності було представлено тиском насиченої пари чистого компонента, при цьому одержали рівняння:
![]() , (1.13)
, (1.13)
де Рi* - тиск (пружність) насиченої пари чистого компонента над розчином за певної температури.
Рівняння (1.13) є математичною формою опису закону Рауля, запропонованого (1886 р.) стосовно до ідеальних розчинів.
Відповідно до закону Рауля, парціальний тиск пари індивідуального компонента над розчином за певної температури прямо пропорційний пружності насиченої пари і мольній концентрації компонента в розчині.
Отже, у відповідності з рівнянням (1.13), парціальний тиск пари компонента в ідеальному розчині за певної температури змінюється лінійно залежно від концентрації та досягає максимальної величини в чистому компоненті (Хi = 1,0). Лінії, що відображають залежність парціального тиску пари компонента над розчином від його концентрації в розчині при різних температурах розчину, називають ізотермами.
Розглянемо умови фазової рівноваги в бінарній системі пара - рідина, що знаходиться в закритій посудині 1 (рис. 1.3) при температурі t1, при цьому мольна концентрація НКК у рідині дорівнює Ха1, відповідно вміст ВКК у рідині складає Хb1 = (1 - Ха1) [2].
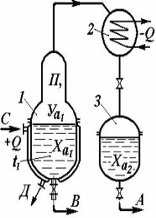
Рис. 1.3 - Схема установки простої дистилляції для пергонки бінарного розчину:
А - дистилят;
В - кубовий залишок;
С - гріюча пара;
Д - конденсат гріючої пари;
1 - куб-випарник;
2 - конденсатор;
3 - збірник дистилляту.
Розчинений компонент А бінарної системи є легколетючим, відповідно компонент В є важколетючим, при цьому залежності тисків (пружності) насиченої пари над розчином від температури розчину (t1) на діаграмі П - t відбиваються відповідними кривими для компонентів розчину (рис. 1.4).
У результаті нагрівання розчину над ним утворюється парова фаза, що містить Уа1 мол. часток НКК та Уb1 = (1 - Уа1) мол. часток ВКК. Загальний тиск пари компонентів над розчином дорівнює П [3].
Відповідно до закону Рауля, парціальний тиск НКК компонента А в паровій фазі над розчином пропорційний пружності насиченої пари і мольній концентрації Ха цього компонента в розчині:
![]() , (1.14)
, (1.14)
де ра - парціальний тиск компонента А в паровій фазі;
Ра - тиск насиченої пари компонента А (пружність пари) за даної температури.
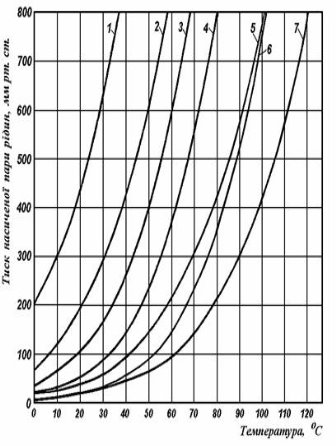
Рис. 1.4 - Тиск насиченої пари деяких компонентів розчину залежно від температури:
1 - діетиловий ефір;
2 - ацетон;
3 - метиловий спирт;
4 - етиловий спирт;
5 - мурашина кислота;
6 - вода;
7 - оцтова кислота.
Подібним чином, записавши закон Рауля для висококиплячого компонента, отримали:
![]() , (1.15)
, (1.15)
де pb - парціальний тиск компонента В у паровій фазі над розчином при температурі розчину t1;
Pb, - пружність насиченої пари компонента B при тій же температурі;
Ха, Х b - концентрація НКК та ВКК у розчині відповідно, мол. частки.
Загальний тиск пари над розчином, відповідно до закону Дальтона, дорівнює сумі парціальних тисків пари індивідуальних компонентів, і отже:
![]() . (1.16)
. (1.16)
Одночасно, відповідно до наслідку з закону Дальтона, парціальний тиск компонента в газовій (паровій) фазі пропорційний загальному тиску та його концентрації в суміші, і отже [4]:
![]() , (1.17)
, (1.17)
![]() , (1.18)
, (1.18)
де Уа, Уb, - концентрація компонентів А і В у паровій фазі над розчином, мол. частки;
П - загальний тиск пари над розчином.
Розв'язавши рівняння (1.18) відносно Уа з врахуванням залежності (1.17), одержали:
![]() . (1.19)
. (1.19)
Підставивши в рівняння (1.19) формули (1.17) і (1.18) для бінарного розчину, одержали залежність:
![]() . (1.20)
. (1.20)
Розв'язавши залежність (1.23) відносно концентрації Ха, знайшли:
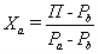 . (1.21)
. (1.21)
Підставивши в рівняння (1.21) залежність (1.20), отримали:
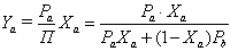 . (1.22)
. (1.22)
Теоретичні залежності (1.22) і (1.21) установлюють взаємозв'язок між рівноважними концентраціями низькокиплячого компонента в рідині і паровій фазі одночасно з урахуванням температури розчину, пружності насиченої пари компонентів і загальним тиском у системі, і отже ці залежності є рівняннями рівноваги у системі бінарний розчин - парова фаза.
На основі цих рівнянь для конкретної бінарної системи будують графіки рівноважних залежностей у різних системах координат.
На рис. 1.5 представлена діаграма в координатах тиск – концентрація (П-Х) для ідеального бінарного розчину.
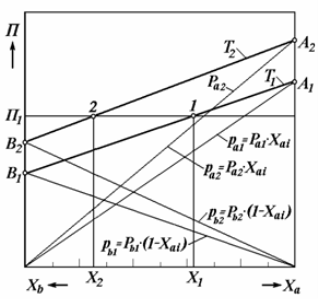
Рис. 1.5 - Діаграма залежності тиск - концентрація (П - Х) для ідеальної суміші:
А1В1 - ізотерма для температури Т1;
А2В2 - ізотерма для температури Т2.
Лінії А1В1 і А2В2 побудовані на основі законів Рауля і Дальтона у відповідності з рівнянням (1.22) та показують зміну загального тиску пари над бінарним розчином при різних температурах кипіння розчину залежно від концентрації НКК у розчині, при цьому Т2> Т1 [7].
Лінії, що враховують зміну загального тиску пари над розчином залежно від концентрації компонентів у розчині та отримані при постійній температурі кипіння розчину, називають ізотермами.
Якщо побудувати ряд ізотерм, а потім задати певний зовнішній тиск пари над розчином (наприклад, тиск П1), то можна помітити, що заданий тиск досягається при температурі кипіння розчину Т1 (точка 1) або при температурі кипінні розчину Т2 (т. 2). У першому випадку (для т. 1) концентрація НКК у розчині більша, ніж у другому випадку (для т. 2), тобто Х1> Х2.
Звідси випливають досить важливі висновки для складних однорідних ідеальних розчинів:
1) температура кипіння бінарного розчину буде тим нижчою, чим вища концентрація НКК у розчині;
2) тиск пари над розчином зростає більшою мірою за рахунок збільшення концентрації НКК у розчині.
У реальних бінарних розчинах спостерігаються відхилення від теоретичних розрахункових залежностей, установлених на основі закону Рауля, і тому реальні ізотерми бувають опуклими або ввігнутими.
3 ЗАКОНИ КОНОВАЛОВА
Закони Коновалова описують процеси, що протікають в рівноважних системах "рідкий розчин - пар" під дією температури або тиску.
Перший закон Коновалова (1881 р.) описує процес фракційної перегонки :
- насичений пар у порівнянні з рівноважним розчином збагачений компонентом, додавання якого до системи підвищує загальний тиск пари
Розглянемо фазову діаграму при постійному тиску для бінарної системи в координатах складу – температура (рис. 1.6).
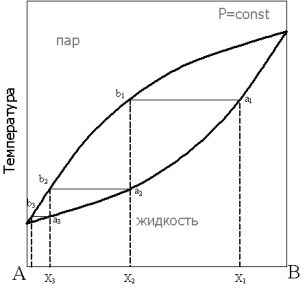
Рис. 1.6 – Залежність складу суміші від температури
При нагріванні вихідної суміші складу Х 1 кипіння почнеться в точці а 1. При цьому склад перших порцій пара відповідає точці b 1. При конденсації цього пара утворюється суміш складу Х 2, в якій частка компонента А вище, порівняно з вихідною сумішшю. Нагрівання цієї суміші призведе до отримання конденсату складу Х 3 і так далі, аж до виділення чистого компонента А. Відзначимо, що при кипінні суміші складу Х 1 склад рідини буде збагачуватися компонентом В, відповідно температура киплячої рідини буде підвищуватися до тих пір, поки в рідині не залишиться тільки компонент В.
Послідовні перегонки в промислових умовах об'єднані в один автоматизований процес в дефлегмаційних і ректифікаційних колонах.
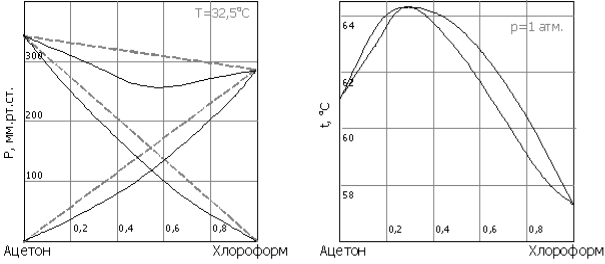
Другий закон Коновалова (1881 р.) описує розчини з відхиленнями від властивостей ідеальних розчинів і пояснює існування азеотропних розчинів, склад яких при перегонці не змінюється (рис. 1.7) [6]:
- екстремуми на кривих повного тиску пари відповідають такому рівноваги розчину і насиченої пари, при якому склад обох фаз однаковий.
Рис. 1.7 – Графічне зображення другого закону Коновалова
4 ЗАКОНИ ВРЕВСЬКОГО
4.1 Формулювання законів Вревського
Термодинамічна теорія подвійних систем типу розчин – пара разом з законами Д. П. Коновалова грунтується на законах М. С. Вревського (1911), які в кількісній формі висвітлюють вплив теплот випаровування компонентів на зміну складу пари розчинів з температурою. Ці закони широко застосовуються при розробці технологічних процесів розділення рідких сумішей, очищення речовин та особливо азеотропної ректифікації.
Закони, що управляють зміною рівноваги при зміні тиску в системі, установлені учнем Д. П. Коновалова М. С. Вревським. М. С. Вревський сформулював два закони.
1. При підвищенні температури кипіння (тиску) розчину двох рідин у парах зростає відносний зміст цього компонента, випар якого вимагає більшої витрати енергії.
2. При підвищенні температури (тиску) кипіння розчинів, пружність пари яких має максимум, у нероздільнокиплячої суміші зростає відносний вміст того компонента, випар якого вимагає більшої витрати енергії.
При підвищенні температури кипіння розчинів, пружність пари яких має мінімум, у нероздільнокиплячої суміші наростає відносний вміст того компонента, випар якого вимагає меншої витрати енергії.
Закони М. С. Вревського вказують на те, що зі зменшенням тиску при низьких концентраціях спирту в рідині (до 21% мол.) збільшується зміст води в парах, а при більше високих концентраціях спирту в рідині збільшується зміст спирту в парах [5].
Перший закон: при підвищенні температури і тиску збагачення пари, у порівнянні з рідиною, відбувається за тим компонентом, молярна теплота розчинення якого вище.
Відповідно до першого закону Вревського, під час простої перегонки в залишку, а слідом за цим і в дистиляті вміст НК поступово зменшується, а температура кипіння збільшується. Припустимо, що перегонці піддаються W кмоль суміші, що містить х мольних часток НК. Вміст НК у парах у будь-який момент часу становить у мольних часток. Визначимо, як згодом буде змінюватися склад залишку й дистиляту, припустивши, що ні в кубі, ні в холодильнику не порушується фазова рівновага. Тобто, пара миттєво видаляється з куба й не контактує з рідким залишком, а конденсат миттєво видаляється з холодильника і не стикається з парою.
В результаті випаровування нескінченно малої кількості суміші d концентрація НК у ній зменшиться на величину dx, її залишок у кубі становитиме (W-d). Кількість НК у цьому залишку: (W-d) (x-dx). Одночасно утвориться dW дистиляту, склад якого ‒ у [7].
Другий закон : в азеотропній суміші з максимумом на залежності загального тиску від складу при підвищенні температури зростає концентрація компонента з більшою парціальною мольною теплотою випаровування, а в азеотропній суміші з мінімумом - зростає концентрація компонента з меншою парціальною мольною теплотою випаровування.
Третій закон : при зміні температури в системах, для яких на залежності загального тиску від складу існує максимум, склад пари, що знаходиться в рівновазі з розчином постійного складу, і склад азеотропної суміші змінюються в одному напрямку (уздовж ліній АВ і LM на рис. 1.8 а); якщо ж залежність має мінімум, то при зміні температури склад пари і склад азеотропної суміші змінюються в протилежних напрямках (уздовж ліній АВ і LM на рис. 1.8 б) [5].
Закон охоплює умови другого і першого законів, які сумісні в нескінченно малий проміжок часу. Спочатку розглядають точку азеотропа при певних температурі і тиску, далі, закріпивши цей склад, досліджують зміну складу пара і азеотропа при варіюванні температури (тиску).
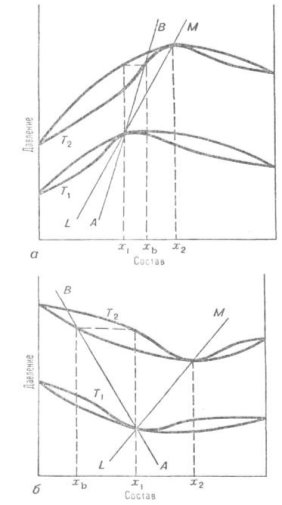
Рис. 1.8 - Діаграма рівноваги рідина - пар для подвійних систем з позитивними (а) і негативними (б) азеотропами:
Т1 і Т2 - температури,
х1 і х2 - вміст, що відповідає азеотропним сумішам,
xb - вміст пари при Т2, рівноважної до рідкої суміші складу x1.
Лінія AВ – зміна вмісту пари з температурою,
лінія LM – зміна вмісту азеотропа з температурою.
4.2 Застосування перегонки
Процес перегонки широко застосовується при переробці нафти, виробництві паливно-мастильних матеріалів, при розділенні розчинників, очистці речовин від домішок.
Розрізняють перегонку з однократним, багаторазовим і поступовим випарюванням. При перегонці з однократним випаром нафту нагрівають до певної температури й відбирають всі фракції, що перейшли в парову фазу. Перегонка нафти з багаторазовим випаром виконується з поетапним нагріванням нафти, і відбиранням на кожному етапі фракцій нафти з відповідною температурою переходу в парову фазу. Перегонку нафти з поступовим випаром в основному застосовують у лабораторній практиці для одержання особливо точного розділення великої кількості фракцій. Відрізняється від інших методів перегонки нафти низькою продуктивністю.
При перегонці з однократним випарюванням нафту нагрівають у змійовику якого-небудь нагрівача до заздалегідь заданої температури. По мірі підвищення температури утворюється усе більше пари, яка перебуває у рівновазі з рідкою фазою, і при заданій температурі парорідинна суміш залишає підігрівач і надходить в адіабатичний випарник. Останній являє собою пустотілий циліндр, у якому парова фаза відділяється від рідкої. Температура парової й рідкої фаз у цьому випадку однакова. Перегонка з багаторазовим випарюванням включає два або більше однократних процеси перегонки з підвищенням робочої температури на кожному етапі [8].
Точність розділення нафти на фракції при перегонці з однократним випарюванням менше в порівнянні з перегонкою з багаторазовим і поступовим випарюванням. Але якщо високої точності розділення фракцій не потрібно, то метод однократного випару дешевше: при максимально припустимій температурі нагрівання нафти 350-370°С (при більш високій температурі починається розкладання вуглеводнів) більше продуктів переходить у парову фазу в порівнянні з багаторазовим або поступовим випаром. Для відбору з нафти фракцій, що википають вище 350-370°С, застосовують вакуум або водяну пару. Використання в промисловості принципу перегонки з однократним випаром у поєднанні з ректифікацією парової й рідкої фаз дозволяє досягати високої чіткості розділення нафти на фракції, безперервності процесу й економічної витрати палива на нагрівання сировини [10].
Найбільше застосування продукти переробки нафти знаходять у паливно-енергетичній галузі. Наприклад, мазут володіє майже в півтора рази більшою теплотою згоряння в порівнянні з найкращим вугіллям. Він займає мало місця при згорянні й не дає твердих залишків. Мазут застосовується на ТЕС, заводах, на залізничному й водному транспорті дає величезну економію засобів, сприяє швидкому розвитку основних галузей промисловості й транспорту.
Бензин застосовується як пальне для двигунів внутрішнього згоряння. Залежно від призначення він підрозділяється на два основних сорти: авіаційний і автомобільний. Бензин використається також як розчинник масел, каучуку, для очищення тканин від жирних плям тощо.
Гас застосовується як пальне для реактивних і тракторних двигунів, а також для побутових потреб, флотореагент тощо.
Солярове масло застосовується як пальне для дизелів, мастила – для змащення різних механізмів.
Після перегонки мазуту залишається нелетка темна маса – гудрон, що йде на асфальтування вулиць.
Лігроїн служить паливом для дизельних двигунів, а також розчинником у лакофарбовій промисловості. Більші кількості його переробляють у бензин.
Енергетичний напрямок у використанні нафти дотепер залишається головним в усьому світі. Частка нафти у світовому енергобалансі становить більше 46%.
Однак в останні роки продукти переробки нафти усе ширше використовуються як сировина для хімічної промисловості. Близько 8% нафти споживається, як сировина для сучасної хімії. Наприклад, етиловий спирт застосовується приблизно в 50 галузях виробництва. У хімічній промисловості застосовуються формальдегід, пластмаси, синтетичні волокна, синтетичний каучук, аміак, етиловий спирт і т.д [9].
Продукти переробки нафти застосовуються й у сільському господарстві. Тут використаються стимулятори росту, протруйники насіння, отрутохімікати, азотні добрива, сечовина, плівки для парників і т.д. У машинобудуванні й металургії застосовуються універсальні клеї, деталі й частини апаратів із пластмас, мастила й ін. Широке застосування знайшов нафтовий кокс як анодна маса при електровиплавці. Пресована сажа йде на вогнестійкі обкладки в печах. У харчовій промисловості застосовуються поліетиленові впакування, харчові кислоти, що консервують засоби, парафін, виробляються білково-вітамінні концентрати, вихідною сировиною для яких служать метиловий і етиловий спирти та метан. У фармацевтичній і парфумерній промисловості з похідних переробки нафти виготовляють нашатирний спирт, хлороформ, формалін, аспірин, вазелін і ін. Похідні нафтосинтезу знаходять широке застосування й у деревообробній, текстильній, шкіряно-взуттєвій і будівельній промисловості.
ВИСНОВКИ
1 Розглянута загальна характеристика і фізико-хімічні параметри перегонки, її застосування в науці та виробництві.
2 Знайдено, що перегонка – це процес, який включає часткове випарування суміші, яка розділяється, та подальшу конденсацію утворюваної пари. В результаті конденсації пари отримують рідину, склад якої відрізняється від складу похідної суміші.
3 Показано, що шляхом дистиляції неможливо розділити азеотропні суміші рідин, тобто суміші рідин, що киплять при певному зовнішньому тиску при постійній температурі без зміни складу. Прикладом такої суміші є 96 % водний розчин етилового спирту, який кипить за температури 78,17 °C.
4 Відзначено, що закони М. С. Вревського відображають термодинамічну теорію подвійних систем типу розчин – пара разом з законами Д. П. Коновалова, які в кількісній формі висвітлюють вплив теплот випаровування компонентів на зміну складу пари розчинів з температурою.
ПЕРЕЛІК ПОСИЛАНЬ
1 Фізична та колоїдна хімія / В. І. Кабачний, Л. К. Осипенко, Л. Д. Грицан і ін. – 2-е вид., перероб. і доп. – Х. : В-во НФаУ, 2010. – 432 с.
2 Кабачний, В. І. Лекції з фізичної хімії : навч. посіб. для студ. вищ. фармац. навч. закл. / В. І. Кабачний, Л. Д. Грицан, Т. О. Томаровська, Л. К. Осіпенко; за ред. В. І. Кабачного. — Х. : НФаУ: Золоті сторінки, 2012. – 280 с.
3 Ковальчук Є. П., Решетняк О. В. Фізична хімія: Підручник. – Львів: Видавничий центр ЛНУ імені Івана Франка, 2007. – 800 с.
4 Кірєєв В. А. Курс фізичної хімії. — М. : Хімія, 1975. — 776 с.
5 Вревський М.С, Роботи з теорії розчинів. М.-Л., 1953;
6 Коган В. Б., Гетерогенні рівноваги, Л., 1968, с. 114-26;
7 Хазанова Н. Е., Системи з азеотропізмом при високих тисках, М., 1978. Н. Е. Хазанова.
8 Гельперін Н.І. Основні процеси і апарати хімічної технології: В 2 ч. − М.: Хімія, 1981. − Ч.2. − 812 с.
9 Дитнерський Ю.І. Процеси і апарати хімічної технології: Навч. для вузів: В 2-х кн. − Вид. 2-е. − М.: Хімія, 1995. − Ч.2: Массообмінні процеси і апарати. − 400 с.
10 Касаткін А.Г. Основні процеси і апарати хімічної технології. 9-е вид. переробл. і доповн. М.: Хімія, 1973. 754с.


про публікацію авторської розробки
Додати розробку