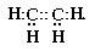План - конспект уроку "Алкени"
Хімія
Курс І, І семестр
«____»_____20__р. Група______ Заняття 11-12
ТЕМА: Алкени.
Мета: формувати знання здобувачів вищої освіти про гомологічні ряди алкенів і алкінів на прикладі етилену і ацетилену; ознайомити з природою кратного зв’язку, ізомерією за місцем положення кратного зв’язку і між класовою ізомерією; удосконалювати навички і вміння складати структурні формули і давати їм назви; виховувати екологічну компетентність здобувачів вищої освіти.
Вид заняття : комбіноване
Тип заняття : засвоєння нових знань
Форма проведення : комбінована
Міжпредметні зв’язки :
забезпечуючі: фізика
забезпечувальні: методика викладання природознавства
Методичне забезпечення та візуальний супровід: Таблиці «Будова алкенів і алкінів», «Типи гібридизації», шаростержневі моделі, мультимедійна презентація до уроку.
Література :
- Попель П.П., Крикля Л.С. Хімія, 10 кл., ВЦ «Академія», 2018.
- Буринська Н.М.,Величко Л.П. Хімія (підручник), 10 кл. Перун 2005
- Титаренко Н.В. Тренувальні тести з хімії , Генеза 2008
- http://subject.com.ua/lesson/chemistry/10klas_1/26.html
- http://osvita.ua/school/lessons_summary/chemistry/48535/
Ключові поняття: вуглеводні, гомологи етилену, гомологи ацетилену.
ЗМІСТ ЗАНЯТТЯ
І. Організація початку заняття:
- перевірка присутності студентів на занятті;
- перевірка готовності до заняття студентів, аудиторії.
ІІ. Перевірка домашнього завдання.
Розв'язати задачі:
1. Визначити формулу алкану, молекулярна маса якого складає 100. Назвіть речовину. Напишіть і назвіть 1 гомолог і 1 ізомер.
2. Визначте масові частки Карбону і Гідрогену в декані.
3. Обчисліть, який об’єм карбон (ІV) оксиду утвориться внаслідок згоряння пропану об’ємом 15л.
Підготувати цікаві факти про алкени.
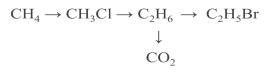
ІІІ. Перевірка знань з теми «Хімічні властивості алканів»
Здійснити перетворення.
![]()
ІV. Виклад нового матеріалу.
- Оголошення теми заняття.
- Мотивація вивчення теми.
- Запис плану в конспекти.
- Складання опорного конспекту.
План
- Будова молекули етилену.
- Гомологічний ряд алкенів.
- Види ізомерії.
- Фізичні властивості алкенів.
- Хімічні властивості алкенів.
Зміст лекції
- Будова молекул етилену і ацетилену
|
Ознака |
Етилен (алкен) |
|
Особливості будови |
Має 1 подвійний зв’язок С=С |
|
Молекулярна формула |
С2Н4 |
|
Електронна формула |
|
|
Структурна формула |
Н Н |
- Гомологічні ряди алкенів.
Алкени (або етиленові вуглеводні) – вуглеводні із загальною формулою СnН2n, в молекулах яких між атомами Карбону є один подвійний зв’язок.
Щоб дати назву алкенам, у назві відповідного алкану суфікс -ан замінюють на –ен.
Заповнити таблицю « Гомологічні ряди вуглеводнів»
(здобувачі освіти під керівництвом викладача заповнюють таблицю та дають назву вуглеводням).
|
Алкани СnН2n +2 |
Алкени СnН2n |
Алкіни СnН2n ─2 |
|
СН4 метан С2Н6 етан С3 С4 С5 і т.д. |
─ С2Н4 етен (етилен) |
─
|
Чому немає алкенів і алкінів з одним атомом Карбону?
- Види ізомерії
- Ізомерія карбонового ланцюга
С4Н8
1 2 3 4
СН2 = СН – СН2 – СН3 бут-1-ен
1 2 3
СН2 = С– СН3 2-метилпроп-1-ен
|
СН3
С5Н8
- Ізомерія положення кратного зв’зку
С4Н8
1 2 3 4
СН2 = СН – СН2 – СН3 бут-1-ен
1 2 3 4
СН3 - СН = СН – СН3 бут-2-ен
ІІІ. Закріплення вивченого.
- Скласти формулу: 4- етил-2- метилгекс-2-ен
- Робота з підручноком. С.51 – знайдіть відповідність формулам.
- Визначте формулу алкену якщо його молекулярна маса дорівнює 88 ( С6Н16).
- Розв’язати задачу.
Обчисліть масові частки Карбону і Гідрогену в пентені.
4. Фізичні властивості етилену .
- Гази – прозорі. Безбарвні
- Майже без запаху (С2Н4 слабкий солодкуватий запах)
- Малорозчинні у воді
- Легші за повітря : М(С2Н4) = 28 г/моль
М(повітря) = 29 г/моль
- Хімічні властивості алкенів.
Алкени хімічно активні. Їх хімічні властивості багато в чому визначаються наявністю подвійного зв’язку. Для алкенів найбільш характерні реакції електрофільного приєднання і реакції радикального приєднання. Реакції нуклеофільного приєднання зазвичай вимагають наявність сильного нуклеофіла і для алкенів не типові.
Алкени легко вступають в реакції окиснення, приєднання а також здатні до алільного радикального заміщення.
I. Реакції приєднання
1. Гідрування
Алкени легко приєднують водень за присутності каталізаторів (Pt, Pd, Ni)
CH2=CH2 + H2 → CH3–CH3
2. Галогенування
Алкени при звичайних умовах приєднують галогени, утворюючи дигалогенпохідні алканів, що містять атоми галогену у сусідніх вуглецевих атомів
CH2=CH2 + Br2 → CH2Br–CH2Br
3. Гідрогалогенування
Взаємодія алкенів з галогеноводнями залежить від будови ненасиченої сполуки, природи галогену та умов проведення. Для несиметричних алкенів приєднання галогеноводнів відбувається за правилом В. Марковнікова: Гідроген приєднується до найбільш гідрогенізованого атома Карбону.
CH3–CH=CH2 + HBr → CH3–CHBr–CH3
При цьому атом гідрогену приєднується до найбільш гідрогенізованого карбонового атома, тобто карбону, зв’язаного з найбільшою кількістю атомів гідрогену. Ця закономірність була встановлена В.В. Марковниковим і тому називається правилом Марковникова.
Виходячи з сучасних електронних уявлень, правило В.В. Марковникова можна пояснити так. В етилені та в симетрично побудованих його похідних, де Карбонові атоми, сполучені подвійним зв’язком, цілком рівноцінні, електронна густина розподілена рівномірно (симетрично), внаслідок цього молекули їх неполярні. У пропілені, як несиметричному алкені, симетричний розподіл електронної густини порушено. Тут під впливом метильної групи електронна хмара подвійного зв’язку зміщена в напрямку до метиленової групи, що приводить до виникнення полярності всієї молекули та виявляється в наявності дипольного моменту. Розподіл електронної густини має вигляд:
Правило Марковнікова не виконується при розміщенні біля подвійного зв’язку електроноакцепторних груп (–CN, –NO2).
Якщо реакцію гідрогалогенування проводити за радикальним механізмом (наприклад, у присутності гідроген пероксиду H2O2) то приєднання буде йти всупереч правило Марковнікова. Цей випадок відхилення називається пероксидний еффект Карраша
CH3–CH=CH2 + HBr → CH3–CH2–CH2Br
4. Гідратація
Гідратація алкенів відбувається в присутності мінеральних кислот і підпорядковується правилу Марковнікова. Продуктами реакції є спирти
CH2=CH2 + H2O → CH3–CH2–OH
5. Алкілювання
Приєднання алканів до алкенів в присутності кислотного каталізатора (HF або H2SO4) при низьких температурах призводить до утворення вуглеводню з більшою молекулярною масою і часто використовується в промисловості для одержання моторного палива
R–CH2=CH2 + R’–H → R–CH2–CH2–R’
II. Окиснення
Окиснення алкенів може відбуватися залежно від умов і видів окиснювальних реагентів як з розривом подвійного зв’язку, так і з збереженням вуглецевого скелета.
CH2=CH2 + HO–OH → HO–CH2–CH2–OH
ІV. Закріплення та узагальнення знань
1..Напишіть структурні формули речовин:
2- метил-1-бутен.
2. Визначте молекулярну формулу алкену, якщо його відносна молекулярна маса дорівнює 56.
3. Обчисліть масові частки Карбону і Гідрогену в молекулі ацетилену.
Домашнє завдання:
Опрацювати п.8, 9 виконати № 52,53,59, творче №55.
1


про публікацію авторської розробки
Додати розробку