План конспектТема: Маса атома. Атомна одиниця маси. Відносні атомні маси хімічних елементів. Хімічні формули речовин. Прості і складні речовини. Багатоманітність речовин. Лаборато
Тема: Маса атома. Атомна одиниця маси. Відносні атомні маси хімічних елементів. Хімічні формули речовин. Прості і складні речовини. Багатоманітність речовин. Лабораторний дослід №4 Ознайомлення зі зразками простих і складних речовин.
Олександрівська загальноосвітня школа І-ІІІ ступенів
Конспект уроку
З хімії 7 класу
(з використанням педагогічної спадщини В.Сухомлинського в процесі викладання хімії)

Тема: Маса атома. Атомна одиниця маси. Відносні атомні маси хімічних елементів. Хімічні формули речовин. Прості і складні речовини. Багатоманітність речовин. Лабораторний дослід №4 Ознайомлення зі зразками простих і складних речовин.
Виконав учитель хімії:
Єрмоліна Світлана Іванівна
2018-2019 н.р
Урок 9, дата проведення 19.10
Тема: Маса атома. Атомна одиниця маси. Відносні атомні маси хімічних елементів. Хімічні формули речовин. Прості і складні речовини. Багатоманітність речовин. Лабораторний дослід №4 Ознайомлення зі зразками простих і складних речовин.
Мета:
- ознайомити з поділом речовин на прості та складні, навчити їх розрізняти, показати відмінність між простими та складними речовинами, систематизувати знання про будову та багатоманітність речовин;
- розвивати пам'ять, творчі здібності, пізнавальний інтерес учнів;
- виховувати інтерес до науки.
Обладнання: періодична система хімічних елементів, відеоролик до лабораторного досліду № 4 «Ознайомлення зі зразками простих і складних речовин»
Базові поняття і терміни: проста речовина, складна речовина.
Тип уроку: вивчення нового матеріалу.
Хід уроку
І. Організаційний момент.
ІІ. Перевірка домашнього завдання
– Згадаймо, що таке молекула. (Молекула – це найдрібніша частинка речовини, що має її властивості)
– З чого складається молекула? (З атомів)
– З однакових чи різних? (Із однакових, і з різних)
ІІІ. Актуалізація опорних знань.
Запитання для учнів:
- Назвіть частини з яких складаються фізичні тіла;
- сформулюйте визначення понять : а) «речовина» ; б) «атом»; в) «молекула»;
- що таке хімічний елемент;
- назвіть, скільки елементів відомо науці ;
- чому дорівнює відносна атомна маса Оксигену;
- як позначається відносна атомна маса елемента;
- назвіть найлегший елемент;
- назвіть відносну атомну масу найлегшого елемента;
- з яких елементів складається молекула води;
- з яких елементів складається молекула Кисню.
ІV. Мотивація навчальної діяльності.
Подумайте: чи існує різниця між киснем і водою; залізом і кухонною сіллю; вуглекислим газом і воднем.
Одні з цих речовин містять атоми одного виду , а інші – атоми різних видів. Сьогодні ми поглибимо знання про класифікацію речовин за складом їх молекул.
V. Вивчення нового матеріалу.
Прості і складні речовини. Багатоманітність речовини.
Атоми хімічних елементів сполучаються між собою, утворюючи всю різноманітність речовин, або хімічних сполук.
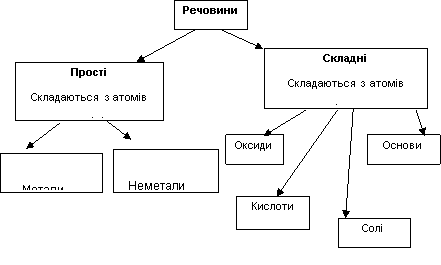
Речовини поділяються на прості і складні, про це ви вже знаєте з курсу природознавства. Пригадайте, у чому їх суть.
Прості речовини складаються з атомів одного виду.
Наприклад, елемент Гідроген утворює одну просту речовину – водень. Молекула водню складається з двох атомів хімічного елемента Гідрогену.
Однак існують прості речовини, які не утворюють молекул, а їхніми структурними частинками є власне атоми, що також сполучаються між собою. До них належать мідь, алюміній, цинк, залізо тощо. Назви простих речовин часто збігаються з назвами відповідних елементів. Наприклад, слово «алюміній» може означати і хімічний елемент, і просту речовину, утворену цим елементом. Назви простих речовин на відміну від назв елементів пишуться з малої літери.
Більшість простих речовин за звичайних умов перебувають у твердому стані, 12 є газоподібними і лише дві – ртуть і бром – рідини. Розрізняють прості речовини двох типів – метали і неметали.
Складні речовини складаються з атомів різних видів.
Вода є складною речовиною, оскільки утворена двома елементами. Її молекула складається з двох атомів Гідрогену й одного атома Оксигену. Існує понад 20 млн складних речовин. До них відносяться оксиди, кислоти, основи, солі, органічні речовини.

Складні речовини не є сумішами простих речовин відповідних елементів. Залишається з’ясувати, чим відрізняються між собою складні речовини і суміші за допомогою демонстраційного досліду.
а) Демонстрація досліду. На картон насипаємо залізний порошок масою 7г і сірку масою 4г. Розмішуємо їх. Що утворилося? Як розділити цю суміш? Розділяємо магнітом.
Видозмінимо дослід. Насипаєм`о суміш порошків заліза і сірки у пробірку і нагріваємо. Що спостерігаєте? Розбиваємо пробірку, висипаємо утворену речовину і спробуємо розділити залізо і сірку магнітом. Утворена сполука магнітом не притягується.
Висновок: властивості сумішей і складних речовин різні.
Василь Сухомлинський при проведенні уроків з хімії закликав виконувати лабораторні досліди самостійно так як в цьому віці ви виявляєте особливу зацікавленість до даного предмета . Тому давайте спрбубуємо також самостійно виконати лабораторний дослід №4 « Ознайомлення зі зразками простих і складних речовин», а також закріпите знання із вивченої теми та навчитесь робити загальний висновок до даного досліду. (Учні переглядають відеоролик лабораторного досліду та потім виконують його в практичному зошиті)
Лабораторний дослід №4 Ознайомлення зі зразками простих і складних речовин.
1) Організація учнів до лабораторного досліду.
2) Інструктаж до проведення лабораторного досліду.
3) Виконання лабораторного досліду.
4) Складання висновку до лабораторного досліду.
VІ. Узагальнення і систематизація знань.
Часто Василь Сухомлинський застосовував на своїх уроках різноманітні вправи, давайте також з вами узагальнимо наші знання виконуючи таку вправу як «Тренажер для розвитку уваги», адже В.Сухомлинський вважав, що використання запропонованих завдань сприяє розвитку творчості, інтелекту та логічного мислення учнів; розвивається вміння пов’язувати теоретичні знання з практичними навичками.
1. З поданого переліку речовин випишіть спочатку прості, а потім складні речовини: цукор, вода, кисень, мідь, кислота оцтова, крейда, цинк, молоко, пісок, залізо, нафта.
2. В поданому переліку речовин: олія, скло, алюміній, бензин, золото, жир, спирт, переважають
а) прості речовини; б) складні речовини;
в) простих і складних речовин порівну.
3.Скільки формул простих та складних речовин наведено в таблиці?
|
|
А |
Б |
В |
Г |
Д |
Е |
Ж |
|
1 |
С02 |
НNO3 |
СаС03 |
Мg0 |
H2 |
S03 |
NaОН |
|
2 |
FеО |
Fе203 |
NаN03 |
А1С13 |
СuО |
CO2 |
Мg(0Н)2 |
|
3 |
Н20 |
NaCl |
HCl |
H2 |
С02 |
Сu(ОН)2 |
МgО |
|
4 |
аі2о3 |
НNO3 |
S02 |
P205 |
H2O |
NаNO3 |
CO2 |
|
5 |
СаС03 |
NаОН |
Сu(ОН)2 |
МgО |
С02 |
Nа3РО4 |
Na2O |
|
6 |
Fе203 |
Мg0 |
С02
|
P205 |
S03 |
FеО |
Н20 |
|
7 |
S03 |
Н2 S04 |
Na2S |
СuS04 |
Н2S |
К2S03 |
Са(0Н)2 |
|
8 |
Р |
S |
C |
N2 |
H2 |
02 |
Fe |
|
9 |
Н20 |
СuО |
Н2S04 |
NaОН |
СuS04 |
NaС1 |
KOH |
|
10 |
HCl |
Н2 S04 |
HNОз |
Н2Si03 |
H2CO3 |
Н2S |
Н3Р04 |
VІІ. Підведення підсумків уроку.
( Вчитель разом із учнями підводить підсумок уроку та робить загальні висновки):
- За якісним складом усі речовини поділяються на прості та складні.
- Складні речовини істотно відрізняються від суміші речовин.
- Складні та прості речовини відрізняються за фізичними й хімічними властивостями.
VІІІ. Домашнє завдання.
Прочитати параграф, відповісти на запитання, повторити назви й хімічні символи елементів. Виписати з підручника п’ять формул складних речовин і описати їх якісний склад.


про публікацію авторської розробки
Додати розробку
