Початкові відомості про будову атома. Ядерна модель атома. Електрони. Йони.Етапи становлення та основні положення атомно-молекулярного вчення про будову речовини.
Урок 3/3. Початкові відомості про будову атома. Ядерна модель атома. Електрони. Йони.Етапи становлення та основні положення атомно-молекулярного вчення про будову речовини.
Мета:
Освітня . Дати учням поняття про будову атома,сформувати уявлення про ядерну модель атома і основні положення атомно-молекулярного вчення про будову речовини.
Розвиваюча. Розвивати інтерес до предмету, логічне мислення, просторову уяву.
Виховна . Виховувати в учнів спостережливість, висловлювати свою думку та вміння спілкуватися.
Тип уроку. Комбінований урок.
Прилади та матеріали: таблиці із зображеннями атомів і молекул, склянки з розчином мідного купоросу
Презентація Урок 3.3
Відео Будова атома і ядра Дослід Резерфорда
Є тільки одне благо - знання й тільки одне зло - неуцтво.
Хід уроку
1. Організаційний момент.
2. Перевірка домашнього завдання.
Індивідуальне опитування учнів біля дошки:
Речовина і поле.
Початкові відомості про будову речовини.
Молекули і атоми.
Вчитель оцінює відповіді учнів.
3. Актуалізація опорних знань.
Бесіда за запитаннями.
1. З чого складається речовина?
2. З чого складаються молекули?
3. Чи однакові молекули води в гарячому чаї та в арктичній кризі?
4. Мотивація навчальної діяльності.
Проблемне запитання: На попередньому уроці ми з вами вияснили, що молекули складаються з атомів, а як ви думаєте чи може атом мати свою будову? Якщо так то які у вас будуть ідеї?
Учні відповідають, вчитель аналізує їх відповіді і
оголошує тему та мету уроку.
Тема: Початкові відомості про будову атома. Ядерна модель атома. Електрони. Йони.Етапи становлення та основні положення атомно-молекулярного вчення про будову речовини.
5. Сприйняття та засвоєння нового матеріалу.
Все починається з атома. У давнину атом вважали найпростішою частинкою, яка не має власної структури. Слово “атом” походить від грецького слова atomos - неподільний. Однак сьогодні відомо, що атом має складну структуру. Вирішальну роль у дослідженні будови атома відіграли досліди, які провів у 1911 році основоположник ядерної фізики Е. Резерфорд. Він створив нову модель атома, що отримала назву планетарної. Атом будь-якої речовини складається з масивного ядра, навколо якого рухаються електрони . Виявилося, що ядро будь-якого атома приблизно в 100 000 разів менше, ніж сам атом .
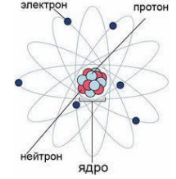
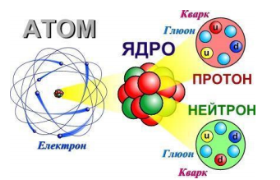
Відкриття елементарних частинок. Упевнившись, що атом не є “неподільним”, фізики намагалися встановити “цеглинки”, з яких він складається. Електрон - перша з відомих елементарних частинок. Термін електрон запровадив у 1894 році Джордж Джонстоун Стоуні. Він вперше сформулював ідею про те, що природа складається із заряджених частинок ще в1874 році. Експериментально відкрив електрон у 1897 році Джозеф Джон Томсон у експериментах з катодними променями у вакуумних лампах.
У 1913 році Е. Резерфорд припустив, що ядро атома Гідрогену є елементарною частинкою, яку назвали протоном, і яка входить до складу інших атомних ядер. Цю гіпотезу було підтверджено експериментально у 1919 р., коли в дослідах виявили окремі протони.
У 1932 р. англійський фізик Дж. Чедвік на досліді встановив, що
невідоме дуже проникне проміння, яке спостерігали він та інші вчені є потоком
нейтральних частинок, маса яких близька до маси протона. Існування такої
частинки ще 1920 р. передбачив Е. Резерфорд, її було названо нейтроном.
Окрім електронейтральних атомів і молекул, існують одно- або багатоатомні заряджені частинки, які називають йонами. Позитивно заряджені йони утворюються з атому, якщо він втрачає певне число електронів. Негативно заряджені йони утворюються з атому, якщо він приєднує певне число електронів. Позитивно заряджені йони називають катіонами, а негативно заряджені – аніонами.
Основні положення атомно молекулярного вчення:
I. Будь-які речовини мають дискретну (переривчасту) будову. Вони складаються з найдрібніших частинок молекул і атомів. Підтвердженням дискретності є прокатка, кування металу, отримання 1974 року фотографії окремих молекул і атомів, розчинність речовин тощо.
II. Молекули знаходяться в стані неперервного хаотичного (невпорядкованого) руху, що називається тепловим і у загальному випадку є сукупністю поступального, обертального і коливального рухів.
III. Молекули взаємодіють одна з одною із силами електромагнітної природи, причому на великих відстанях вони притягуються, а на малих — відштовхуються. Сили притягання і відштовхування між молекулами діють постійно.
6. Осмислення об'єктивних зв'язків.
Бесіда за запитаннями.
- Яка модель атома?
- Що таке електрон? Протон? Нейтрон? Йон?
- Основні положення атомно- молекулярного вчення про будову речовини?
7. Підсумок уроку.
Метод «Продовж речення»
Пропонуємо учням продовжити речення : «Я на цьому уроці навчився (зрозумів, з’ясував, тощо)»
8. Домашнє завдання.

про публікацію авторської розробки
Додати розробку
