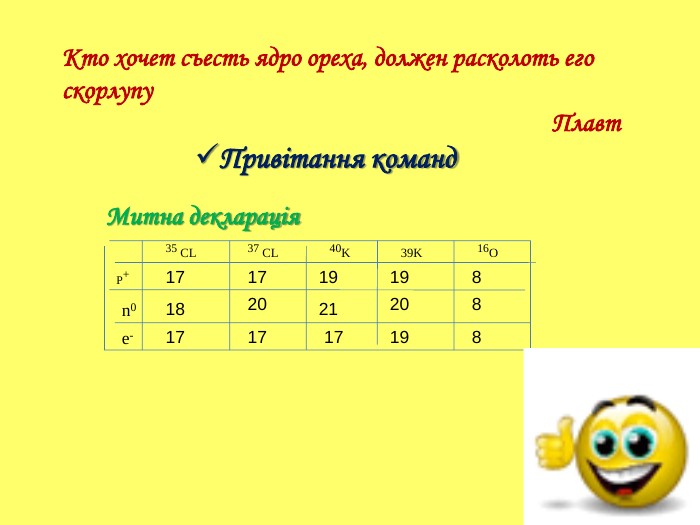
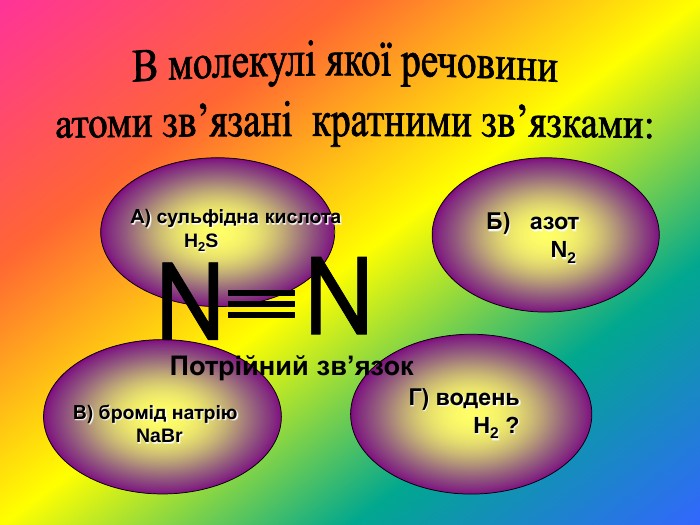
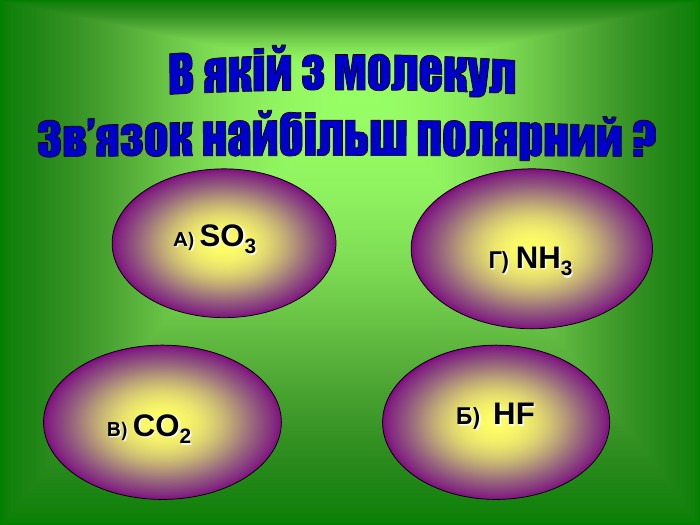
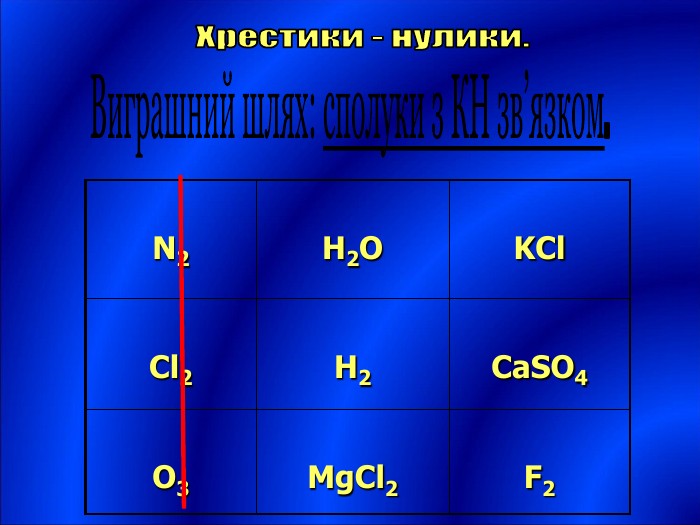
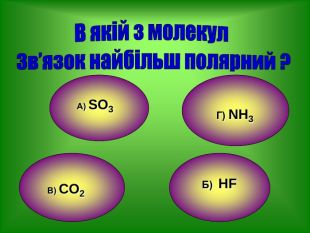
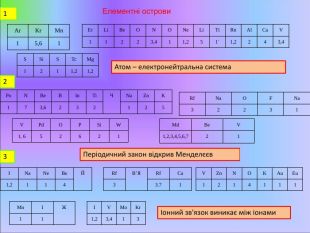
ПОДОРОЖ ДО КРАЇНИ “МЕНДЕЛЄЄВІЙ”
Про матеріал
Узагальнення і систематизація знань про періодичний закон, будову атома та види хімічного зв'язку. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку