Поняття про оксиди, окиснення (горіння, повільне окиснення, дихання).
Мета уроку: сформувати поняття про окиснення та горіння; порівняти
процеси горіння, повільного окиснення, дихання; розширити уявлення про
оксиди як продукти горіння; формувати позитивне ставлення до навчання,
етичних, естетичних, патріотичних та інших якостей особистості; розвивати в учнів уміння робити логічно обумовлені висновки; розвивати навчальнопізнавальний інтерес до вивчення хімії.
Тип уроку: урок вивчення нового матеріалу
ПЛАН-КОНСПЕКТ УРОКУ З ХІМІЇ 7 КЛАС
Виконав: студент Безсмертний Богдан
Урок: поняття про оксиди, окиснення (горіння, повільне окиснення, дихання). Мета уроку: сформувати поняття про окиснення та горіння; порівняти процеси горіння, повільного окиснення, дихання; розширити уявлення про оксиди як продукти горіння; формувати позитивне ставлення до навчання, етичних, естетичних, патріотичних та інших якостей особистості; розвивати в учнів уміння робити логічно обумовлені висновки; розвивати навчальнопізнавальний інтерес до вивчення хімії.
Тип уроку: урок вивчення нового матеріалу з використанням проблемного навчання.
Методи навчання: вербальні (пояснення, репродуктивна, евристична бесіда), наочні (ілюстрації), практичні (розв’язування доцільно підібраних завдань, тренувальні вправи).
Обладнання: дошка, мультимедія, підручники, роздатковий матеріал, таблиця хімічних елементів.
Поняття, що розвиваються: хімічний елемент, проста речовина, закон збереження маси речовин, схема хімічної реакції, хімічні рівняння, кисень, каталізатор, реакція розкладу, хімічні властивості, оксиди, прості речовини, реакція сполучення, горіння, повільне окиснення, дихання.
Література:
1. https://school-71.zp.ua/sites/default/files/2018-
10/Хімія%20підручник%20для%207%20класу%20Ярошенко.pdf
2. https://sites.google.com/view/chemistry-v-n/7-клас/тема-2кисень/поняття-про-оксиди-окиснення-горіння-повільне-окисненнядихання-умови
3. https://files.pidruchnyk.com.ua/uploads/book/7-klas-himiia-popel-2020.pdf
Хід уроку
Організація класу (2-3 хвилини).
Підготовка вчителем класу до уроку. Визначення відсутніх; перевірка наявності підручників, таблиці Мендєлєєва, роздаткового матеріалу. Оголошення теми уроку.
Актуалізація опорних знань (3-5 хвилин).
Ми з вами вивчали багато термінів, що стосуються різних хімічних процесів і явищ, тому щоб згадати і перевірити наскільки ви їх пам’ятаєте пропоную розділитися на дві групи і за 1 хвилину написати якнайбільше термінів, та група, яка справиться швидше отримає додатковий 1 бал до наступного тестування.
Очікувані терміни: проста речовина, складна речовина, хімічний елемент, атом, молекула, електрон, протон, вода, тіло, матеріал, агрегатний стан речовини (твердий, рідкий газоподібний), суміш, чиста речовина, хімічна формула, відносна атомна маса, відносна молекулярна маса… та ін.
Коротке опитування:
1. Який порядковий номер у Оксигену в періодичній системі?
2. Яка валентність у Оксигену?
3. Які прості речовини утворює Оксиген?
4. Вкажіть формулу води та кількість атомів Оксигену в ній.
5. Яка відносна молекулярна маса кисню.
6. В якій групі розташований Оксиген?
Мотивація навчальної діяльності (2-3 хвилини)
Всім відомо, що Прометей – один із титанів древньогрецької міфології – викрав з Олімпа у бога вогню Гефеста благодатне полум’я і віддав його на служіння людям. Це міф, який асоціюється у людей з виникненням вогню. Саме завдяки появи вогню людство має великий прогрес, який змінив наш побут і весь світ. Багато з вас точно задавали собі такі питання: як горить полум’я, чому горить газова канфорка, чому горять бенгальські вогники? Саме на цьому уроці ми спробуємо дати визначення на ці питання. Вивчення нового матеріалу (20-30 хвилин)
Ви знаєте, що кисень є активною хімічною речовиною і речовини, які утворюються при взаємодії з киснем називаються оксидами.
Запишіть! Сполуку, утворену двома елементами, одним із яких є Оксиген, називають оксидом. Реакції речовин з киснем називають окисненням.
Склад майже всіх оксидів відповідає загальній формулі ЕmОn, у якій індекс m може набувати значень 1 або 2. Кожний оксид має хімічну назву, а де" які — ще й традиційні, або тривіальні назви (табл).

Хімічна назва оксиду складається із двох слів. Першим словом є назва відповідного елемента, а другим — слово «оксид». Якщо елемент має змінну валентність, то він може утворювати кілька оксидів. Зрозуміло, що їхні назви повинні бути різними.
Для цього після назви елемента вказують (без відступу) римською цифрою в дужках значення його валентності в оксиді. Приклад такої назви сполуки: хром (ІІІ) оксид (читається «хром три оксид»).
У хімічних назвах оксидів відмінюється лише друге слово: магній оксиду, ферум (IІІ) оксидом. Якщо елемент виявляє змінну валентність, то оксид, у якому значення валентності цього елемента є для нього максимальним, називають вищим. Вищий оксид Карбону — сполука з формулою СО2. Поміркуйте! Складіть формули оксидів Натрію, Цинку, Алюмінію, Силіцію (IV), Феруму(ІІІ), Нітрогену(ІІ) і Нітрогену(ІV). Відшукайте, у яких формулах валентність елемента збіглась з номером групи.
Найпоширенішими оксидами на Землі є гідроген оксид, або вода H2O, силіцій(IV) оксид SiO2 — основна складова частина піску та граніту, алюміній оксид Al2O3, що входить до складу глини, ферум(III) оксид Fe2O3, (міститься у залізних рудах) та інші.
Питання для учнів! Які оксиди із зазначених вище утворені металічними, а які — неметалічними хімічними елементами? Оксиген — найпоширеніший елемент на Землі. У природі переважна більшість Оксигену перебуває у сполуках з іншими елементами.
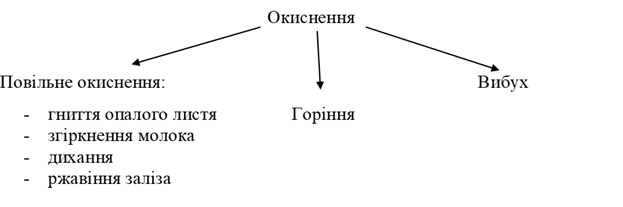
Окиснення. Від назви «кисень» походить загальна назва реакцій за участю цієї простої речовини — окиснення. На розглянутих у попередньому параграфі прикладах ви мали змогу переконатися, наскільки різним воно буває. Тому окиснення поділяють на горіння, повільне окиснення, дихання.
Проста речовина кисень підтримує горіння. Кисню, що міститься в повітрі, досить для горіння дров у багатті, природного газу в грубці, вугілля в каміні. Якщо використовувати для горіння чистий кисень, воно відбувається інтенсивніше.
Взаємодія речовин з киснем не завжди супроводжується горінням. Більшість таких реакцій відбувається непомітно:
1. скисання молока
2. ржавіння заліза
3. гниття
Речовина, взаємодіючи з киснем, зазнає окиснення, тобто змінюється за участю кисню. (Такі реакції називаються реакціями окиснення). Запишіть! Окиснення – це хімічна реакція взаємодії речовин (простих і складних), з киснем.
Існує багато прикладів окиснення, яке не можна віднести до горіння, бо воно не супроводжується виділенням світла та відбувається повільно. Як приклад можна навести гниття опалого листя, згіркнення масла, іржавіння заліза.
Через повільний перебіг цих реакцій залишається непомітною така їх ознака, як виділення теплоти. Продукти такого окиснення можна побачити лише через роки, місяці, тижні, тому його назвали повільним окисненням.
Запишіть! Окиснення речовин, що відбувається без світла, а лише з виділенням теплоти (теплової енергії), називають повільним окисненням.
Пригадайте з біології досліди, що доводять необхідність кисню для дихання!
Горіння. Почувши слова «горить багаття», кожен з вас в уяві малює полум’я, від якого випромінюються тепло і світло. Горіння — це реакції окиснення, що супроводжуються виділенням тепла й світла.
Горіння є першою хімічною реакцією, з якою познайомилася людина та навчилася здійснювати самостійно. Нині горіння стало невід’ємною ознакою її життя. Наведіть відомі вам приклади використання горіння.
Горіння, як вам відомо, відбувається досить швидко. Речовин, здатних горіти в кисні, існує досить багато. Якщо горіння здійснюється під контролем людини (у газовій плиті, двигунах автомобілів, на теплових електростанціях тощо), воно приносить користь. Незаплановане самочинне загоряння дуже небезпечне. Щоб попередити, що речовина легкозаймиста, вдаються до її маркування знаком, зображеним на малюнку.
 Спостерігаючи за горінням речовин у кисні на попередньому уроці, ви помічали, що горіння у кисні відбувається швидше, ніж у повітрі. Зазначимо, що під час горіння у кисні температура вища, ніж у повітрі. Це пояснюється тим, що повітря лише на 1/5 складається з кисню. Решта газів не беруть участі в горінні, але на їх нагрівання витрачається теплота. Для горіння має значення площа зіткнення речовин з повітрям (киснем).
Спостерігаючи за горінням речовин у кисні на попередньому уроці, ви помічали, що горіння у кисні відбувається швидше, ніж у повітрі. Зазначимо, що під час горіння у кисні температура вища, ніж у повітрі. Це пояснюється тим, що повітря лише на 1/5 складається з кисню. Решта газів не беруть участі в горінні, але на їх нагрівання витрачається теплота. Для горіння має значення площа зіткнення речовин з повітрям (киснем).
Питання для учнів: що згорить швидше — дерев’яна дошка, чи дерев’яні стружки, на які її подрібнили? Чому?
Чим шкідливе окиснення? Та не завжди горіння й повільне окиснення виявляються корисними. Багато лиха і збитків завдають пожежі. Через повільне окиснення заліза псуються машини та механізми. Псування продуктів харчування — теж наслідок повільного окиснення. Особливо небезпечним є повільне окиснення насіння у зерносховищах.
Коли насіння сухе, то його дихання відбувається повільно. Якщо ж вологість насіння перевищує припустиму норму, то повільне окиснення прискорюється, і з часом під впливом тепла, що виділяється і накопичується, може статися самозаймання. Це ж саме трапляється з торфовищами спекотного літа.
Уважно! Якщо процес повільного окиснення не контролювати, своєчасно не відводити теплоти, то може статися самозаймання — загоряння без зовнішнього джерела запалювання.
Закріплення, систематизація та узагальнення (5 хвилин)
Напишіть рівняння реакцій та дайте назви оксидам: Складіть формули оксидів:
Li + O2 → 1. Хлор(ІІ) оксид
N2 + O2 → 2. натрій оксид
Ca + O2 → 3. фосфор(ІІІ) оксид
С + O2 → 4. магній оксид
АІ + O2 → 5. Сульфур(VI) оксид
N2 + O2 →
Запитання до учнів:
1. Хімічні реакції в яких приймає участь кисень називається
2. Хімічний елемент, що перекладається «як той що горить»
3. Живі організми, які здатні жити без атмосферного кисню
4. Складні речовини, що складаються з одного з хімічного елемента як Оксиген
5. Пристрій, який здатний загасити пожежу
6. Для хімічної реакції характерно виділення тепла та світла називається
7. Процес характерний для живих організмів, в результаті якого поглинається кисень, а виділяється вуглекислий газ та вода Домашнє завдання: Опрацювати параграфи 24-25 підручника (Попель П. Хімія : підруч. для 7 кл. закл. заг. серед. освіти), дайте письмові відповіді на питання в кінці параграфу 25 (№183-189).


про публікацію авторської розробки
Додати розробку
