Повторення вивченого матеріалу за 7 клас
Про матеріал
Повторення вивченого матеріалу з хімії за 7 клас та підготовка до діагностичної контрольної роботи з хімії за 7 клас, а також вступ до хімії 8 класу! Перегляд файлу
Хімія 8 клас. Урок №1
Тема: Повторення вивченого матеріалу за 7 клас.
Повторення теоретичного матеріалу з курсу хімії 7 класу:
-
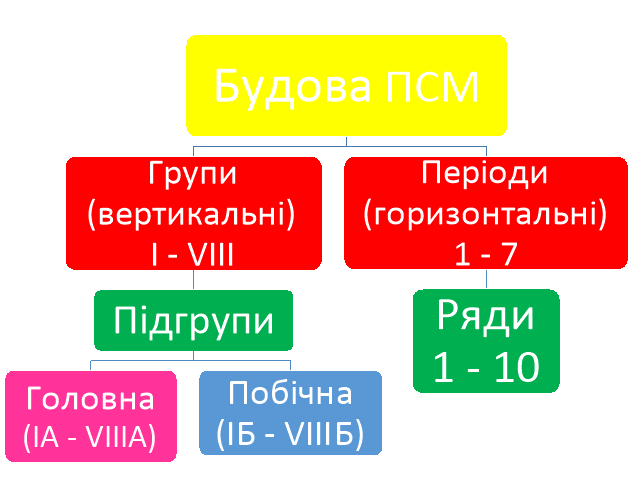 Будова періодичної системи хімічних елементів Д.І.Менделєєва.
Будова періодичної системи хімічних елементів Д.І.Менделєєва.
- Атомна та відносна атомна (Аr) маси елементів.
-
Атомна маса хімічного елемента – це відношення абсолютної маси атому до
 частини абсолютної маси атому Карбону – 12. Відносна атомна маса елемента (Аr) – це відношення маси атома до атомної одиниці маси(а.о.м.).
частини абсолютної маси атому Карбону – 12. Відносна атомна маса елемента (Аr) – це відношення маси атома до атомної одиниці маси(а.о.м.).
- Атомна маса елементів записана біля елементів у ПСМ.
- Щоб знайти Аr елемента, потрібно атомну масу заокруглити до цілого числа, за всіма законами математики (лише Аr (Cl) i Ar (Rb) заокруглюються до десятих!).
- Молекулярна та відносна молекулярна (Мr) маси речовин.
-
Молекулярна маса – це маса однієї молекули певної речовини. Відносна молекулярна маса (Мr) – це фізична величина, що показує, у скільки разів маса певної молекули більша за
 маси атома Карбону – 12.
маси атома Карбону – 12.
- Одиниць вимірювання Мr немає – це безрозмірна величина, так як і Аr.
- Щоб знайти Мr речовини, потрібно знайти суму Аr елементів, які є у цій речовині.
№1.
- Mr (N2) = 2Ar (N) = 2*14=28.
- Mr (H2SO4) = 2Ar (H) + Ar (S) + 4Ar (O) = 2*1+32+4*16 = 2+32+64 = 34+64 = 98.
- Mr (Li2O) =
- Mr (MnSO4) =
- Mr (Ba3(PO4)2) =
- Mr (CaCO3) =
- Mr (BeO) =
- Mr (Cl2O7) =
- Mr (NaOH) =
- Mr (Al(OH)3) =
- Mr (Ca(OH)2) =
- Mr (HClO4) =
- Mr (H2SO3) =
- Mr (H3PO4) =
- Класифікація речовин.
-
За походженням.
- Неорганічні (оксиди, основи, кислоти і солі);
- Органічні (всі інші).
-
За складом.
-
Прості.
- Метали;
- Неметали;
- Складні (речовини неорганічної і органічної хімії).
-
Прості.
- За структурними частинками (Йонні, молекулярні і атомні).
- Валентність.
- Валентність – це властивість атомів сполучатися з певною кількістю таких самих або інших атомів, утворюючи речовини.
- За одиницю валентності прийнято значення валентності атома Гідрогену – І.
- Валентність позначається римськими цифрами зверху над ХЕ та зноситься навхрест у вигляді індексів для складання формул (індекс 1 не пишиться, наприклад CO2, H2O, HCl).
- Валентність буває постійна та змінна.
-
Постійну валентність мають ХЕ з ІА- ІІІА групи, значення якої дорівнює номеру групи, а також F, Zn, O як виключення.
- IA – I + F;
- IIA – II + O, Zn;
- IIIA – III.
- Всі решта ХЕ мають змінну валентність.
-
Змінна валентність для ХЕ IVA – VIIA групи:
- IV – IV, II;
- V – V, III;
- VI – VI, IV, II;
- VII – VII, V, III, I.
- Для ХЕ VІІІА групи валентність – не розглядається.
- Максимальна валентність дорівнює номеру групи ХЕ.
- У сполуках з Оксигеном, елементи виявляють свою максимальну валентність – SO3 (S – VI – валентний).
- У сполуках з Гідрогеном – мінімальну, крім ХЕ ІVА групи (СН4, де С – ІV – валентний).
- Як з Гідрогеном так і з металічними елементами (мінімальна валентність) – MgS, де Mg та S – мають валентність ІІ.
- Для ХЕ побічної підгруп(синіх) дані правила – не застосовуються!
№2.
Охарактеризуйте карбон за поданим планом.
- Символ, назва і вимова (С – Карбон(це)).
- Група, підгрупа (ІVА група).
- Період, ряд (2 період, 2 ряд).
- Порядковий номер (6).
- Відносна атомна маса (Ar(C) = 12).
- Валентність, яку має елемент (ІІ, ІV).
- Метал чи неметал (Неметал).
- Вищий оксид (СО2).
- Летка сполука з Гідрогеном (СН4).
- Формула і назва простої речовини (С – вуглець, графіт і алмаз).
«Домашнє завдання охарактеризувати Fe, Mg i F за даним планом і доробити №1 (щоб, не витрачати час уроку на це завдання) у зошиті».
Середня оцінка розробки
Оцінки та відгуки
-
спасибо большое
docx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку
