Позакласний захід "Цікаві досліди"
![]()
Цікаві хімічні досліди
Дослід. У насичений розчин сірки в бензені або толуені занурюють стрічку мідної бляхи чи мідну платівку. Занурена поверхня металу вмить чорніє. Якщо ж мідь залишити в розчині сірки на кілька діб, а то й на цілий тиждень, - вона зникне, бо сірка повністю «з’їдає» метал. Натомість у стаканчику знайдемо чорні із синюватим відблиском кристали купрум(І) сульфіду [17]:
2Cu + S = CU2S. (3.1)
Цю саму реакцію можна провести інакше. У колбі нагрівають до кипіння сірку, а потім в її пару вносять пучок попередньо підігрітих мідних дротинок. У сірковій парі мідь спалахує та енергійно згоряє. При цьому утворюється чорний дим купрум(І) сульфіду.
У давнину соду добували з води содових озер, а також з попелу солончакових рослин та морських водоростей [17].
Поташ добували з попелу, що лишався після спалювання деревини. Так, головним продуктом, який Росія у XVI—XVIII ст. вивозила за кордон, був поташ. Для його добування по-хижацькому вирубувались, а потім спалювались величезні лісові масиви.
Багато калію витягують з грунту картопля, буряки, помідори, баклажани, кукурудза, а найбільше - соняшник. Зокрема, у золі соняшникового бадилля міститься до 50% поташу. На заняттях хімічного гуртка можна спробувати виділити з попелу чистий К2СО3. Для цього користуються доброю його розчинністю.
Дослід. Соняшниковий попіл збовтують з однаковою за масою кількістю гарячої води, дають відстоятись і відфільтровують водну витяжку. Останню випарюють насухо у порцеляновій чашці або стакані. При цьому одержують сірий порошок, що містить чимало домішок. Для очистки його розчиняють в однаковій за масою кількості гарячої (50-60°С) води і відфільтровують твердий залишок. Після випарювання розчину вдається виділити дуже чистий К2СО3
Дослід. У дні високої залізної бляшанки - місткістю 0,5-1 л шилом або цвяхом пробивають невеликий отвір. Отвір щільно закривають кусочком сірника і бляшанку наповнюють воднем, витаскуючи з неї повітря. Газоподібний водень слід пропускати 5-6 хв. Бляшанку ставлять на стіл і підпалюють кусочок сірника палаючою скіпкого або свічкою, прикріпленого до дротини. Сірник згоряє і підпалює водень, що витікає з бляшанки через отвір. Водень горить майже безбарвним полум’ям. Та ось, через кілька хвилин чується протяжний свист, а потім - гучний вибух, від якого бляшанка підстрибує і перевертається [17].
Це явище пояснюється досить просто. Водень, що виривається назовні, згоряє спокійним безбарвним полум’ям. Натомість у бляшанку знизу надходить повітря. І в той момент, коли об’ємне співвідношення між воднем і киснем повітря становить 2 : 1, суміш вибухає внаслідок розгалуженої (лавинної) ланцюгової реакції:
Н2 + О2 ^ 2НО’, НО’ + Н ^ Н2О + Н’, (3.2)
Н’ + О2 ^ НО’ + [О], [О] + Н2 ^ НО’ + Н’ і т. д. (3.3)
При цьому розвивається висока температура, яка і спричиняв раптове розширення значного об’єму водяної пари.
Описаний дослід слід ретельно проробити кілька разів, щоб на вечорі цікавої хімії він виглядав ефектно. Можна також точно вказати час вибуху, визначивши його секундоміром з попередніх дослідів.
Дослід. У стакан місткістю 500 мл наливають води майже по вінця і всипають 1-2 чайні ложки КСЮ3, який у воді розчиняється мало. Потім добавлять кілька маленьких кусочків білого фосфору (брати тільки пінцетом або щипцями). Лійку з довгим кінцем закріплюють у штативі і занурюють у розчин так, щоб кінець трохи не торкався дна. У лійку невеличкими порціями вливають концентровану H2SO4. Як тільки кислота торкається КСЮ3, лунає тріск, рідина па дні жовтіє (виділяється. СЮ2), фосфор підстрибує під водою і яскраво згоряє. Великі порції H2SO4 добавляти небезпечно [17].
На вечорі цікавої хімії можна з успіхом продемонструвати «вавілонське чудо» [17].
Дослід 1. У стакан місткістю 1 л наливають 500 мл 1-2%-вого лужного розчину люмінолу і 400 мл 3%-вого розчину Н2О2 і всипають пучечок оранжево-червоних кристалів K3[Fe(CN)6]. До суміші добавляють також трохи лугу. У темряві розчин світиться яскравим блакитним сяйвом протягом кількох хвилин. Дуже гарно виглядає переливання рідини з одного стакана в інший. Коли розчин підкислювати кислотою - свічення зникає, коли доливати лугу - воно з’являється знову.
Дослід 2. У великий скляний кристалізатор кладуть гостроверхий уламок криги і обливають його сумішшю лужного розчину люмінолу з гідроген пероксидом. Потім кригу досипають розтертими в ступці кристалами К3[Бе(С^6]. Виникає дуже ефектна і вражаюча картина - «айсберг», що сяє блакитним світлом.
Дослід 3. Одну руку змочують лужним розчином люмінолу і Н2О2, а другу — розведеним розчином K3[Fe(CN)6] і ретельно труть одна об одну. Руки «спалахують» і світяться блакитним сяйвом.
Дослід 4. У колбу місткістю 500 мл всипають 35 г сухого КОН і 0,100,15 г люмінолу, потім вливають 30 мл диметилсульфоксиду, .попередньо висушеного безводним N^SO.i. Затикають колбу гумовим корком і сильно струшують. Невдовзі з’являється ясне блакитне сяйво, яке весь час підсилюється. Якщо свічення починає слабнути, відкривають колбу, впускають туди порцію свіжого повітря і свічення знову стає дуже яскравим. Цю хемілюмінесцентну реакцію можна демонструвати багато разів підряд.
Дослід 5. У колбочку місткістю 50 мл наливають 10 мл 10%-вого розчину пірогалолу і стільки ж 35-40%-вого розчину формальдегіду (формаліну). Потім до цієї суміші доливають 20 мл 30%-вого Н202 (пергідролю). З’являється червонувато-жовте свічення.
Дослід 6. Розчиняють невеликий кусочок білого фосфору (брати тільки пінцетом) в сірковуглеці або бензині (поводитись з цими речовинами треба дуже обережно, оскільки вони отруйні і легкозаймисті). Розведеним розчином білого фосфору за допомогою невеликого пензля роблять у темній кімнаті напис на дошці. З’являються «вогняні» знаки.
Дослід 7. Велику круглодонну колбу закріплюють у штативі, на дно її кладуть шар скляної вати, а на вату - кілька кусочків білого фосфору (брати тільки пінцетом). Потім у колбу крізь довгу скляну грубку, що майже сягає дна, пропускають сильний струмінь СО2 з вуглекислотного балону чи апарату Кіппа. Одночасно колбу підігрівають на водяній ванні. При цьому фосфор розплавляється, випаровується, а його пара, підхоплена струминою СО2, біля виходу з отвору колби займається і горить «холодним полум’ям». Щоб переконати в цьому глядачів, тримають у полум’ї руку. Дослід дуже ефектно виглядає в темряві (рис. 3.1).
Дослід 1. Біхроматний вулкан. У фарфоровій ступці ретельно розтирають 50 г оранжево-червоних кристалів біхромату амонію. Порошок (КН4)2Сг2О7 висапають на велику металеву пластинку або аркуш азбестового паперу, надаючи йому форму гірки [19, 20].

Рис. 3.1. Горіння фосфору.
На вершині «вулкана» цвяхом або паличкою роблять лунку і вливають у неї 1-2 мл етилового спирту. Спирт підпалюють сірником і світло в кімнаті вимикають. Від тепла горіння спирту біхромат амонію починає бурхливо розкладатись. При цьому з «кратера» викидається сніп яскравих іскор і «вулканічний попіл» - брудно-зелений Cr2O3, об’єм якого в багато разів перевищує об’єм взятого (МН4)2Сг2О7:
(NH4)2Cr2O7 ^ СГ2О3 + N2 + 4H2O (3.4)
Вперше за розкладом амоній біхромату спостерігав першовідкривач цієї речовини - Рудольф Беттгер (1843 р.).
Існує декілька модифікованих варіантів даного досліду. Наприклад, насипають гору цукрової пудри і роблять в ній заглиблення, в яке засипають амоній біхромат (NH4)2Cr2O7. Біхромат підпалюють. Початок досліду нічим не відрізняється від описаного вище експерименту. Проте хром (ІІІ) оксид Сг2О3, який утворюється в результаті розкладу, є каталізатором окиснення сахарози. Тому якщо в кінці розкладу біхромату суміш перемішати, дослід перейде в другу стадію. Потім майже згорілу, але ще гарячу гору посипають селітрою, при цьому одержують красиві мерехтливі вогні, що роз'їдають масу (рис.3.2).

Рис. 3.2. Біхроматний вулкан.
Дослід 2. Перманганатний вулкан. Велику і широку пробірку закріплюють в штативі майже вертикально. У пробірку насипають 2-3 г дрібно розтертого калій перманганату КМпО4 і обережно піпеткою додають туди 1-2 мл концентрованої сульфатної кислоти H2SO4.
У пробірку з деякими інтервалами вкидають невеликі паперові кульки. Від контакту з сумішшю папір з тріском спалахує, при цьому утворюється бурий дим MnO2 (точніше - MnO2^nH2O) - продукту відновлення Mn2O7 целюлозою паперу.
Час від часу пробірки вистрілюють язики полум'я, йде дим і вилітають бурі пухнасті пластівці (рис. 3.3). Реакції можна виразити рівняннями:
KMnO4 + H2SO4 ^ KHSO4 + НМПО4 (3.5)
(марганцева кислота)
Марганцева кислота під дією конц. H2SO4 розкладається:
2HMnO4 ^ Mn2O7+ H2O (3.6)
в результаті утворюється зелений манган (VII) оксид - Mn2O7, який володіє дуже сильними окисними властивостями і підпалює папір:
4nMn2O7 + (C6H10O5)n = 8nMnO2 + 5nH2O + 6nCO2 (3.7)

Рис. 3.3. Перманганатний вулкан.
Дослід 3. Фератний вулкан. Щоб показати виверження фератного вулкан, змішують 3-5 г залізного порошку або залізної пудри з рівною за масою кількістю сухого калій нітрату KNO3, заздалегідь розтертого в ступці. (Калій нітрат має бути ретельно висушений!). Суміш поміщають в заглиблення гори, зробленої з 4-5 столових ложок сухого просіяного річкового піску. В центрі самої суміші також роблять невелике заглиблення. Далі розжарюють вуглинку в полум'ї газового пальника і кидають її в середину суміші (рис.3.4).
Починається активне горіння з виділенням великої кількості тепла, іскр, білого диму. Маса розжарюється до яскраво-жовтого кольору і дуже нагадує лаву. Якщо вулкан з амоній біхроматом подібний до викиду вулканічного попелу, то ферратний вулкан більше нагадує іншу стадію вулканічного виверження - коли з кратера з'являється лава.
При взаємодії калій нітрату з залізом утворюється калій ферат (VI) КБеОд:
2KNO3 + Fe ^ K2FeO4 + 2NO (3.8)
Неприємним моментом при виконанні досліду є те, що суміш калій нітрату і залізного порошку досить важко підпалити: вона цілком витримує дію полум'я пальника протягом декількох хвилин, тому потрібна розжарена вуглинка достатніх розмірів. Суміш також можна підпалити з допомогою вузького газо-повітряного полум'я (склодувний пальник або піддування повітря в полум'я звичайного пальника через піпетку).
У деяких джерелах рекомендують брати 2 масових частини KNO3 на 1 частину заліза. Проте така суміш запалюється значно гірше.

Рис. 3.4. Фератний вулкан
Дослід 4. Фіолетовий вулкан. Йод реагує з активними металами (наприклад, магнієм і алюмінієм) з ефектним спалахом. При цьому утворюється багато фіолетової або бурої пари йоду .
Дослід є дуже красивим видовищем (рис.3.5).
У фарфоровій ступці змішують половину чайної ложки алюмінієвої пудри або дрібного порошку магнію і чайну ложку заздалегідь розтертого сухого йоду. Суміш збирають гіркою і у вершині її роблять заглиблення, в яке доливають з піпетки 1-2 краплі дистильованої води.
Через декілька секунд над гіркою з'явиться густа бура хмара і фіолетовий дим. Потім відбувається раптовий спалах, і вся суміш вмить розжарюється до білого кольору.
В результаті реакції утворюються алюміній або магній йодиди (А1І3 MgI2), а буре і фіолетове забарвлення диму спричинене частковою сублімацією йоду.
2A1 + 3I2 = 2A1I3 (3.9)
Mg + I2 = MgI2 (3.10)
Всі операції потрібно проводити у витяжній шафі або на свіжому повітрі.
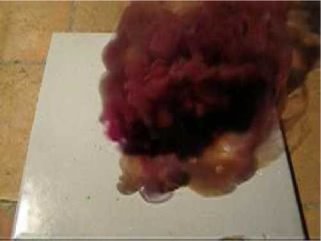
Рис. 3.5. Фіолетовий вулкан.
У великий циліндр на 250 мл наливають 50 мл концентрованої H2SO4. Потім обережно по стінках (щоб рідини не змішалися) додають рівний об'єм етанолу. Кінцеву частину досліду проводять в напівзатіненому приміщенні.
У циліндр невеликими порціями кидають кристали калій перманганату KMnO4. В глибині рідини з тріском спалахують жовті іскри (рис. 3.6). Це відбувається біля поверхні поділу між спиртом і сульфатною кислотою. Появу вогню в рідині можна пояснити енергійним окисненням спирту під дією сильних окисників - Mn2O7 і HMnO4, які утворюються в результаті реакції KMnO4 з концентрованою сульфатною кислотою [17].
Ймовірно в ролі безпосереднього окисника виступає озон, який частково утворюється при розкладі нестійких Mn2O7 і HMnO4:
Mn2O7 ^ 2MnO2 + 3O (3.11)
2O ^ O2 і 3O ^ O3 (3.12)
Виділення бульбашок озонованого кисню добре помітне, коли кристали перманганату опускаються на дно в шарі сульфатної кислоти.

Рис. 3.6. Феєрверк у склянці.
Дослід. На цупкому білому папері малюють лиса і вирізають малюнок ножицями. У хімічному стакані виготовляють насичений розчин К2Сг2О7 У розведеній. H2SO4. Білого лиса повністю занурюють у цей розчин - він стає рудим. Мокрий малюнок вкидають у великий хімічний стакан, завчасно наповнений газоподібний SO2. Рудий лис від задушливого сіркового газу швидко стає блакитним або синім. Така метаморфоза відбувається завдяки окисно-відновному перетворенню. При цьому утворюється хромокалієвий галун [17]:
К2СГ2О7 + 3SO2 + H2SO4 + 2ЗН2О ^ 2КСг^О4)2 42H2O (3.13)
Оранжевий Синій
Найзручніше сірчистий газ можна добути внаслідок взаємодії концентрованої H2SO4 з мідними стружками або №2SO)3 (трохи зволожений водою). Реакції проводять при слабкому нагріванні:
Cu + 2H2SO4 ^ CUSO4 + SO2T + 2H2O (3.14)
Na2SO3 + 2H2SO4 ^ 2NaHSO4 + SO2T + H2O (3.15)
Згаданий вище ефектний дослід можна проробити дещо інакше, а саме: паперового лиса попередньо вкинути в розчин чистої хроматної кислоти. Для цього в дистильованій воді розчиняють темно-червоні блискучі кристали СгО3 (сильна отрута!). Потім білого паперового лиса занурюють в оранжево-червоний розчин Н2СгО4 - він стає жовто- оранжевим. Після цього його обкурюють сірчистим газом, як описано вище:
C ї(). + H2O ^ Н2СЮ4 (3.16)
SO2 + H2O ^ H2SO3 (3.17)
Н2СЮ4 + 3 H2SO3 ^ Cr2(SO4)3 + 5 H2O (3.18)
Остання реакція цікава тим, що тут внаслідок взаємодії двох кислот утворюються сіль і вода, як і в реакціях нейтралізації.
Фараоновими зміями називають цілий ряд реакцій [19, 20], які супроводжуються утворенням пористого продукту з невеликого обсягу реагуючих речовин. Ці реакції супроводжуються бурхливим виділенням
газу. У підсумку виглядає реакція так, ніби з суміші реагентів виповзає велика змія і повзе по столу, як справжня.
Термічний розклад мерурій(ІІ) роданіду відбувається за рівнянням:
2 Hg(SCN)2 ^ 2 HgS + CS2 + C3N4 (3.19)
![]()
![]()
Під час нагрівання меркурій(ІІ) роданіду утворюються чорна сіль - меркурій (ІІ) сульфід, карбон нітрид жовтого кольору і карбон дисульфід CS2, який на повітрі спалахує і згоряє, утворюючи карбон діоксид CO2 і сульфур діоксид SO2.
Карбон нітрид стає пористим від утворених газів, у русі він захоплює чорний меркурій(ІІ) сульфід, і виходить жовто-чорна пориста маса.
У результаті з шматочка меркурій(ІІ) роданіду вилазить велика «змія» чорно-жовтого кольору, схожа на вужа, а то й не одна. Блакитне полум'я, з якого виповзає «змія» - це полум'я палаючого сірковуглецю CS2. З 1 г амоній тіоціанату і 2,5 г меркурій(ІІ) нітрату в умілих руках можна одержати змію довжиною 20-30 см.
![]()

Спосіб 1. Змішують 10 г калій біхромату K2Cr2O7, 5 г калій нітрату KNO3 і 10 г цукру (сахарози) C12H22O11. Потім розтирають суміш в ступці і зволожують етиловим спиртом або колодієм (він продається в аптеці). Потім цю суміш спресовують в скляній трубочці діаметром 5-8 мм.
Отриманий стовпчик виштовхують з трубочки і підпалюють з одного кінця. Спалахує ледь помітний вогник, з-під якого починає виповзати спочатку чорна, а потім зелена «змія». Стовпчик суміші діаметром 4 мм горить зі швидкістю 2 мм за секунду. При горінні він може подовжитися в 10 разів!

Рис. 3.8. Дихроматна змія.
Реакція горіння сахарози в присутності двох окисників - калій нітрату і калій біхромату - досить складна. Продукти реакції - чорні частинки сажі, зелений хром(Ш) оксид Cr2O3, розплав калій карбонату K2CO3, карбон діоксид і калій нітрит KNO2. Вуглекислий газ CO2 розспушує суміш твердих продуктів і змушує її рухатися.
Спосіб 2. Змішати 1 г амоній біхромату (NH4)2Cr2O7, 2 г амоній нітрату NH4NO3 і 1 г цукрової пудри. Змочити суміш водою, виліпити з неї паличку і висушити на повітрі. Якщо паличку підпалити, з неї в різні боки поповзуть чорно-зелені «змії».
При підпалюванні суміші відбуваються наступні реакції:
(NH4)2Cr2O7 ^ СГ2О3 + N2 + 4H2O, (3.21)
NH4NO3 ^ N2O + 2H2O, (3.22)
C12H22O11 + 6O2 ^ 6CO2 + HH2O + 6C. (3.23)
При розкладі амоній біхромату утворюються азот N2, водяна пара і
зелений хром(Ш) оксид Cr2O3. Реакція протікає з виділенням тепла. В реакції термічного розкладу амоній нітрату виділяється безбарвний газ - нітроген(І) оксид, який вже при слабкому нагріванні розкладається на кисень і азот. Горіння цукру дає ще один газ - карбон діоксид, до того ж відбувається обвуглювання - виділення карбону. Великий об'єм газів плюс тверді продукти окиснення - ось секрет «зміїної» поведінки суміші.
Для проведення цього досліду в столову тарілку насипають 3-4 ложки сухого просіяного річкового піску і роблять з нього гірку з заглибленням у вершині. Потім готують суміш, що складається з 1 чайної ложки цукрової пудри і 1/4 чайної ложки натрій гідрогенкарбонату NaHCO3 (питна сода). Пісок просочують 96-98%-м розчином етанолу C2H5OH і в заглиблення гірки насипають приготовану реакційну суміш. Потім гірку підпалюють.
Спирт загоряється. Через 3-4 хвилини на поверхні суміші з'являються чорні кульки, а біля основи гірки - чорна рідина. Коли майже весь спирт згорить, суміш чорніє, і з піску повільно виповзає звивиста товста чорна «гадюка». Біля основи вона оточена «коміром» догораючого спирту.

Рис. 3.9. Чорна «гадюка».
У цій масі відбуваються наступні реакції:
2NaHCO3 ^ Na2CO3 + H2O + CO2, (3.24)
Карбон діоксид, що виділяється при розкладі натрій гідрогенкарбонату і горінні етилового спирту, а також водяні пари розпушують гарячу масу, змушуючи її повзти, як змія. Чим довше горить спирт, тим довшою виходить «змія». Вона складається з натрій карбонату, змішаного з найдрібнішими частинками вугілля, утвореного при горінні цукру.
Замість натрій гідрогенкарбонату можна використовувати амоній нітрат NH4NO3. У тарілку насипають 3-4 ложки просіяного річкового піску, роблять з нього гірку з заглибленням у вершині і готують реакційну суміш, що складається з 1/2 чайної ложки амоній нітрату і 1/2 чайної ложки цукрової пудри, ретельно перетертих в ступці. Потім у заглиблення гірки наливають 1/2 столові ложки етилового спирту і насипають 1 чайну ложку приготованої нітратно-цукрової суміші. Тепер, якщо підпалити спирт, на поверхні суміші відразу ж з'являються чорні кульки обвугленого цукрового піску, і слідом за ними виростає чорний блискучий і товстий «черв'як». Якщо нітратно-цукрової суміші було взято не більше 1 чайної ложки, то довжина черв'яка не перевищить 3-4 см, а його товщина залежиме від діаметра заглиблення гірки.

Рис. 3.10. Нітратний черв’як.
Поява черв'яка спричинена взаємодією амоній нітрату з цукром, яка виражається наступним рівнянням:
«Черв’яка» приводять у рух гази: азот N2, карбон діоксид CO2 і пари води.
Цей дослід - вражаюче видовище. Цукрову пудру масою 75 г поміщають у високий скляний стакан, змочують її 5-7 мл води і перемішують довгою скляною паличкою. До вологого цукру приливають по цій паличці 30-40 мл концентрованої сульфатної кислоти. Потім суміш швидко перемішують скляною паличкою і залишають у стакані.
Через 1-2 хвилини вміст склянки починає чорніти, розпушуватися і у вигляді пухкої маси підніматися, захоплюючи вгору скляну паличку. Суміш в стакані сильно нагрівається, навіть трохи димить, - і повільно виповзає із склянки.
Сульфатна кислота відбирає від цукру воду, руйнуючи його молекулярну структуру, і окиснює його, перетворюючись при цьому в сульфур діоксид. При окисненні цукру одержують карбон діоксид. Ці гази розпушують утворене вугілля і виштовхують його зі склянки разом з паличкою.

Рис. 3.11. «Чорний удав» зі склянки.
Рівняння цих хімічних перетворень виглядає так:
C12H22O11 + 2H2SO4 ^ 11C + 2SO2 + CO2 + 13H2O. (3.26)
Карбон і сульфур діоксиди разом з парами води збільшують об’єм
реакційної маси і змушують її підніматися вгору у вузькому стакані.
Для цього досліду знадобиться уротропін (гексаметилентетрамін - (CH2)6N4). Таблетки уротропіну можна купити в аптеці - це антисептичний препарат. Підійде також «твердий спирт» (сухе пальне) - його можна придбати в господарському магазині.
Щоб зробити «змію», потрібно виконати наступні дії. Одну таблетку «твердого спирту» або аптечного уротропіну покладіть на блюдце і 3-4 рази просочіть концентрованим водним розчином амоній нітрату NH4NO3, капаючи його з піпетки, а потім висушуючи. Кожен раз треба наносити по 510 крапель (0,5 мл розчину).
Висушування таблеток - найважча частина досліду: за кімнатної температури на повітрі воно триває занадто довго. Але підвищувати температуру для прискорення процесу не можна - уротропін розкладається за високої температури. Тим більше не можна сушити таблетки на відкритому вогні: вони можуть спалахнути.
Просочену і висушену таблетку слід покласти на блюдце і підпалити з одного боку. Після цього з'являться чорні кульки киплячої рідини, які зливаються разом, справляючи враження зростання «хвоста». Він згинається, а за ним з вогню виростає товсте тіло «змії». «Змія» росте, впирається хвостом у блюдце, починає згинатися.

Рис. 3.12. Уротропінова змія.
Розклад уротропіну в суміші з амоній нітратом призводить до утворення пористої маси, що складається з вуглецю, і великої кількості газів - карбон діоксиду, азоту і води:
(СН2Ш + 2NH4NO3 + 7О2 > 10C + 6N2 + 2CO2 + I6H2O (3.27)
Це найпростіший і безпечний спосіб отримання фараонової змії - для цього достатньо піднести до полум'я таблетку кальцій глюконату, який продається в кожній аптеці. Можна покласти таблетку кальцій глюканату на таблетку сухого спирту і підпалити його. З таблетки виповзе світло-сіра «змія» з білими плямами, об’єм якої набагато перевищує об’єм вихідної речовини - вона може досягти довжини 10-15 см.
Розклад кальцій глюконату супроводжується утворенням кальцій оксиду, вуглецю, вуглекислого газу і води.
(СН2ОН-(СНОН)4-СОО)2Са + О2 >ЮС + 2СО2 + СаО + 1ІН2О. (3.28)
Світлий відтінок «змії» надає кальцій оксид.

Рис. 3.13. Глюконатна змія.
Дослід. На азбестовому картоні чи металевій пластинці змішують приблизно однакові кількості натрій пероксиду і тирси. Цій суміші надають форму гірки, її вершину притискують пальцем і в ямку пускають з піпетки 1 - 2 краплі води. Суміш спалахує і згоряє. Спочатку вода реагує з Na2O2 — утворюються натрій гідроксид та безводний гідроген пероксид [17]:
Na2O2 + 2H2O (хол.) ^ 2NaOH + H2O2. (3.29)
Безводний Н2О2 - надзвичайно сильний окисник і підпалює деревину. Потім горіння підтримується за рахунок безпосередньої реакції натрій пероксиду з деревиною.
Дослід. Фарфорову чашку накривають двома-трьома аркушами фільтрувального каперу. У пробірку насипають 1-2 г кристалів АgNO3 і нагрівають її у полум'ї газового пальника чи спиртівки. За 218°С сіль плавиться і перетворюється на блідо-зеленувату рідину. Розплавлений АgNO3 краплю за краплею виливають на папір. Він умить спалахує і горить. На дні чашки рідка сіль гусне і кристалізується у вигляді сірої маси (AgNO3 з домішкою розпорошеного металічного Ag) [17].
Розплавлений AgNO3 - надзвичайно активний окисник, легко розкладається:
2AgN)3 = 2Ag + 2N)2 + )2 (3.30)
а тому він і газоподібні продукти його розкладу енергійно окиснюють клітковину.
Хроматний осінній сад [19, 20].
Хімічний осінній сад із жовтою «травою» і золотистим «листям» виростає, якщо у водний розчин, що містить 30 - 50 г калій хромату К2СгО4 в 1 л води, додати кристал дигідрату барій хлориду ВаС12^2Н2О. У жовтому розчині відбувається осадження барій хромату ВаСгО4:
К2СЮ4 + ВаСІ2 ^ ВаСгОД + 2KC1 (3.31)
Тонкі нитки жовтого кольору, схожі на траву, з'являться і у водному розчині плюмбум(ІІ) нітрату Pb(NO3)2, що містить 100 - 150 г солі в 1 л води, якщо в нього помістити декілька кристалів калій хромату . В цьому випадку «трава» це малорозчинний плюмбум(ІІ) хромат PbCrO4:
К2СЮ4 + Pb(NO3)2 ^ PbCrO4^ + 2KNO3 (3.32)
Хімічні «водорості» [19, 20].
Для цього досліду потрібно взяти рідке скло - натрій полісилікат з умовною формулою Na2SiO3, розбавити його 2-3-х кратною кількістю води і налити в банку. Далі додати в розчин кристали різних солей: сульфатів (або хлоридів, нітратів) Cu, Fe(II), Fe(III), Cr(III), Co, Ni, Mn, Mg, Zn, Pb. Кількість кожної солі - «на кінчику шпателя». Солі можна брати як разом, так і окремо. Коли кристали опустяться на дно, почнеться ріст «водоростей». Використовуючи солі різних металів, можна виростити «водорості» різноманітних квітів (рис. 3.14). Наприклад, солі Cu(II) дають «водорості» світло-синього кольору, Co - фіолетового, Ni - ясно-зеленого, Zn, Mg і Pb - білого, Fe (III) - бурого. «Марганцеві водорості» спочатку забарвлюються в білий колір, але потім стають бурими (в результаті окиснення Mn (II)).

Рис. 3.14. Хімічні водорості.
Інший варіант досліду. У високу скляну банку потрібно налити 1 л рідкого скла додати 0,5-0,7 л води і перемішати. Після цього потрібно одночасно з двох склянок вилити в цю банку водні розчини хром (III) сульфату Cr2(SO4)3 і ферум (III) хлориду FeCl3. В результаті виростуть силікатні «водорості» жовто-зеленого кольору, які, химерно переплітаючись, опускаються зверху вниз.
Ріст «водоростей» - наслідок утворення ферум, купрум і хром силікатів, що утворюються в результаті реакцій обміну, рівняння яких умовно можна записати таким чином:
Cr2(SO4)3 + 3Na2SiO3 ^ С^іОзЬ + 3N2SO4 (3.33)
2FeCl3 + 3Na2SiO3 ^ Fe2(SiO3)4 + 6NaCl (3.34)
Додавши в ту ж банку краплями розчин купрум (II) сульфату CuSO4, акваріум можна заселити химерними «морськими зірками» і круглими колючими «морськими їжаками» синього кольору:
CuSO4 + Na2SiO3 ^ CuSiO3^ + N2SO4 (3.35)
В табл. 3.1 приведені концентрації розчинів для утворення водоростей.
Таблиця 3.1
Рецепти «хімічних водоростей»
|
Розчин |
Концентрація розчину, % |
Кристали |
||
|
K4[Fe(CN)6] |
3-5 |
CdCl2, ZnCl2, MnCl2, FeCl2, CoCl2, NiCl2, FeCl3 |
||
|
K3[Fe(CN)6] |
3-5 |
ZnCl2, FeCl2 |
||
|
CdCl2, CUSO4 |
3-5 |
K3 |
[Fe(CN)6] |
|
|
CUSO4 |
10-15 |
K3 |
[Fe(CN)6] |
|
|
NiCl2, Pb(NO3)2 |
3-5 |
K4 |
Fe(CN)6 |
|
|
К2СЮ4 |
3-5 |
BaCl2 |
||
|
N2B4O7 |
3-5 |
АІСІз, Pb(NO3)2 |
||
|
N2CO3 |
3-5 |
BaCl2, CaCl2 |
||
|
N2CO3 |
5-20 |
Sr(NO3)2, Ba(NO3)2 |
||
|
N2CO3 |
10-20 |
BaI2, CdI2 |
||
|
Pb(NO3)2 |
11 |
KI, CdI2 |
||
|
Cdl2 |
насичений |
Pb(NO3)2 |
||
|
Nal |
10 |
Pb(NO3)2 |
||
|
Na3PO4 |
2-4 |
MgCl2 |
||
|
Na3PO4 |
7-15 |
C0CI2, ZnCl2, Sr(NO3)2, Ba(NO3)2,Pb(NO3)2 |
||
|
Pb(NO3)2 |
5-10 |
ЖРО4 |
||
|
Pb(NO3)2 |
10-15 |
К2СЮ4 |
||
|
Pb(NO3)2 |
20 |
(NH4)2Cr2O4 |
||
|
ЖСЮ4 |
5-20 |
Pb(CH3COO)2 |
||
|
Pb(CH3COO)2 |
10-20 |
К2СГО4, К2СГ2О4 |
||
|
K2HPO4 |
3-4 |
CdCl2, CaCl2, FeCl2, BaCl2, ZnCl2 |
||
|
К2СГ2О4 |
3-20 |
Pb(NO3)2, Pb(CH3COO)2 |
||
|
NaOH |
25 |
C0CI2 |
||
|
ЖСЮ4 |
4 |
MnCl2, Cd(NO3)2, Sr(NO3)2, BaCl2 |
||
Дуже барвистий експеримент, який, по суті, є різновидом дослідів «хімічні водорості».
Для його проведення потрібно налити в склянку розчин плюмбум (ІІ) ацетату (концентрацією близько 10%), підкисненого нітратною або мурашиною кислотою. На поверхню розчину акуратно поміщають півшпателя кристалів KI (кристали повинні плавати на поверхні, а не падати на дно). Для цього добре використовувати кристали пластинчастої форми. KI розміщують таким чином, щоб кристали покрили 50-80% поверхні розчину. Необхідно ретельно уникати навіть невеликих струсів склянки і столу, на якому вона стоїть. Інакше дослід може не вийти.
Кристали, які потрапили на поверхню розчину вмить забарвлюються в жовтий колір - внаслідок утворення плюмбум (ІІ) йодиду:
2KI + Pb(NO3)2 ^ РЬІ2^ + 2KNO3 (3.36)
Частина кристалів все-таки опуститься на дно, утворюючи жовтий осад.
Частинки KI, які залишаться на поверхні, даватимуть насичений розчин, який опускаючись на дно, набуває жовтого забарвлення. В результаті з поверхні розчину вниз будуть рости утворення, які нагадують жовті сталактити (рис. 3.15).

Рис. 3.15. «Золоті сталактити».
Дослід. У колбу місткістю 500 мл наливають 200 мл дистильованої води, всипають у неї 2 г агар-агару, 0,65 г РЬ(СН3СОО)2. і добавляють 10-20 крапель льодяної СН3СООН. Вміст колби нагрівають до кипіння і кип’ятять до повного розчинення агар-агару. Теплий розчин виливають у стакан місткістю 200 мл, і після того як у стакані розчин перетвориться на драглі, у нього вдавлюють на глибину 1-2 см одну велику гранулу металічного цинку. Уже наступного дня можна бачити, що гранула-«насінина» «проросла» і в стакані з’явилось свинцеве «дерево», яке все більше розростається в усі боки.
Явище пояснюється так. Металічний цинк витискує з плюмбум(ІІ) ацетату вільний метал, який виділяється у вигляді великих гіллястих утворень:
Zn + РЬ(СНзСОО)2 ^ Zn(CH3COO)2 + Pb^. (3.37)
У водному розчині ця реакція відбувається досить швидко, а в середовищі агар-агарового «холодцю» - повільно.
Відомо, що хамелеон від подразнення чи зміни зовнішнього середовища змінює колір своєї шкіри [17].
У хімії мінеральним «хамелеоном» називають метал манган, сполуки якого залежно від умов реакції швидко змінюють своє забарвлення. Так, солі мангану(ІІ), наприклад МпС12-4Н2О, Mn(NO3)2-6H2O, MnSO4-7H2O тощо, світло-рожевого кольору. Якщо як до їх розчинів добавити лугу, випадає білий осад манган(ІІ) гідроксиду:
Mn2+ + 2ОН- ^ Мп(ОН)2 Ф, (3.38)
який на повітрі швидко буріє;
2Мп(ОН)2 + O2 + 2Н2О ^ 2Мп(ОН)4. (3.39)
Дослід. У хімічний стакан наливають розведеного розчину якої-небудь солі мангану(ІІ), підкислюють його концентрованою HNO3, всипають невелику кількість коричневого РЬО2 і нагрівають. При цьому майже безбарвний розчин стає фіалковим:
2Мп2+ + 5РЬ02 + 4Н+ ^ 2Мп04- + 5РЬ2+ + 2Н20. (3.40)
Дослід. У три стакани наливають фіалкового розчину КМпО4. У перший добавляють розведеної H2SO4, а в третій - концентрованого розчину КОН, Потім у кожний стакан добавляють розчину K2SO3, або NaNO2. При цьому фіалкове забарвлення аніона МпО4- скрізь зникає, натомість у першому стакані розчин знебарвлюється:
- МпО4- + 5SO32- + 6Н+ ^ 2Mn2+ + 5SO42- + 3Н2О, (3.41)
у другому - випадає бурий осад:
2 МПО4- + 3SO32- + 5 Н2О ^ 2Мп(ОН)4 Ф + 3 SO42- + 20Н-, (3.42)
у третьому - розчин вмить зеленіє:
- МпО4- + NO2- + 20H- ^ 2MnO42- + N03- + Н2О. (3.43)
Дослід. Якщо висипати твердий залишок після прожарювання КМпО4 у воду, то спершу утворюється розчин зеленого кольору, який швидко переходить у синьо-фіалковий, потім у фіалковий і, нарешті, у малиновий. Одночасно випадає бурий осад.
Якщо ж всипати залишок після прожарювання КМпО4у концентрований луг, то зелений колір лишається незмінним, бо манганати (VI) і манганати (V) стійкі лише в сильно лужному середовищі. Після підкислення розчину аніони МпО4- і MnO42- вмить самоокиснються - самовідновлюються:
Дослід. До лужного розчину К2МпО4 і К3МпО4 в циліндрі обережно вливають по його стінці концентрованої H2SO4. При цьому розчин змінює зелене забарвлення на малиново-фіалкове, починаючи знизу і не відразу, а поступово, набираючи різноманітних відтінків.
Дослід. Приготуйте два розчини. Склад першого: 3,9 г калій йодату KIO3 на літр води. Склад другого: 1 г натрій сульфіту Na2SO3, 0,94 г концентрованої сульфатної кислоти (обережно!) і небагато - кілька мілілітрів крохмального клейстеру - теж на літр води. Обидва розчини безбарвні і прозорі [19].
Відміряйте по 100 мл обох розчинів і швидко, краще при перемішуванні, прилийте другий до першого. Дослід зручніше демонструвати удвох - нехай ваш товариш відразу ж почне відлік часу за секундоміром. Через шість-вісім секунд (точний час залежить від температури) рідина миттєво забарвиться в темно-синій, майже чорний колір.
Тепер відміряйте знову 100 мл другого розчину, а 50 мл першого розбавте водою рівно вдвічі. З секундоміром в руках ви переконаєтеся, що час, що минув з моменту зливання розчинів до їх фарбування, теж збільшиться в два рази.
Нарешті, змішайте 100 мл другого розчину з 25 мл першого, розведеного водою вчетверо, тобто до тих же 100 мл. «Хімічний годинник» буде працювати в чотири рази довше, ніж у першому досліді.
Цей дослід демонструє один з фундаментальних хімічних законів - закон дії мас, згідно з яким швидкість реакції пропорційна концентраціям реагуючих речовин. Але чому розчини забарвлюються миттєво після паузи, а не рівномірно та поступово, як цього слід очікувати?
Сульфатна кислота в розчині витісняє йодат - і сульфіт-йони з їх солей. При цьому в розчині утворюється йодидна кислота HI, яка майже миттєво вступає у взаємодію з йодатною кислотою HIO3. У результаті виділяється вільний йод. Він і дає кольорову реакцію з крохмалем.
Якби все відбувалося саме так, то розчин і темнів би поступово, у міру виділення йоду. Однак паралельно йде ще один процес: сульфітна кислота H2SO3 реагує з вільним йодом і знову утворюється йодидна кислота. Ця реакція йде швидше, ніж попередня, і йод, не встигнувши пофарбувати крохмаль, знову відновлюється до ІО3-. У ході реакції сульфітна кислота безперервно витрачається, і як тільки вся вона перетвориться в сульфатну, йоду ніщо вже не буде заважати реагувати з крохмалем. І тоді розчин миттєво забарвиться по всьому об'єму.
Розбавляючи розчин вдвічі і вчетверо, зменшується концентрація калій йодату, і швидкість реакції зменшується пропорційно.
- Савчин М. Шкільний хімічний експеримент як система та його дидактичне забезпечення// Педагогічна Думка. - 2003.- № 1-2.- С.36-44.
- Книш Л.А. Застосування хімічного експерименту при вивченні хімії // Хімія. - 2004. - №4/52/. - С. 2-6.
- Буринська Н.М. Хімія, 7 кл.:підруч. для загальноосвіт. навч. закл./ Н.М.Буринська. - К.:Ірпінь: ВТФ «Перун», 2007. - 112с.
- Куленко О.А. Шкільний хімічний експеримент в умовах реформування навчально-виховного процесу з хімії // Хімія.- 2009.- №7.- С.36-39.
- Беспалов П.И. Как сделать безотходным школьный химический кабинет / П.И.Беспалов.А.А., Гамаюнова // Химия в школе. - 2000.- №5.- С.31-33.
- Хімічний експеримент: Теорія і практика. - К: Шкільний світ, 2008 - Спеціальний номер газети « Хімія» - 2008.- №1 / 541/.- С.48.
- Симоненко С. Шкільний хімічний експеримент як основа розвитку творчої діяльності учнів // Хімія. - 2008. - №13 /553/.- С.22-24.
- Коник М. Демонстраційний експеримент у системі засобів навчання /на прикладі вивчення хімії // Матеріали звітних наукових конференцій кафедри педагогіки. - Л. 2005. - Вип. 4, С. 20-24.
- Грабовий А. Естетика шкільного хімічного експерименту// Біологія і хімія в школі. - 2007.- №1. - С.17-20.
- Гаврилюк І. Хімічний експеримент як засіб розвитку логічного мислення учнів // Хімія. - 2006. - №11 /479/. - С.11-17.
- Романенко Ю., Олійник М. Технологія моніторингу навчання: Хімічний експеримент // Біологія і хімія в школі. - 2006.- №3.- С.43-45.
- Йосипенко Л. Хімічний експеримент: формування в учнів системного аналітичного мислення // Хімія. - 2010. - № 9 /621/.- С.11-22.
- Грабовий А. Компетентнісний підхід до учнівського хімічного експерименту // Біологія і хімія в школі. - 2006. - №4. - С.13-15.
- Сенюк Н.М. Зошит для лабораторних дослідів та практичних робіт з хімії.
8 клас/ Н.М. Сенюк. - Івано-Франківськ: Симфонія форте, 2014. - 36 с.
- Струць О.В. Хімічний експеримент при навчанні хімії та методика його проведення/ Електронний ресурс
https://docs.google.com/document/d/1ra_K1KjXYoAAnslx7BuMIBNL8uWQjDeq e8-NN9Y9wmg/edit?pli=1
- Яковішин Л.О. Цікаві досліди з хімії: у школі та вдома. - Севастополь: Библекс, 2006. — 176 с. — ISBN 966-8231-36-8.
- http7Лib.iitta.gov.ua/702/1/Тези._Херсон._Міжн._конф.pdf.
- http://www.osvita.org.ua: Загнибіда Н.М. Домашній хімічний експеримент.
- http://chemistryandchemists.narod.ru/
- http://chem.tut.ru


про публікацію авторської розробки
Додати розробку