Презентація "Якісні реакції. Тренувальні вправи 2"




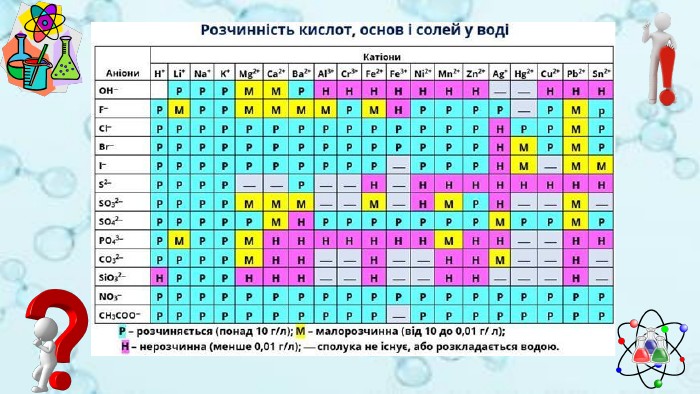
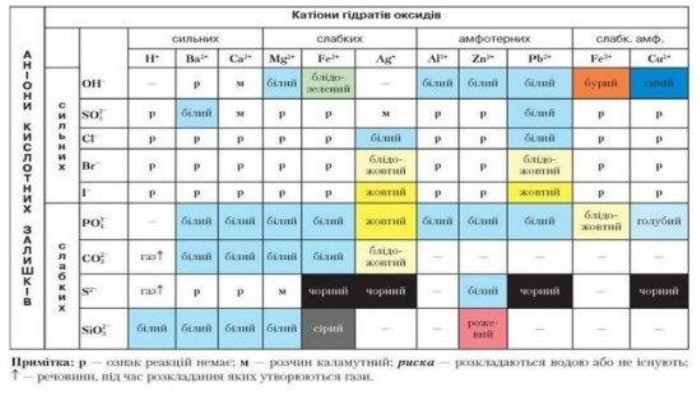














Завдання 1 Визначити якісний склад ферум(ІІ) сульфату. Fe. SO4 = Fe + SO42+2-Реактивом на йони феруму (2+) є гідроксид-аніони. Fe. SO4 + 2 Na. OH = Na2 SO4 + Fe(OH)2↓ Осад зеленого кольору. Реактивом на сульфат-аніони є катіони барію. Fe. SO4 + Ва. Cl2 = Fе. Cl2 + Ва. SO4↓Білий кристалічний осад
Завдання 2 Визначити якісний склад кальцій броміду. Са. Br2 = Ca + 2 Br2+-Реактивом на катіони кальцію є карбонат-аніони. Са. Br2 + Na2 СO3 = 2 Na. Br + Са. СO3↓ Осад білого кольору. Реактивом на бромід-аніони є катіони аргентуму. Са. Br2 + 2 Ag. NO3 = Са(NO3)2 + 2 Ag. Cl ↓Світло-жовтий осад
Завдання 3 Визначити якісний склад ферум(ІІІ) хлориду. Fe. Cl3 = Fe + 3 Cl3+-Реактивом на йони феруму (3+) є гідроксид-аніони. Fe. Cl3 + 3 Na. OH = 3 Na. Cl + Fe(OH)3↓ Осад бурого кольору. Реактивом на хлорид-аніони є катіони аргентуму. Fe. Cl3 + 3 Ag. NO3 = Fe(NO3)3 + 3 Ag. Cl ↓Білий сирнистий осад
Завдання 4 Визначити якісний склад амоній ортофосфату.(NH4)3 PO4 = 3 NH4 + PO4+3-Реактивом на йони амонію є гідроксид-аніони. (NH4)3 PO4 + 3 Na. OH = Na3 PO4 + 3 H2 O + 3 NH3↑Газ із характерним запахом, що забарвлює вологий індикаторний папірець у синій колір. Реактивом на хлорид-аніони є катіони аргентуму. (NH4)3 PO4 + 3 Ag. NO3 = 3 NH4 NO3 + Ag3 PO4 ↓Жовтий осад
Завдання 5 Розрізнити в пронумерованих пробірках розчини нітратів Барію та амонію. Щоб розрізнити розчини речовин, необхідно скористатись якісною реакцією на катіони барію або амонію. Реактивом на катіони барію є сульфат-аніони. Ва(NO3)2 + Na2 SO4 = 2 Na. Cl + Ва. SO4↓Білий кристалічний осад
Завдання 6 Розрізнити в пронумерованих пробірках розчини метасилікату й ортофосфату Натрію. Щоб розрізнити розчини речовин, необхідно скористатись якісною реакцією на метасилікат-аніони або ортофосфат-аніони. Реактивом на метасилікат-аніони є катіони гідрогену. Nа2 Si. O3 + H2 SO4 = Na2 SO4 + H2 Si. O3↓Драглистий осад
Завдання 7 У двох пробірках містяться розчини ферум (ІІ) хлориду та ферум (ІІІ) хлориду. Доведіть експериментально вміст кожної пробірки. Розчин ферум (ІІ) хлориду містить йони Fe, а розчин ферум (ІІІ) хлориду – йони Fe . Щоб визначити вміст кожної пробірки достатньо провести досліди, що виявлять наявність цих йонів2+3+Реактивом на йони феруму (2+) та йони феруму (3+) є гідроксид-аніони. Fe. Cl2 + 2 Na. OH = 2 Na. Cl + Fe(OH)2↓ Осад зеленого кольору, який на повітрі окиснюється і бурієFe. Cl3 + 3 Na. OH = 3 Na. Cl + Fe(OH)3↓Осад бурого кольору
Завдання 8 У двох пробірках містяться розчини солей: амоній хлорид та амоній сульфат. Доведіть, що в обох випадках – це солі амонію. Визначте експериментально склад кожної речовини. Амоній хлорид складається з катіонів амонію та хлорид-аніонів, а амоній сульфат - з катіонів амонію та сульфат – аніонів. Для доведення складу кожної речовини необхідно провести досліди, що виявляють наявність цих йонів. Вміст кожної пробірки розділяємо на три порції й додаємо луг (для виявлення йонів амонію), аргентум нітрат (для виявлення хлорид-аніонів) та барій хлорид (для виявлення сульфат – аніонів). За результатами дослідів робимо висновок про склад кожної речовини.(NH4)2 SO4 + 2 Na. OH = Na2 SO4 + 2 H2 O + 2 NH3↑ NH4 Cl + Na. OH = Na. Cl + H2 O + NH3↑Газ із характерним запахом, що забарвлює вологий індикаторний папірець у синій колір(NH4)2 SO4 + Ва. Cl2 = 2 NH4 Cl + Ва. SO4↓Білий кристалічний осад. NH4 Cl + Ag. NO3 =NH4 NO3 + Ag. Cl ↓Білий сирнистий осад
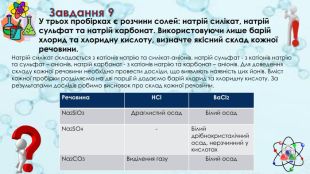
Завдання 9 У трьох пробірках є розчини солей: натрій силікат, натрій сульфат та натрій карбонат. Використовуючи лише барій хлорид та хлоридну кислоту, визначте якісний склад кожної речовини. Натрій силікат складається з катіонів натрію та силікат-аніонів, натрій сульфат - з катіонів натрію та сульфат – аніонів, натрій карбонат - з катіонів натрію та карбонат – аніонів. Для доведення складу кожної речовини необхідно провести досліди, що виявляють наявність цих йонів. Вміст кожної пробірки розділяємо на дві порції й додаємо барій хлорид та хлоридну кислоту. За результатами дослідів робимо висновок про склад кожної речовини.{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Речовина HCl. Ba. Cl2 Na2 Si. O3 Драглистий осад. Білий осад. Na2 SO4-Білий дрібнокристалічний осад, нерзчинний у кислотах. Na2 CO3 Виділення газу. Білий осад
Завдання 10 У трьох пробірках є розчини солей: натрій силікат, натрій сульфат та натрій карбонат. Використовуючи лише барій хлорид та хлоридну кислоту, визначте якісний склад кожної речовини. Спочатку до вмісту пробірок додаємо хлоридну кислоту. Як результат – в одній із пробірок виділятиметься газ (там міститься розчин натрій карбонату), ще в одній випаде драглистий осад (там міститься розчин натрій силікату). У третій пробірці змін не відбуватиметься. Там – розчин натрій сульфату. Щоб довести його якісний склад, додаємо розчин барій хлориду й отримаємо білий дрібнокристалічний (молокоподібний) осад, який не розчиняється в кислотах. Nа2 Si. O3 + 2 HСl = 2 Na. Cl + H2 Si. O3↓Драглистий осад. Nа2 СO3 + 2 HСl = 2 Na. Cl + H2 O + CO2↑Виділяється газ, який спричиняє помутніння вапняної води. Na2 SO4 + Ва. Cl2 = 2 Na. Cl + Ва. SO4↓Білий дрібнокристалічний осад, нерзчинний у кислотах
Завдання 11 У трьох пробірках є розчини: натрій хлорид, натрій гідроксид та хлоридна кислота. Визначте вміст кожної пробірки. У пробірках містяться розчини солі (нейтральне середовище), лугу (лужне середовище), кислоти (кисле середовище). Щоб визначити вміст пробірок, скористаємося одним із індикаторів: лакмус, метилоранж, універсальний індикатор. За зміною забарвлення індикатора робимо висновок про вміст пробірок.
Реакція «бурого кільця»Реа́кція «бу́рого кільця́» — якісна реакція, що широко застосовується в якісному аналізі для визначення присутності нітратів у досліджуваному розчині. Для виконання тесту до аналізованого розчину додається кілька крапель розведеної сульфатної кислоти, його кип'ятять і охолоджують. Після цього додається рівний об'єм розчину сульфату заліза(II) та, обережно, концентрована сульфатна кислота. При наявності нітрат-йонів на межі розділу шарів водного розчину і кислоти утворюється кільце, забарвлене у колір від коричневого до фіолетового.
Висновок. Якісними реакціями називають такі реакції, що дозволяють відповісти на запитання «Чи міститься певна речовина або йон у досліджуваному зразку?»Якісні реакції – це звичайні хімічні реакції, що відбуваються досить швидко і перебіг яких супроводжується певними візуальними змінами, які називають ознаками якісних реакцій. Ознаками якісних реакцій є зміна забарвлення розчину, утворення осаду певного кольору та певної якості або виділення газу, який також може мати (чи не мати) забарвлення або запах.

про публікацію авторської розробки
Додати розробку