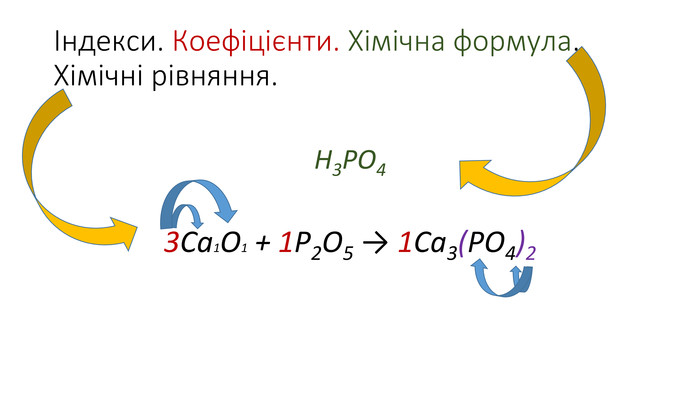
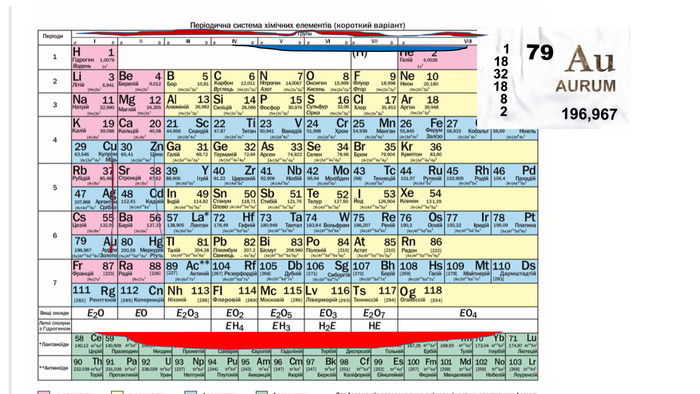
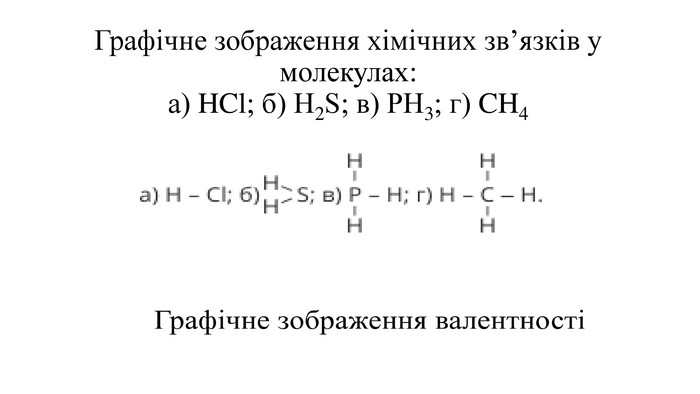
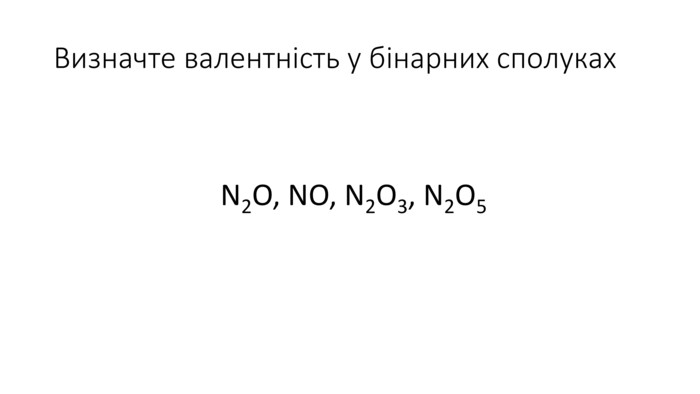
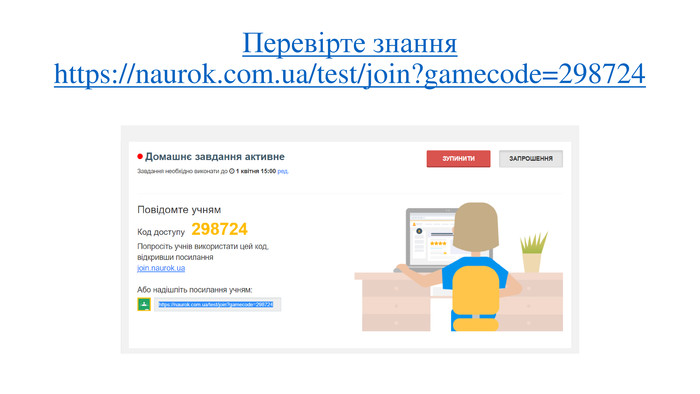
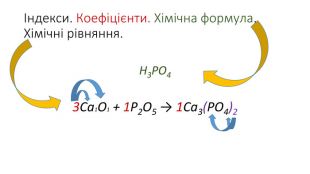
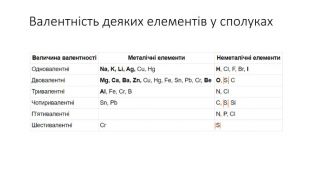
Правила визначення валентності
Про матеріал
Презентація до уроку і доступним поясненням щодо правил складання формул сполук та визначення валентності Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку