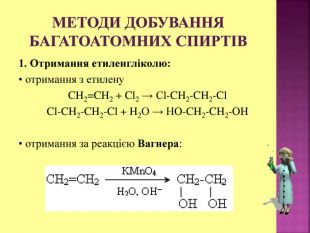
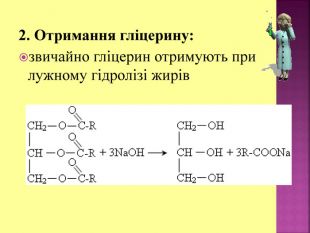
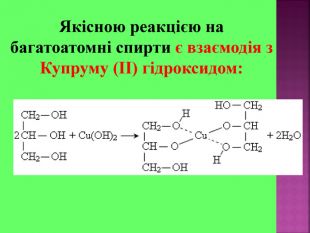
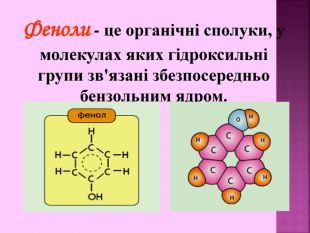
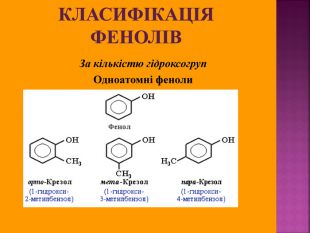
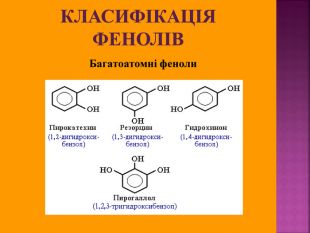
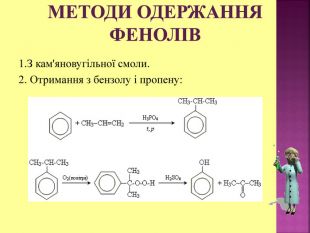
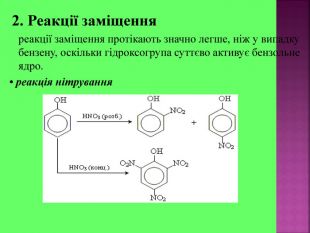
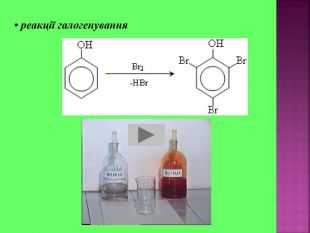
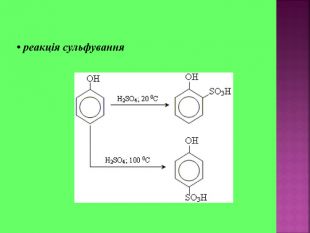
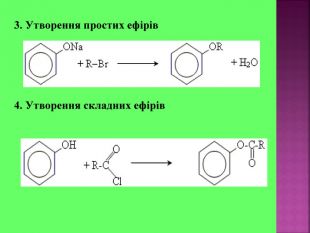
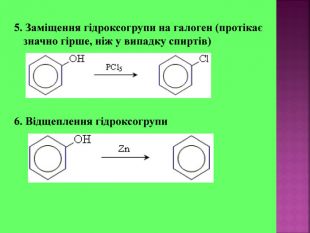
Презентаці "Спирти та феноли. Властивості, застосування"



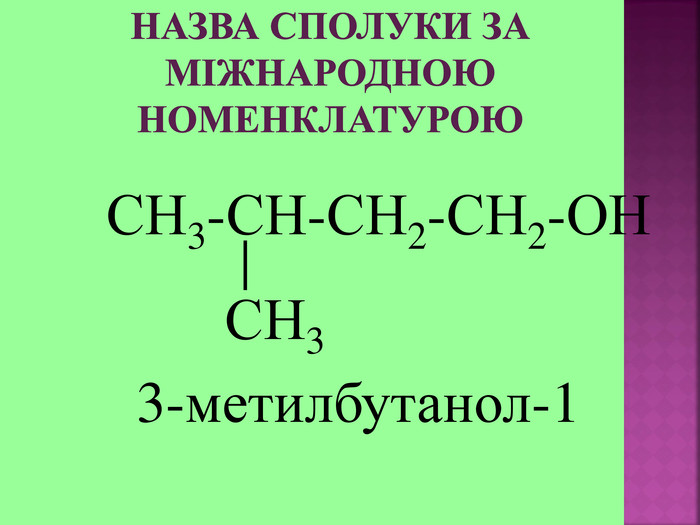
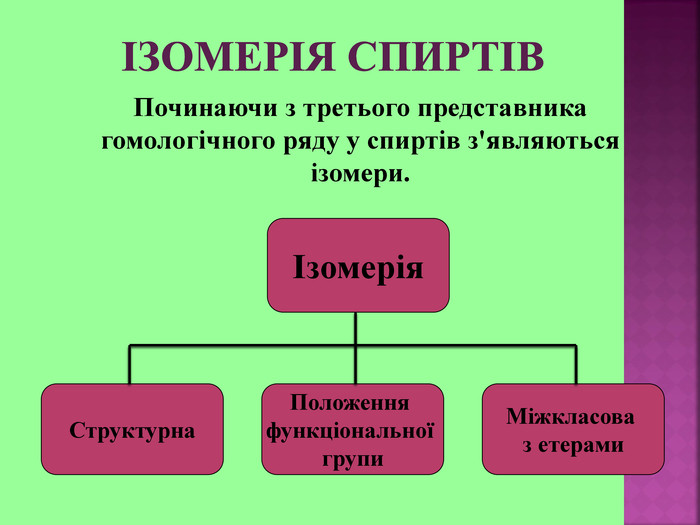
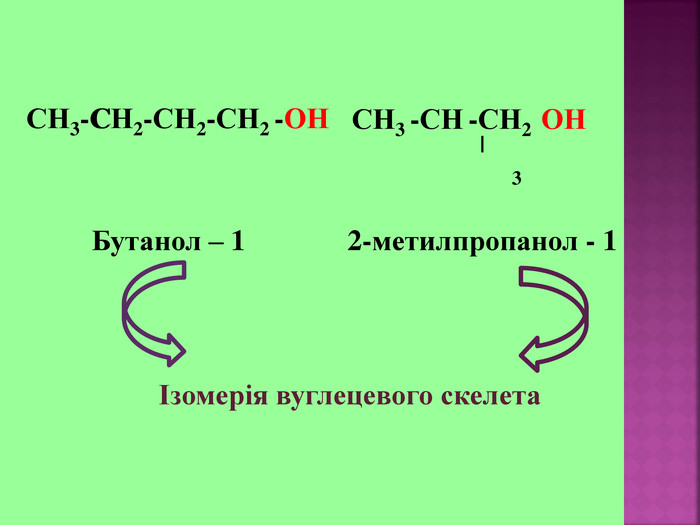
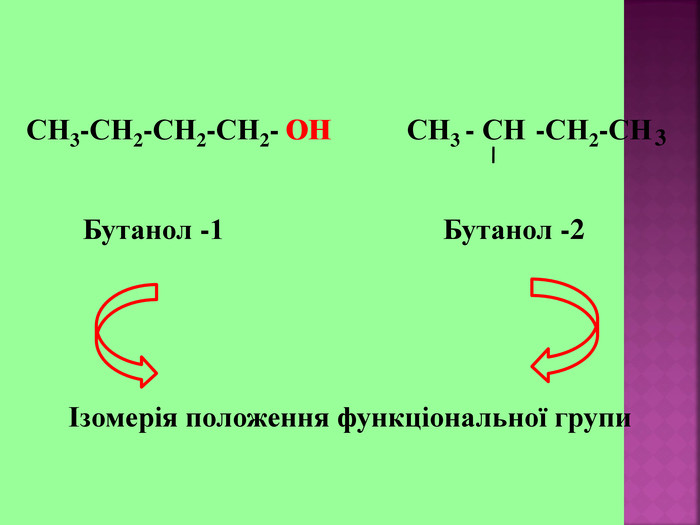
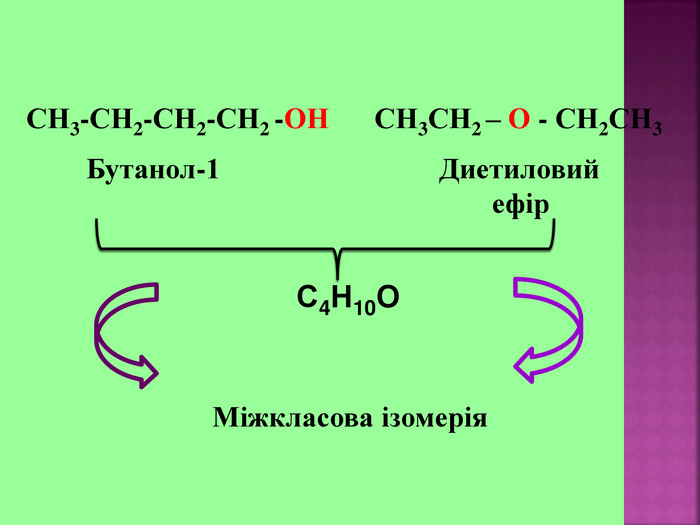




















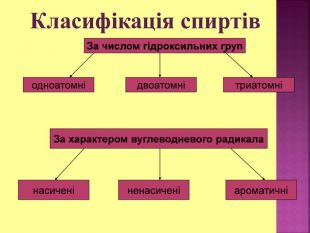
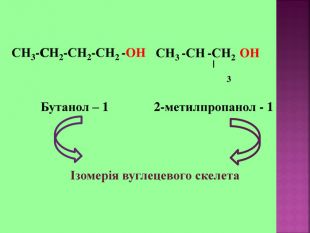
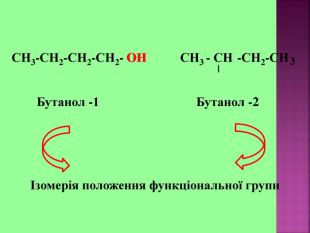
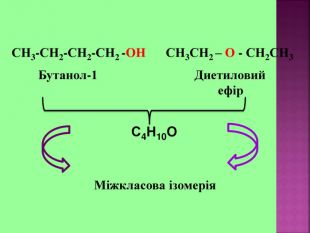
1.Обирають головний ланцюг атомів Карбону (найдовший); 2.Нумерацію атомів Карбону проводять, починаючи з краю, до якого ближче розташована гідроксогрупа; 3.Називають всі замісники в порядку від старшого до молодшого, попередньо вказуючи номери їх положень; 4.Називають головний ланцюг із додаванням суфікса “ол”; 5.Положення гідроксильної групи позначають після назви через дефіс арабською цифрою.
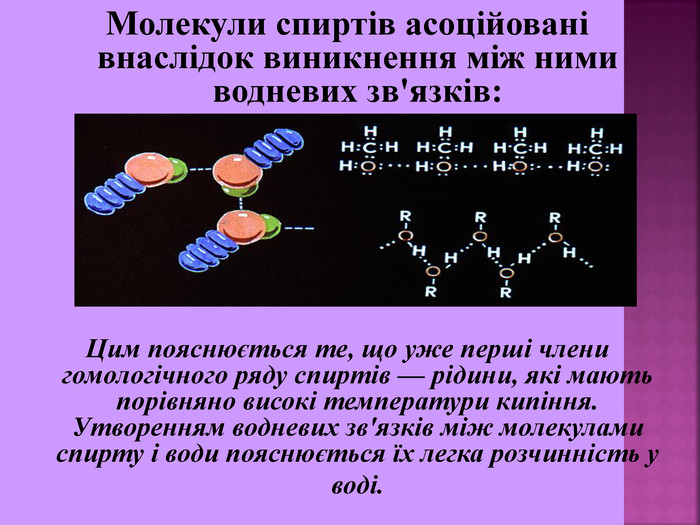
Молекули спиртів асоційовані внаслідок виникнення між ними водневих зв'язків: Цим пояснюється те, що уже перші члени гомологічного ряду спиртів — рідини, які мають порівняно високі температури кипіння. Утворенням водневих зв'язків між молекулами спирту і води пояснюється їх легка розчинність у воді.
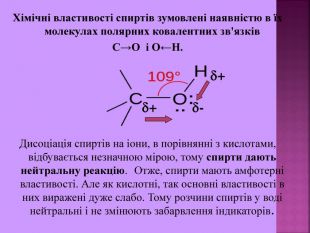
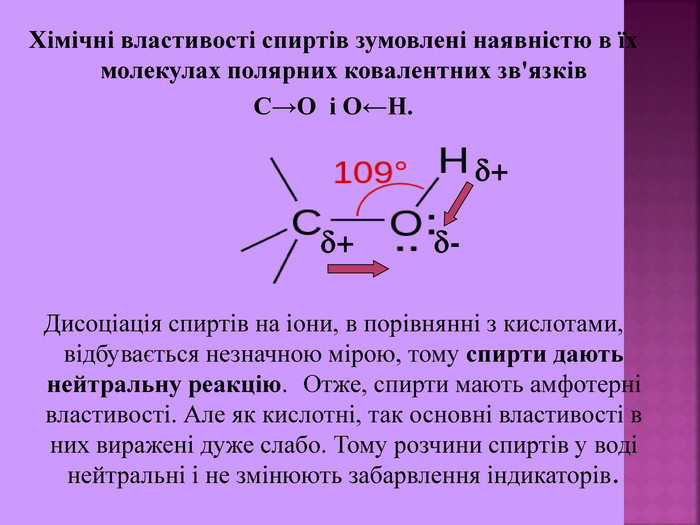
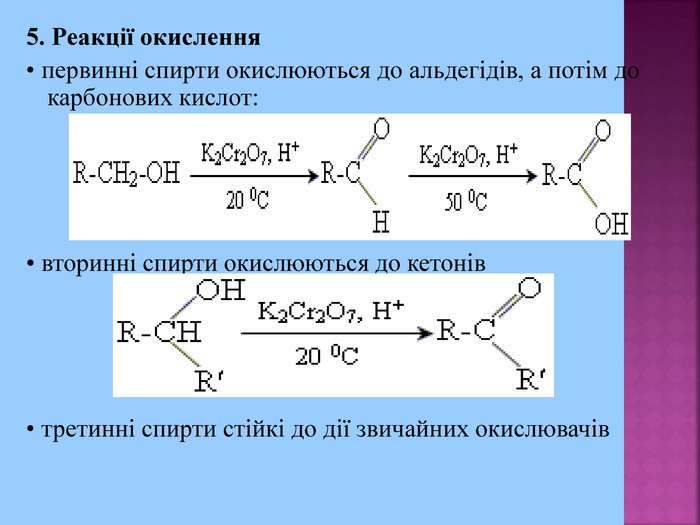
Хімічні властивості спиртів зумовлені наявністю в їх молекулах полярних ковалентних зв'язків С→О і О←Н. Дисоціація спиртів на іони, в порівнянні з кислотами, відбувається незначною мірою, тому спирти дають нейтральну реакцію. Отже, спирти мають амфотерні властивості. Але як кислотні, так основні властивості в них виражені дуже слабо. Тому розчини спиртів у воді нейтральні і не змінюють забарвлення індикаторів. + - +
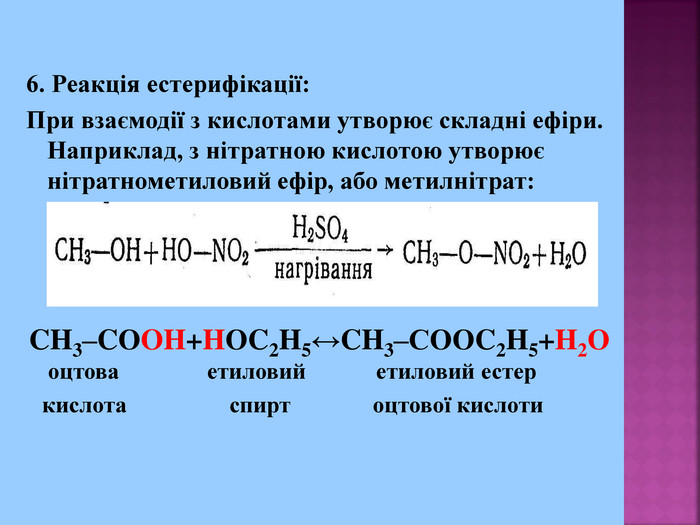
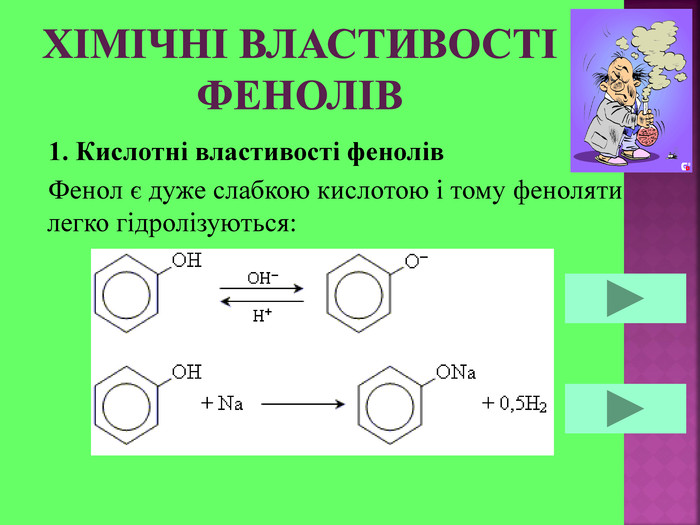
1. Кислотні властивості спиртів 2СH3CH2OH + 2Na = 2СH3CH2ONa + H2 При взаємодії з водою алкоголяти, метилового спирту, як і алкоголяти етилового спирту, легко гідролізують, утворюючи спирт і їдкий луг. Наприклад: CH3OK + H2O → CH3OH + KOH 2. Реакції з галогеноводнями (HCl, HBr) СH3–OH + HCl = СH3–Cl + H2O
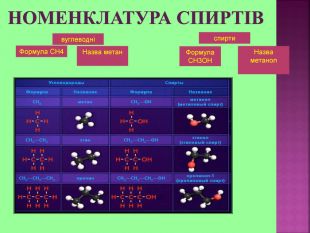
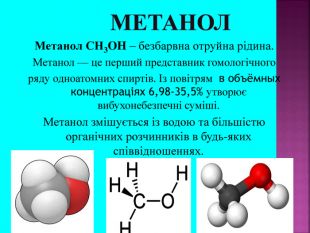
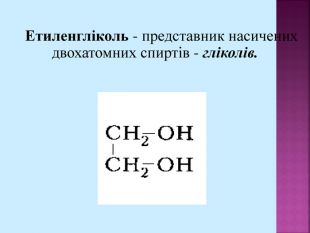
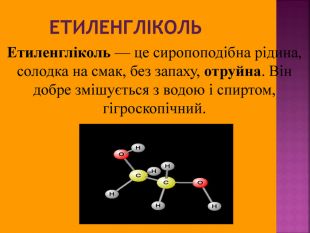
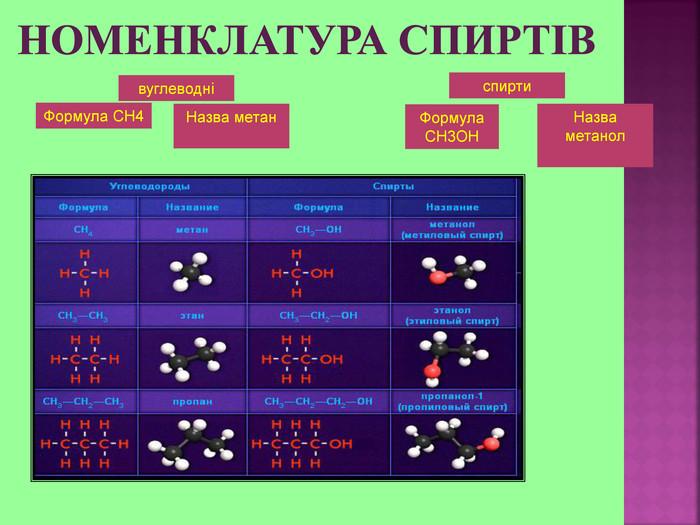
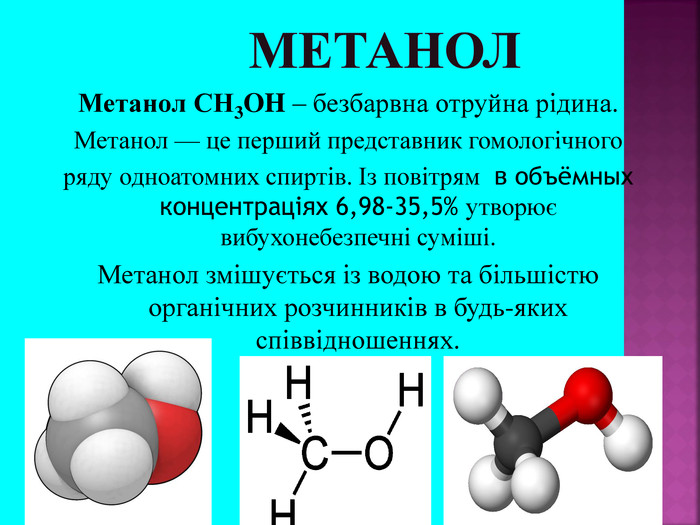
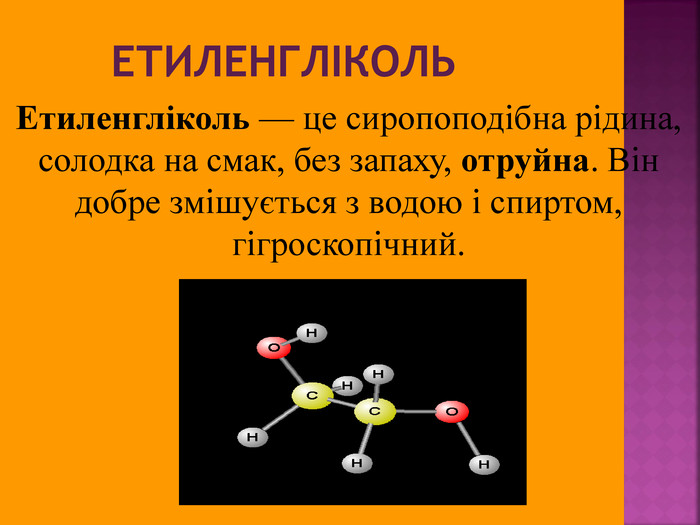
Метанол CH3OH – безбарвна отруйна рідина. Метанол — це перший представник гомологічного ряду одноатомних спиртів. Із повітрям в объёмных концентраціях 6,98-35,5% утворює вибухонебезпечні суміші. Метанол змішується із водою та більшістю органічних розчинників в будь-яких співвідношеннях.
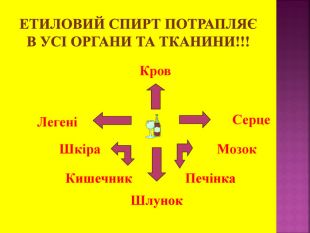
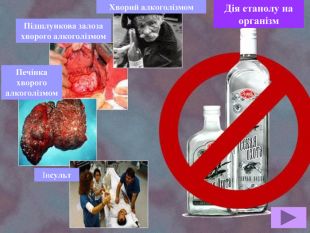
Метанол — отрута, що діє на нервову та серцево-судинну систему. Токсична дія метанолу зумовлена так званим «летальним синтезом» — метаболічним окисленням в організмі до отруйного формальдегіду. Особлива небезпека метанолу пов’язана з тим, що за запахом та смаком його не можливо відрізнити від етилового спирту.
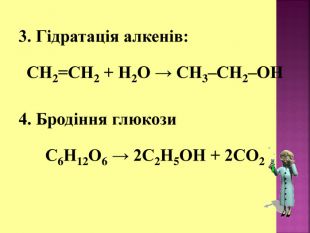
Етиловий спирт або винний спирт, або етанол, C2H5OH утворюється при бродінні вуглеводів- це безбарвна рідина із слабким «алкогольним» запахом. З водою змішується в будь-яких пропорціях. Етиловий спирт є гарним розчинником для багатьох органічних та неорганічних речовин, а також дуже важливим продуктом для потреб народного господарства. Етанол
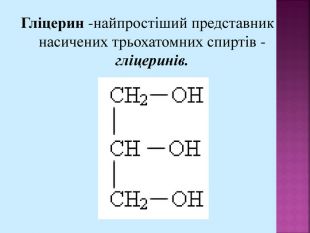
Велике значення має реакція взаємодії гліцерину з нітратною кислотою з утворенням нітрогліцерину: Нітрогліцерин - речовина, що відноситься до вазодилятаторів (розширювачів коронарних судин), що використовують для зняття гострих спазмів коронарних судин при стенокардії. СН – ОН СН2 – СН2 – ОН ОН СН – О СН2 – СН2 – О О HO-NO2 HO-NO2 HO-NO2 -NO2 -NO2 -NO2 + 3 H2O +
Основна: Бобівник Л.Д. та ін. Органічна хімія: Підручник для студентів вищих навчальних закладів – К.: Ірпінь: ВТФ “Перун”, 2002. – с. 228-265 Боєчко Ф.Ф., Найдан В.М., Захарик Д.М., Захарченко Н.М. Органічна хімія. – К.: Вища шакола, 1986. – с. 110-135 Юзефович Р.В. Методичні рекомендації для практичних занять з хімії для студентів вищих медичних навчальних закладів І-ІІ рівнів акредитації. – Кіровоград: Центрально-Українське видавництво, 2012. - с. 96-103 Додаткова: 1. Домбровський А.В., Лукашова Н.І. Хімія 10-11, – К.: Освіта, 1998. – 192 с. 2. Мороз А.С., Луцевіч Д.Д., Яворська Л.П. Медична хімія, – Вінниця: Нова книга, 2006. – 776 с. 3. Чернобельська Г.М., Чертков И.Н. Хімія, – М.: Медицина, 1993 Список необхідної літератури


про публікацію авторської розробки
Додати розробку