Урок «Швидкість хімічної реакції, залежність швидкості реакції від різних чинників»
Хімія
9 клас
Тема уроку: «Швидкість хімічної реакції, залежність швидкості реакції від різних чинників».
Мета: cформувати уявлення про швидкість хімічної реакції, її залежність від різних чинників, поглибити знання про каталізатори та їх вплив на швидкість реакції, розвивати вміння аналізувати інформацію, порівнювати, класифікувати, формулювати узагальнюючі висновки, застосовувати набуті знання на практиці та оцінювати результати виконаних дій, використовувати суб’єктивний досвід учнів, уміння висловлювати судження про роль хімічних процесів в природі та побуті, допомогти вихованню самостійності, співробітництва, здатності до взаємодопомоги, уважність, бережливе ставлення до хімічних реагентів і свого здоров’я.
Тип уроку: урок вивчення нового матеріалу.
Форма уроку: урок-дослідження.
Обладнання: Періодична система хімічних елементів Д.І.Менделєєва, таблиця електронегативностей хімічних елементів; штатив з пробірками; нагрівальні прилади хімічні склянки і колби.
Нові поняття і терміни: швидкість хімічної реакції, інгібітори, природа речовин, агрегатний стан, ступінь подрібнення, площа зіткнення, концентрація, каталізатор.
Хід уроку
- Організаційний момент.
Доброго дня шановні учні! Сьогоднішній урок буде сповнений цікавими фактами. Сподіваюсь , що він вам запам’ятається, і ви візьмете із нього все те, що вам знадобиться в майбутньому.
Гаслом уроку стануть слова Леонардо да Вінчі
« Знання, не перевірені дослідом, безплідні і мають багато помилок»
- Перевірка домашнього завдання.
Перш ніж приступити до вивчення нового матеріалу, перевіримо домашнє завдання (за підручником автора Попель):
№98: 1-в, 2-г, 3-б, 4-а.
№101: N2+3H2---2NH3 Це оборотна реакція, вона йде відразу у двох напрямках (пряма реакція і зворотна реакція).
- Актуалізація і корекція опорних знань учнів.
|
Запитання вчителя |
Очікуванні відповіді учнів |
|
1. На минулих уроках ви розглянули класифікації хімічних реакцій за різними ознаками. За якими? |
За кількістю речовин (реакції сполучення, розкладу, обміну, заміщення). За ступенем окиснення (окисно-відновні і не окисно-відновні). За тепловим ефектом реакції (ендотермічні та екзотермічні) За оборотністю (оборотні і необоротні). |
- Дайте визначення поняттю "Хімічна реакція" (хімічна реакція – це перетворення одних речовин на інші при незмінності ядер атомів).
- Які ознаки протікання хімічних реакцій? (Виділення або поглинання тепла, світла, електричної енергії; поява чи зникнення запаху, виділення газу, випадання осаду та інше).
- Повідомлення теми, мети, завдань уроку і мотивація навчальної діяльності.
Питання до класу:
1.Скажіть будь-ласка чим відрізняється черепаха від гепарда? Лелека від реактивного літака? Повільне окиснення від горіння та вибуху?
(Наприклад: У них різна швидкість руху)
А тепер за допомогою експерименту переконаємось, що швидкість може використовуватись і в хімії.
До експерименту вам завдання:
Спостерігаючи за експериментом зверніть увагу яка з реакцій відбувається найшвидше, а яка найповільніше.
Демонстрація.
Дослід 1. Горіння свічки.
Запалити свічку та звернути увагу на швидкість її горіння.
Дослід 2. Горіння порошку магнію
– Чи однакова швидкість горіння в обох випадках?
(Ні. магній згоряє швидше.)
Як ви вже здогадались тема нашого уроку "Швидкість хімічної реакції".
Сучасний світ уявити без продуктів хімічної промисловості практично неможливо. Будь-яке хімічне виробництво базується на певних хімічних реакціях. Закони економіки диктують необхідність розробки технологій дешевших, економічніших, з максимальним виходом продукту та найменшими витратами.
2. Складемо асоціативний кущ до поняття « хімічне виробництво»:
умови ↖ ↥ tº ↗ продукція
сировина ← Хімічне виробництво → інженери
апарати ↙ ↘екологія
Ми бачимо, яке багатогранне поняття «хімічне виробництво». І для того, щоб керувати хімічними процесами, треба знати закономірності протікання хімічних реакцій, умови, що впливають на їх проходження.
Отже тема нашого уроку є дуже актуальною.
Повідомляючи тему уроку наголошуємо, що на цьому уроці ми зможемо:
- робити висновки про вплив різних чинників на швидкість хімічних реакцій;
- пояснити чому продукти харчування зберігають в холодильнику?
Та поміркуємо з хімічної точки зору над словами: «Є тільки дві форми життя: гниття і горіння. Боягузи та жадібні оберуть першу, мужні та щедрі – другу.»
У ваших путівниках є таблиця заповніть першу колонку:
|
Що я знаю? |
Про що дізнався? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пропонуємо учням заповнити ліву частину таблиці.( Учні називають, вчитель записує на дошці). Далі говоримо, що наприкінці уроку дізнаємося, чи правильні твердження ми записали і що нове ми можемо дописати в праву частину таблиці.
- Сприймання і первинне усвідомлення нового матеріалу, осмислення зв`язків і відношень в об`єктах вивчення.
Чому одні хімічні реакції відбуваються миттєво, а інші тривають століттями? Відповіді на це запитання важливо знати для того, щоб керувати швидкістю хімічних перетворень, прискорювати корисні й уповільнювати шкідливі процеси.
VI. Вивчення нового матеріалу.
1. Поняття про швидкість реакції.
Вам вже відомо із курсу фізики, що, швидкість – це величина, яка чисельно дорівнює шляху, який проходить тіло за одиницю часу.
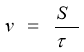 Запитуємо, як позначається швидкість і чому вона дорівнює з точки зору фізика.
Запитуємо, як позначається швидкість і чому вона дорівнює з точки зору фізика.
Але під час проходження хімічної реакції механічного переміщення не відбувається.
Проблема: То що ж характеризує швидкість в хімії? Спробуємо розібратись в цьому.
– Скажіть, будь ласка, швидко чи повільно відбуваються такі процеси:
а) Іржавіння заліза (повільно);
б) утворення мінералів в земній корі (повільно);
в) тверднення цементу (повільно);
г) вибух пороху (швидко);
д) спалах пари бензину в двигуні (швидко).
Проблемне питання: Що відбувається під час хімічної реакції?
Щоб розпочалася хімічна реакція, потрібен контакт між частинками реагентів.
Під час хімічної реакції частинки речовини рухаються і зустрічаються . Чим частіше зустрічаються частинки, тим більше утворюються нових частинок і тим швидше відбувається реакція.
Фактори, що впливають на швидкість реакції.
Водій керуючи автомобілем, використовує різні пристосування для зміни швидкості руху автомобіля (коробку передач, зчеплення, гальма, "газ"). Так і, щоб керувати хімічним процесом необхідно змінювати швидкість хімічної реакції. Які ж "пристосування" можна використати для зміни швидкості хімічної реакції? Швидкість хімічної реакції залежить від багатьох факторів. Розглянемо схему.
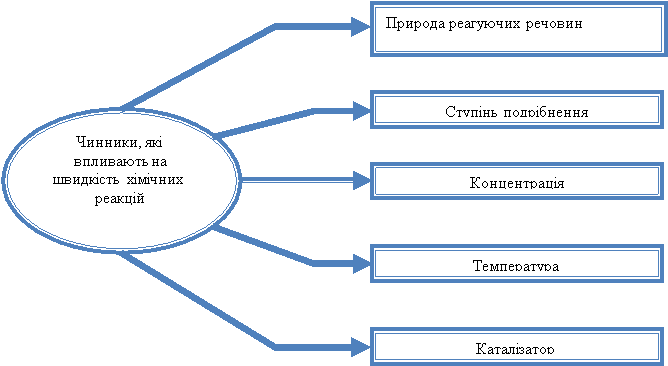
Зараз ми спробуємо подорожувати у хімічну лабораторію і ви практично під моїм керівництвом будете досліджувати хімічні реакції, але спочатку пригадаємо правила техніки безпеки під час роботи з обладнанням та реактивами
Техніка безпеки- це не жарт!
Правила поводження пам’ятати варто
Під час лабораторної роботи
І в побуті, щоб не було турботи, -
Як працювати з кислотою,
Штативом, склом та лугом…
І хімія тоді завжди
Буде вашим другом!
Лабораторний дослід №10 Вплив площі поверхні контакту реагентів, концентрації й температури на швидкість хімічної реакції.
Учні виконують лабораторну роботу згідно інструкції. Клас розділений на групи, в кожній групі є капітан. Кожна група виконує лише один дослід. Після виконання досліду учні оформляють звіт (див. Додаток 1) по своєму досліду, роблять висновки. Висновок кожної групи оголошує капітан. Члени іншої групи записують оголошені висновки у свої звіти. Форма проведення експерименту: робота в групах.
Інструктаж з правил безпеки при виконанні дослідів.
Завдання для групи №1. Дослід № 1. Як залежить швидкість хімічної реакції від природи реагуючих речовин?(Обговорення результатів).Спостереження: хімічна реакція йде у всіх трьох пробірках з виділенням газу. Швидкість виділення газу різна.
Проблема: Маси взятих металів, концентрація соляної кислоти, умови проведення реакції однакові, але при цьому інтенсивність проходження процесів (швидкість виділення водню) різна. Чому?
Висновок учнів: ми брали різні метали.
Учитель: Тобто ці речовини мають різну природу. Таким чином, швидкість хімічної реакції буде залежати від природи реагуючих речовин. Демонстрація положення хімічних елементів в «Ряду активності металів» .
Висновок. Учні: Швидкість хімічної реакції буде залежати від природи реагуючих речовин: чим активніше метал (речовина), тим більша швидкість хімічної реакції.
Завдання для групи №2. Дослід № 2. Залежність швидкості хімічної реакції від концентрації реагуючих речовин. (Обговорення результатів).Спостереження: хімічна реакція йде у всіх трьох пробірках, Рівняння реакції: Zn + 2НCl → ZnCl2 + Н2 ↑
Проблема: природа всіх реагуючих речовин, умови проведення досвіду однакові, проте інтенсивність проходження процесів (швидкість виділення водню) різна. Чому?
Учні: При додаванні води, ми змінили (зменшили) концентрацію соляної кислоти у другій і третій пробірках, при цьому інтенсивність виділення водню зменшувалася.
У січні 1967 року три американські космонавти загинули від пожежі, яка виникла в командному модулі їх корабля "Аполлон" під час тренувань. Тоді атмосфера в кабіні американських космічних кораблів складалась на 100% із кисню. Причиною пожежі стала випадкова іскра, яка призвела до займання пластмаси в кабіні командного модуля. Швидке поширення полум’я стало можливим через високу концентрацію кисню. Надалі космічні кораблі були розраховані на використання атмосфери із 60% кисню та 40% азоту.
Висновок: Швидкість хімічної реакції буде залежати від концентрації реагуючих речовин: чим більше концентрація реагуючих речовин, тим вище швидкість хімічної реакції.
Завдання для групи №3. Дослід № 3. Залежність швидкості хімічної реакції від температури . (Обговорення результатів).
Спостереження: ( учні коментують)
Рівняння реакції: CuO + 2НCl → Cu Cl2 + Н2О
Проблема:
Учитель: Всі взяті для експерименту речовини мають однакову природу, маса взятого порошку CuO і концентрація сірчаної кислоти також однакові, проте швидкість реакції різна. Чому?
За підвищенням температури хімічні реакції переважно пришвидшуються. Це зумовлено збільшенням вмісту активних молекул (чи інших структурних частинок у реакційній суміші). Натомість охолодження уповільнює взаємодію між реагентами. Саме тому харчові продукти довше зберігаються за низьких температур(тому що реакції розкладу сповільнюються).
Під час проведення деяких операцій на серці та мозку пацієнтів охолоджують для того що сповільнити реакції, які відбуваються в організмі людини.
Висновок: При підвищенні температури реакції швидкість реакції зростає.
Завдання для групи № 4. (Обговорення результатів).
Дослід № 4. Залежність швидкості хімічної реакції від площі поверхні зіткнення реагуючих речовин (ступеня подрібнення).
Спостереження: хімічна реакція йде у обох пробірках з виділенням газу, але з різною інтенсивністю.
Проблема Всі речовини однакові по своїй хімічній природі, однакові за масою і концентрацією, реагують при однаковій температурі, однак інтенсивність виділення водню (а отже і швидкість реакції ) різна. Чому? Висновки
Учні: Залізо в обох пробірках має різну ступінь подрібнення. Там де цей ступінь подрібнення більший - швидкість виділення водню більша.
Висновок: Швидкість хімічної реакції залежить від площі зіткнення реагуючих речовин: чим більше площа зіткнення реагуючих речовин (ступінь подрібнення), тим більше швидкість реакції.
Дослід № 5. Розкладання гідроген пероксиду в присутності каталізатора.
ВІДЕОДЕМОНСТРАЦІЯ: Розклад гідроген пероксиду в присутності каталізатора.
Каталізатор – це речовина, яка впливає на швидкість реакції, але сама при цьому залишається незмінною на кінець реакції.
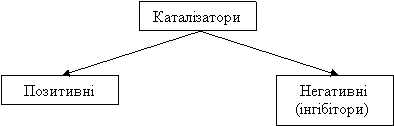 Каталізатор – це речовина яка впливає на швидкість реакції але сама при цьому залишається незмінною.
Каталізатор – це речовина яка впливає на швидкість реакції але сама при цьому залишається незмінною.
Позитивні каталізатори збільшують швидкість реакції, а негативні – зменшують.
Як саме впливають каталізатори на швидкість реакції вияснимо з експерименту.
За інтенсивністю виділення газу порівняйте швидкість розкладу гідроген пероксиду в обох пробірках.
![]()
Зробіть висновок про вплив каталізатора на швидкість реакції.
Механізми дії каталізаторів до кінця не з’ясовані. Існує велика кількість теорій про те яким саме чином діють каталізатори. Вчені до цих пір працюють над цим питанням. Можливо хтось із вас в майбутньому відкриє цей механізм, й одержить невеличку, розміром у 1,5 млн. доларів, нобелівську премію. Не для всіх реакцій використовують каталізатор. Для кожної каталітичної реакції існує свій каталізатор. Каталізатори досить поширені в живій природі. Такі каталізатори називають ферментами. За їх участю відбуваються реакції в клітинах живих організмів, перетравлення їжі в шлунку та інше.
Каталізатори використовують майже на кожному хімічному виробництві: виробництво сульфатної кислоти, аміаку та інші. Каталізатори використовують у фільтрах призначених для очистки викидів від шкідливих газів (платинові фільтри вихлопних газів автомобілів).
VII. Узагальнення і систематизація знань, застосування їх в різних ситуаціях.
1.Аналізуємо ліву частину таблиці «Я знаю», заповнену на початку уроку, і дописуємо праву частину – «Про що дізнався».
2. Задача-прогноз: Для дослідження реакції цинку з кислотою Петро взяв хлоридну кислоту, а Галинка – оцтову такої самої концентрації. Спрогнозуйте, у якому випадку реакція відбудеться швидше.
3.Що швидше розчиняється в чаєві: цукор-пісок чи грудка цукру? (цукор- пісок).
4. Самостійна робота із взаємоперевіркою.
- Підведення підсумків уроку і домашнє завдання.
Отже, ми вже можемо дати відповіді на поставленні питання на початку уроку:
- Які ж чинники впливають на швидкість хімічних реакцій?
- чому продукти харчування зберігають в холодильнику?
Міркування дітей над словами: «Є тільки дві форми життя: гниття і
горіння. Боягузи та жадібні оберуть першу, мужні та щедрі – другу».
Гниття і горіння – процес окиснення, що відбувається з різною швидкістю і якістю. Доречно пригадати стародавній закон лікарів: «Светя другим - згораю»(російською мовою).
IX.Домашнє завдання
Прочитати § 17 (Попель П.П., Крикля Л.С. Хімія - 9), с.103 №133-137.
Як варіант домашнього завдання:
За допомогою мережі Інтернет розробіть пам`ятку для тих, хто збирається у похід:
Які продукти харчування краще брати з собою і чому?
- Як доцільніше зберігати продукти?
Додаток № 1 Звіт по лабораторному досліді
Лабораторна робота.
Вплив площі поверхні контакту реагентів, концентрації й температури на швидкість хімічної реакції.
Неухильно виконуйте правила техніки безпеки
Завдання №1. Дослід № 1. Як залежить швидкість хімічної реакції від природи реагуючих речовин ?(Обговорення результатів).
Обладнання та реактиви: розчин НCl, Mg (смужка), Zn (гранули ), Fe ( кусочки).
Хід роботи:
У три пронумеровані пробірки долити по 1 мл розчину НCl і в кожну з пробірок додати приблизно однакову масу металів: у першу - Mg, у другу - Zn, в третю - Fe;
|
№ пробірки |
Рівняння реакції |
Швидкість виділення газу |
|
№ 1 |
|
|
|
№ 2 |
|
|
|
№ 3 |
|
|
Висновок: __________________________________________________________________________
Лабораторна робота.
Вплив площі поверхні контакту реагентів, концентрації й температури на швидкість хімічної реакції.
Неухильно виконуйте правила техніки безпеки
Завдання для групи №3. Дослід № 2. Залежність швидкості хімічної реакції від концентрації реагуючих речовин. (Обговорення результатів).
Обладнання та реактиви: 10 % розчин НCl, дистильована вода, гранули цинку.
Хід роботи:
У три пронумеровані пробірки долити по 1 мл 10 % розчину соляної кислоти (НCl), а потім долити дистильованої води (тим самим розбавляємо розчин) в пробірку № 1 - 2 мл, в пробірку № 2 -1 мл, в пробірку № 3 – не добавляти. У кожну з пробірок опустити по гранулі Zn (приблизно однакового розміру).
|
№ пробірки |
Рівняння реакції |
Швидкість виділення газу |
|
№ 1 |
|
|
|
№ 2 |
|
|
|
№ 3 |
|
|
Висновок: __________________________________________________________________________
Лабораторна робота.
Вплив площі поверхні контакту реагентів, концентрації й температури на швидкість хімічної реакції.
Неухильно виконуйте правила техніки безпеки
Завдання для групи №4. Дослід № 3. Залежність швидкості хімічної реакції від температури . (Обговорення результатів).
Обладнання та реактиви: 10 % розчин Н2SO4, порошок CuO, склянка з гарячою водою, спиртівка, тримач, пробірки № 1, № 2, № 3.
Хід роботи:
У три пронумеровані пробірки налити по 1 мл розчину сульфатної кислоти (Н2SO4) . У кожну помістити наважку Купрум (II) оксиду (CuO) (порошок). Першу пробірку залишити у штативі; другу - опустити в склянку з гарячою водою; третю - нагріти в полум'ї спиртівки.
|
№ пробірки |
Рівняння реакції |
Зміна забарвлення |
|
№ 1 |
|
|
|
№ 2 |
|
|
|
№ 3 |
|
|
Висновок: __________________________________________________________________________
Лабораторна робота.
Вплив площі поверхні контакту реагентів, концентрації й температури на швидкість хімічної реакції.
Неухильно виконуйте правила техніки безпеки
Завдання для групи № 4. (Обговорення результатів).
Дослід № 2. Залежність швидкості хімічної реакції від площі поверхні зіткнення реагуючих речовин (ступеня подрібнення).
Обладнання та реактиви: розчин НCl, кусочок Fe, порошок Fe; пробірки № 1, № 2.
Хід роботи:
У дві пронумеровані пробірки долити по 1 мл розчину HCl, і додати в першу – кусочок Fe, у другу – порошок Fe (однакові за масою).
|
№ пробірки |
Рівняння реакції |
Швидкість виділення газу |
|
№ 1 |
|
|
|
№ 2 |
|
|
Висновок: __________________________________________________________________________


про публікацію авторської розробки
Додати розробку
